Углеводы Химия 10 класс. Углеводы. Общей формулой Сn Н
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
|
Углеводы Углеводы — обширный класс природных соединений, которые играют важную роль в жизни человека, животных и растений. Название ≪углеводы≫ эти соединения получили потому, что состав многих из них выражается общей формулой Сn(Н2O )m , т. е. они формально являются соединениями углерода и воды. Биологическая роль Углеводы относятся к числу наиболее распространенных в природе органических соединений: они являются компонентами клеток всех растительных и животных организмов. Углеводы образуются растениями в процессе фотосинтеза: 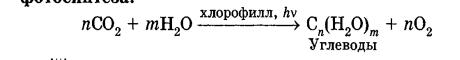 Животные не способны сами синтезировать углеводы и используют углеводы,- синтезируемые растениями. Углеводы составляют значительную долю пищи млекопитающих. В процессах дыхания происходит окисление углеводов, в результате чего выделяется энергия, необходимая для функционирования живых организмов: При полном окислении 1 г углеводов освобождается 17,6 кДж энергии. Некоторое количество выделяющейся энергии превращается в тепло, а большая часть ее аккумулируется в АТФ и затем расходуется в процессах жизнедеятельности. Функции углеводов в живых организмах разнообразны. Они служат источником запасной энергии (в растениях — крахмал, в животных организмах — гликоген). В растительных организмах углеводы являются основой клеточных мембран. В качестве одного из структурных компонентов остатки углеводов входят в состав нуклеиновых кислот. Классификация углеводов Все углеводы можно разделить на две группы: простые углеводы, или моносахариды, и сложные углеводы. Простые углеводы (моносахариды) — это простейшие углеводы, не гидролизующиеся с образованием более простых углеводов. Сложные углеводы — это углеводы, молекулы которых состоят из двух или большего числа остатков моносахаридов и разлагаются на эти моносахариды при гидролизе. МОНОСАХАРИДЫ Моносахариды представляют собой соединения со смешанными функциями. Они содержат альдегидную или кетогруппу и несколько гидроксильных групп, т. е. являются альдегидоспиртами или кетоноспиртами. Следовательно, углеводы являются полигидроксикарбонильными соединениями. Моносахариды с альдегидной группой называются альдозами, с кетогруппой — кетозами. По числу углеродных атомов в молекуле моносахариды делятся на тетрозы, пентозы, гексозы и т. д. Классификация моносахаридов Альдозы и кетозы с одинаковым числом атомов углерода изомерны между собой. Наибольшее значение среди моносахаридов имеют гексозы и пентозы. 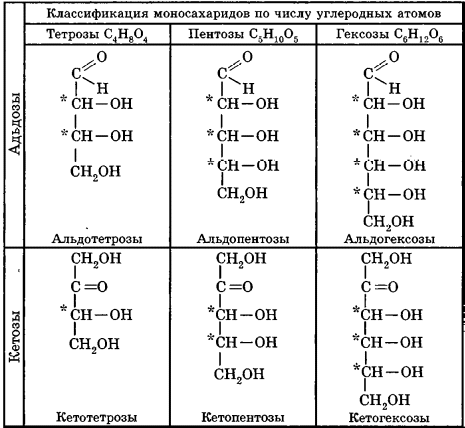 Структура моносахаридов Для изображения строения моносахаридов используют проекционные формулы Фишера. В формулах Фишера цепь углеродных атомов располагается в одну линию. Нумерация цепи начинается с атома углерода альдегидной группы (в случае альдоз) или с крайнего атома углерода, к которому ближе располагается кетогруппа (в случае кетоз). Атомы водорода и группы -ОН у асимметрических атомов «С» располагаются слева и справа от углеродной цепи. В зависимости от пространственного расположения атомов «Н» и ОН-групп у 4-го атома углерода у пентоз и 5-го атома углерода у гексоз моносахариды относят к D- или L-ряду. Моносахарид относят к D-ряду, если ОН-группа у этих атомов располагается справа от цепи: 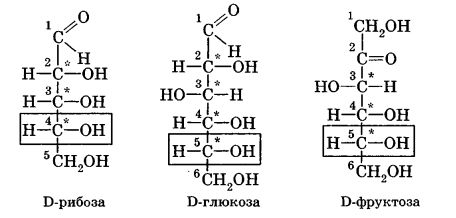 Почти все встречающиеся в природе моносахариды относятся к D-ряду. Для перехода от моносахарида D-ряда к моносахариду L-ряда нужно изменить конфигурацию всех асимметрических углеродных атомов на противоположную: 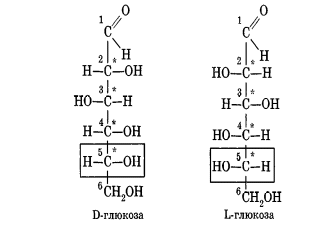 Рассмотренные выше структуры моносахаридов являются ациклическими. Однако моносахариды могут существовать также в циклических формах. Циклические формы образуются в результате взаимодействия карбонильной группы и одной из гидроксильных групп с образованием внутренних полуацеталей. Образование циклической формы глюкозы из альдегидной – это своеобразный химический акт, обусловленный наличием различных функциональных групп, которые могут взаимодействовать между собой. Альдегидная группа может приблизиться к спиртовой группе, так как атом кислорода карбонильной группы несет на себе частичный отрицательный заряд, а атом водорода спиртовой группы – частичный положительный заряд. При сближении этих двух функциональных групп происходит разрыв π-связи карбонильной группы, к атому кислорода присоединяется атом водорода (образовалась новая гидроксильная группа), а атом кислорода спиртовой группы с атомом углерода замыкают цикл. 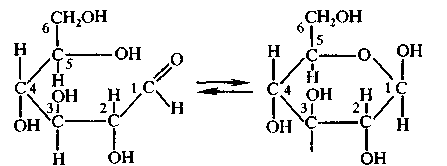 В растворах моносахаридов происходит миграция атома водорода между гидроксо- и карбонильной группой, при этом устанавливается подвижное равновесие между ациклической и циклической формами. Подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами) называется таутомерией. Циклические формы принято изображать перспективными формулами Хеуорса. Молекула стремится к минимуму энергии. В молекуле глюкозы этот минимум достигается, когда ОН-группы находятся по разные стороны от плоскости кольца, чтобы не было их взаимного отталкивания В том случае, когда новая ОН-группа находится под плоскостью цикла, образуется α-форма глюкозы, если над плоскостью – β-форма 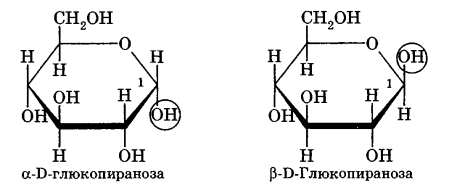 Биологически важной альдогексозой является также D-галактоза. Структурным отличием молекулы D-галактозы от молекулы D-глюкозы является положение ОН-группы у 4-го атома углерода: в молекуле галактозы она располагается слева от углерод-углеродной цепи. Как и глюкоза, галактоза существует в виде нескольких таутомерных форм: 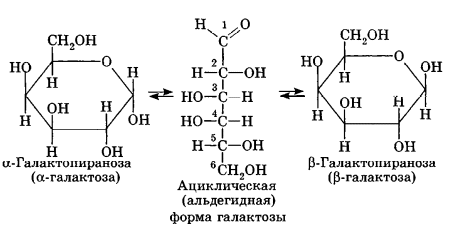 Важнейшей кетогексозой является D-фруктоза (изомер D-глюкозы). Для циклических форм фруктозы характерны фуранозные структуры. Фуранозный цикл образуется в результате взаимодействия карбонильной (кетонной) группы со спиртовой группой при 5-м углеродном атоме. 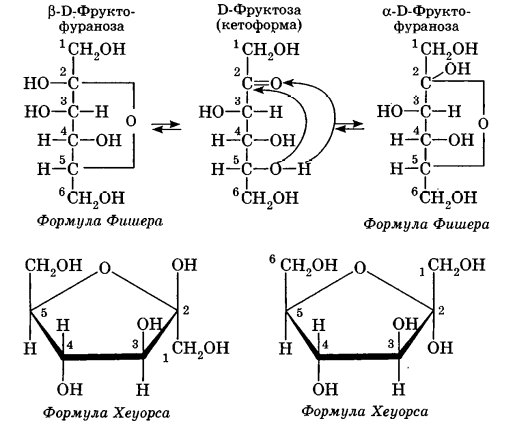 Среди пентоз наиболее известны D-рибоза и ее производное 2-дезокси-D-рибоза, у которой нет гидроксильной группы при втором углеродном атоме. Эти моносахариды входят в состав рибо- и дезоксирибонуклеиновых кислот (РНК и ДНК) в фуранозной форме. 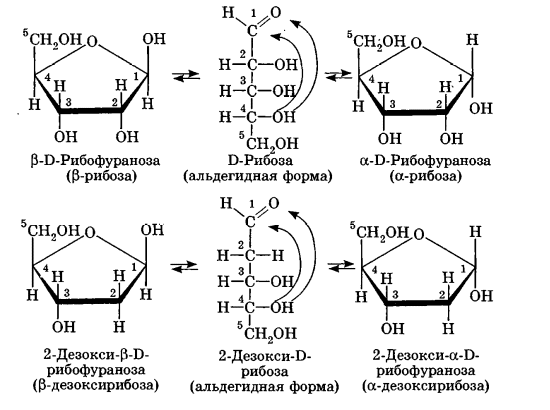 Физические свойства Моносахариды представляют собой бесцветные кристаллические вещества, сладкие на вкус, хорошо растворимые в воде, нерастворимые в эфире, плохо растворимые в спирте. Сладость моносахаридов различна. Например, фруктоза слаще глюкозы в три раза. Химические свойства Моносахариды — это соединения со смешанными функциями. В растворах существует динамическое равновесие между несколькими таутомерными формами моносахаридов, поэтому в зависимости от условий и реагентов они могут реагировать в открытой или циклической форме. При этом равновесие смещается в сторону образования той формы, которая вступает во взаимодействие. Химические свойства моносахаридов обусловлены наличием: а) карбонильной группы в открытых формах моносахаридов; б) спиртовых гидроксильных групп как в открытых, так и в циклических формах моносахаридов; в) полуацетальной гидроксильной группы в циклических формах моносахаридов. Рассмотрим химические свойства моносахаридов на примере важнейшего из них — глюкозы. /. Реакции с участием альдегидной группы глюкозы (т.е. свойства глюкозы как альдегида) 1. Восстановление (гидрирование) с образованием многоатомного спирта: 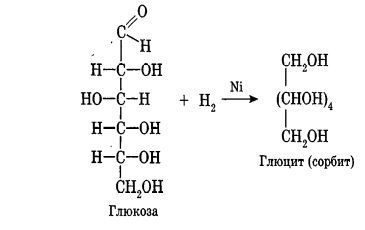 В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа 2. Окисление Глюкоза легко окисляется. В зависимости от характера окислителей получаются различные продукты. 1) Окисление под действием слабых (мягких) окислителей с образованием глюконовой кислоты. К числу таких реакций относятся качественные реакции на глюкозу как альдегид: реакция с аммиачным раствором оксида серебра (I) Ag2O (реакция «серебряного зеркала») и реакция с гидроксидом меди (II) Сu(ОН)2 в щелочной среде при нагревании:  В ходе этих реакций альдегидная группа -СНО окисляется до карбоксильной группы -СООН. 2) Окисление под действием сильных окислителей (например, азотной кислоты) с образованием двухосновной глюкаровой кислоты: 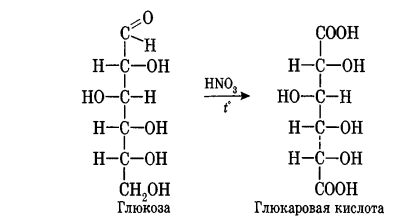 В ходе этой реакции и альдегидная группа -СНО и первичная спиртовая группа -СН2ОН окисляются до карбоксильных групп -СООН. II. Реакции глюкозы с участием гидроксильных групп(т. е. свойства глюкозы как многоатомного спирта) 1. Взаимодействие с Си(ОН)2на холоду с образованием глюконата меди (II) (качественная реакция на глюкозу как многоатомный спирт): 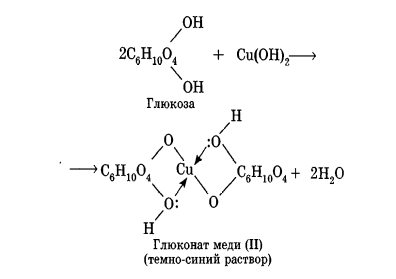 2. Взаимодействие с ангидридами или галогенангидридами кислот с образованием сложных эфиров: 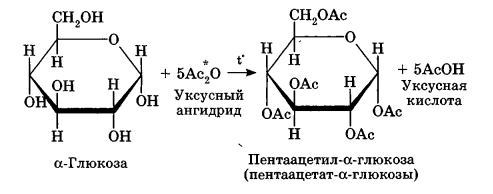 3. Взаимодействие с галогеналканами с образованием простых эфиров: 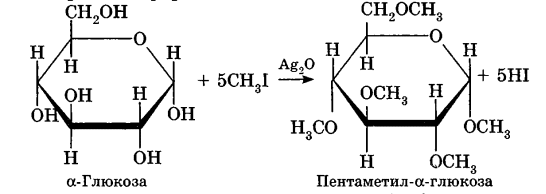 Реакция происходит в присутствии Аg2O для связывания выделяющегося при реакции НI. 4. Взаимодействие со спиртами с образованием гликозидов. Гликозиды — это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения. В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной. 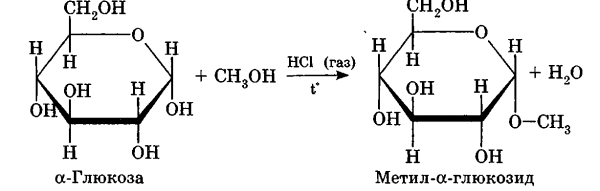 В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют. Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы связаны остатки самых различных соединений. III. Брожение (ферментация) моносахаридов Брожение — это расщепление моносахаридов под влиянием биологических катализаторов — ферментов, вырабатываемых микроорганизмами. Разные микроорганизмы вызывают различные виды брожения. Название вида брожения определяется названием образующихся продуктов брожения. Брожение — сложный многостадийный биохимический процесс. Ниже приводятся лишь суммарные уравнения различных типов брожения глюкозы.  Получение и применение глюкозы В промышленности глюкозу получают гидролизом крахмала и целлюлозы. 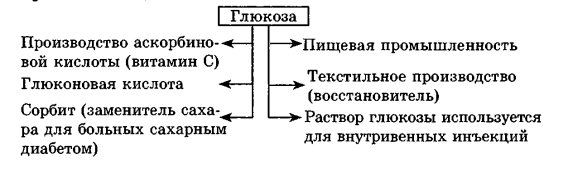 СЛОЖНЫЕ УГЛЕВОДЫ Олигосахариды — низкомолекулярные сахароподобные углеводы, содержащие от двух до десяти остатков моносахаридов (обычно гексоз), соединенных гликозидными связями. Простейшими из них являются дисахариды. Дисахариды Дисахариды — продукты конденсации двух моносахаридов. Важнейшие природные представители: сахароза (тростниковый или свекловичный сахар), мальтоза (солодовый сахар), лактоза (молочный сахар), целлобиоза. Все они имеют одну и ту же эмпирическую формулу С12Н22О11, т. е. являются изомерами. Физические свойства Дисахариды — типичные сахароподобные углеводы; это твердые кристаллические вещества, хорошо растворимые в воде, имеющие сладкий вкус. Строение 1. Молекулы дисахаридов могут содержать два остатка одного моносахарида или два остатка разных моносахаридов. 2. Связи, образующиеся между остатками моносахаридов, могут быть двух типов: а) Связь, в образовании которой принимают участие полуацетальные гидроксилы обеих молекул моносахаридов. Например, образование молекулы сахарозы: 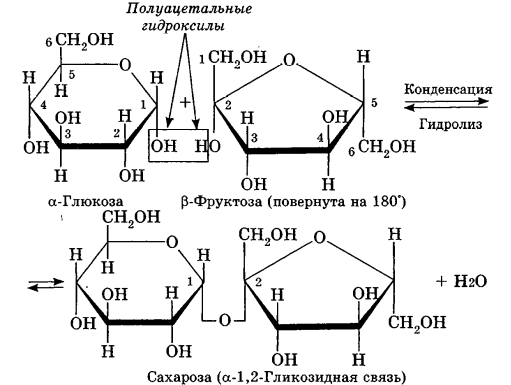 б) Связь, в образовании которой принимают участие полуацетальный гидроксил одного моносахарида и спиртовый гидроксил другого моносахарида. Например, образование молекул мальтозы, лактозы и целлобиозы: 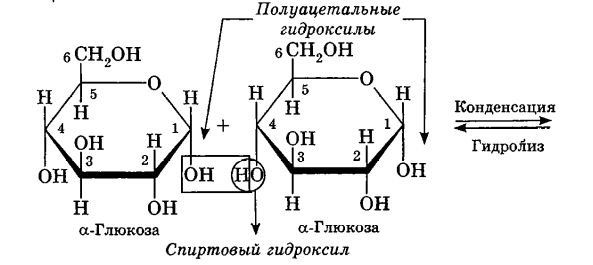 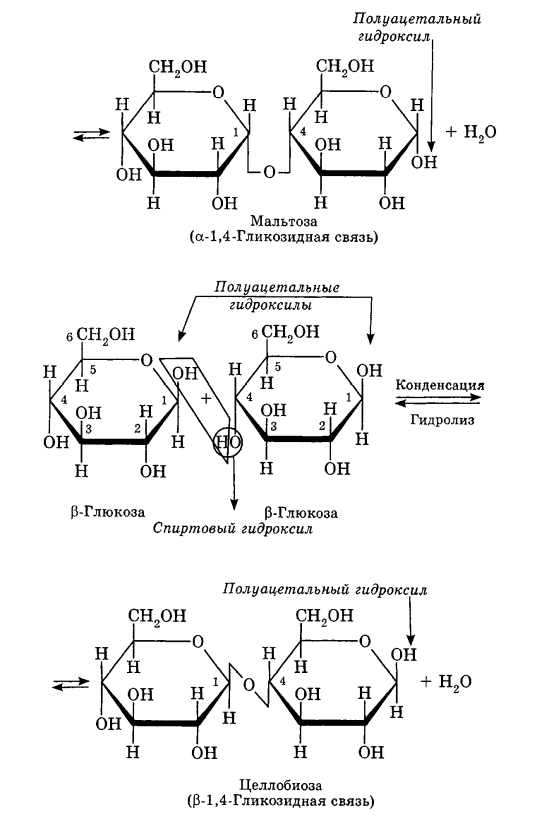 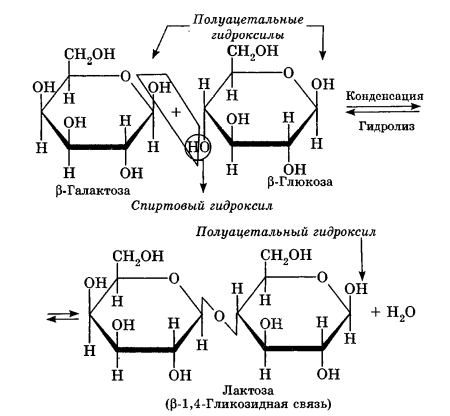 Отсутствие или наличие в молекулах дисахаридов полуацетального гидроксила существенно отражается на их свойствах. Химические свойства дисахаридов 1. Дисахариды, в молекулах которых сохраняется полуацетальный гидроксил (мальтоза, лактоза, целлобиоза), в растворах частично превращаются в открытые альдегидные формы и вступают в реакции, характерные для альдегидов, в частности в реакцию «серебряного зеркала». Такие дисахариды называются восстанавливающими (восстанавливают Сu(ОН)2 и Аg2O). Дисахариды, в молекулах которых нет полуацетального гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими. 2. Все дисахариды являются многоатомными спиртами, для них характерны свойства многоатомных спиртов (образование простых и сложных эфиров), они дают качественную реакцию на многоатомные спирты: 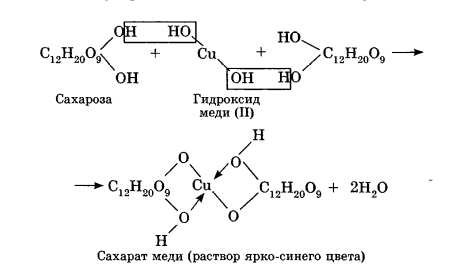 3. Все дисахариды гидролизуются с образованием моносахаридов: В живых организмах гидролиз идет под действием ферментов. Полисахариды Полисахариды — высокомолекулярные несахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (обычно гексоз), связанных гликозидными связями. Важнейшие природные представители: крахмал, гликоген, целлюлоза. Это природные полимеры (ВМС), мономером которых является глюкоза. Их общая эмпирическая формула (С6Н10О5)n. Крахмал Аморфный порошок белого цвета, без вкуса и запаха, плохо растворим в воде, в горячей воде образует коллоидный раствор. Макромолекулы крахмала построены из большого числа остатков а-глюкозы. Крахмал состоит из двух фракций: амилозы и амилопектина. Соотношение между амилозой и амилопектином в крахмалах разных растений различно. В среднем содержание амилозы – 20-30%, амилопектина – 70-80%. Амилоза Молекулы амилозы — это очень длинные неразветвленные цепи, состоящие из остатков а-глюкозы: 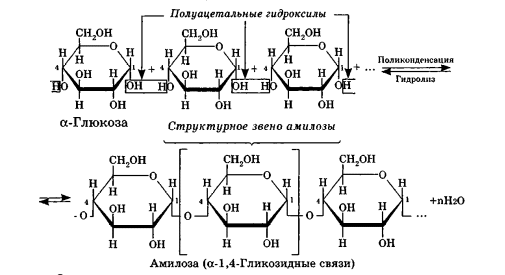 Относительная молекулярная масса молекул амилозы колеблется от 60 до 500 тыс. Но молекулы имеют очень компактное строение, так как закручены в спираль, на виток спирали приходится 6—7 остатков а-глюкозы. Амилопектин Молекулы амилопектина, в отличие от молекул амилозы, сильно разветвлены. Подавляющее большинство глюкозных остатков в амилопектине связаны, как и в амилозе, а-1,4-гликозидными связями. Однако в точках разветвлений цепи имеются а-1,6-гликозидные связи. Число глюкозных остатков в молекулах амилопектина значительно выше, относительная молекулярная масса колеблется от 100 тыс. до 1 млн. Молекулы амилопектина также довольно компактны, так как имеют сферическую форму. 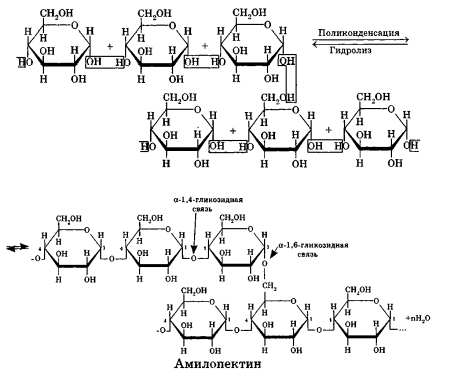 Химические свойства крахмала 1. Гидролиз крахмала Процесс гидролиза идет ступенчато, схематически его можно изобразить так: 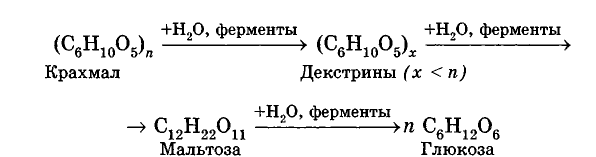 Реакцию превращения крахмала в глюкозу при каталитическом действии серной кислоты открыл в 1811 г. русский ученый К. Кирхгоф (реакция Кирхгофа). 2. Качественная реакция на крахмал 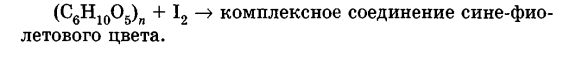 При нагревании окрашивание исчезает (комплекс разрушается), при охлаждении появляется вновь. 3. Большинство глюкозных остатков в молекулах крахмала имеют по 3 свободных гидроксила (у 2, 3 и 6-го атомов углерода), в точках разветвления — у 2-го и 3-го атомов углерода. Следовательно, для крахмала возможны реакции, характерные для многоатомных спиртов, в частности образование простых и сложных эфиров. Однако эфиры крахмала большого практического значения не имеют. Качественную реакцию на многоатомные спирты крахмал не дает, так как плохо растворяется в воде. Применение крахмала Крахмал применяется в кондитерском производстве (получение глюкозы и патоки), является сырьем для производства этилового, н-бутилового спиртов, ацетона, лимонной кислоты, глицерина и т. д. Он используется в медицине в качестве наполнителей (в мазях и присыпках), как клеящее средство. Биологическая роль крахмала. Гликоген Крахмал — один из продуктов фотосинтеза, главное запасное питательное вещество растений. Остатки глюкозы в молекулах крахмала соединены достаточно прочно и в то же время под действием ферментов легко могут отщепляться, как только возникает потребность в источнике энергии. Гликоген — это эквивалент крахмала, синтезируемый в животном организме, т. е. это тоже резервный полисахарид, молекулы которого построены из большого числа остатков а-глюкозы. Содержится гликоген главным образом в печени и мышцах. По своему строению он очень близок амилопектину. Отличие гликогена от амилопектина: 1. Содержит большее число остатков а-глюкозы, относительная молекулярная масса колеблется от 1 до 15 млн. 2. Молекулы гликогена более разветвленные и вследствие этого более плотные. Гликоген — белый аморфный порошок, хорошо растворяется даже в холодной воде, легко гидролизуется под действием кислот и ферментов, образуя в качестве промежуточных веществ декстрины, мальтозу и при полном гидролизе — глюкозу. Превращение крахмала в организме человека и животных: 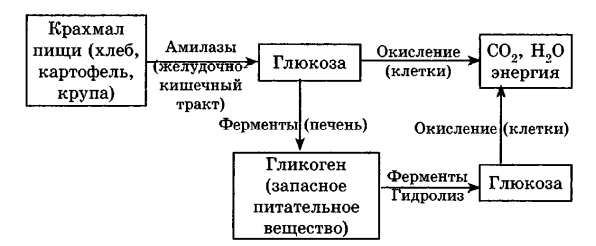 Целлюлоза, или клетчатка Главная составная часть растительной клетки, синтезируется в растениях (в древесине до 60% целлюлозы). Чистая целлюлоза — белое волокнистое вещество, без вкуса и запаха, нерастворимое в воде. Молекулы целлюлозы — это длинные цепи, состоящие из остатков (3-глюкозы, которые соединяются за счет образования (3-1,4-гликозидных связей: 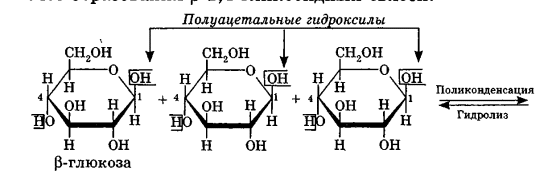 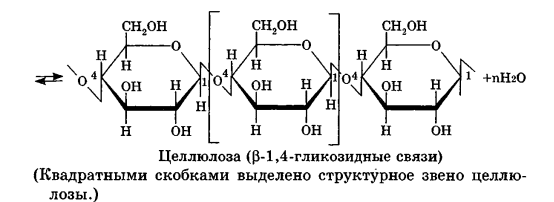 Различия в строении и свойствах крахмала и целлюлозы 1. Содержат остатки разных форм циклической глюкозы: крахмал — остатки а-глюкозы; целлюлоза — остатки β-глюкозы. 2. Содержат разное число структурных звеньев — остатков глюкозы: крахмал — до нескольких тысяч (Мr — до 1 млн); целлюлоза — до 40 тыс. (Мr — до 20 млн). 3. Между остатками глюкозы образуются различные связи: в крахмале — а-1,4- и а-1,6-гликозидные связи; в целлюлозе — β-1,4-гликозидные связи. 4. Макромолекулы имеют различную структуру: крахмал — разветвленные и неразветвленные молекулы, компактно свернутые; целлюлоза — только неразветвленные молекулы, имеют вид нитей, так как форма остатков β-глюкозы исключает спирализацию. 5. Характер межмолекулярных взаимодействий: в крахмале макромолекулы имеют компактную форму, водородные связи между ними почти не образуются; в целлюлозе между молекулами нитевидной формы образуются очень прочные водородные связй (в которых участвуют свободные гидроксильные группы), нити объединяются в пучки, пучки — в волокна. Поэтому в воде, спирте, эфире целлюлоза не растворяется и не набухает, как крахмал. 6. Крахмал — продукт питания, так как в организмах человека и животных есть ферменты, расщепляющие а-1,4-и а-1,6-гликозидные связи. Целлюлоза не является продуктом питания человека и большинства животных, так как в их организмах нет ферментов, расщепляющих более прочные β-1,4-гликозидные связи. Жвачные животные и кролики способны усваивать целлюлозу при посредстве содержащихся в их организме бактерий. Химические свойства целлюлозы 1. Гидролиз целлюлозы При длительном нагревании с минеральными кислотами или под действием ферментов (у жвачных животных) идет ступенчатый гидролиз целлюлозы: 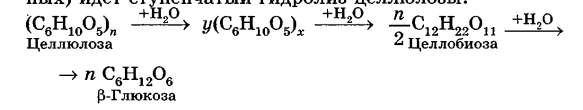 2. Образование сложных эфиров Каждое структурное звено целлюлозы содержит три свободных гидроксила: 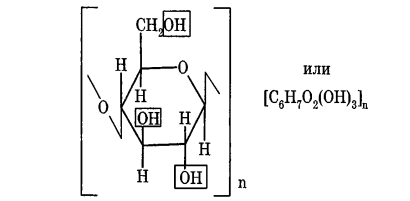 Следовательно, целлюлоза может вступать в реакции, характерные для многоатомных спиртов: а) взаимодействие с неорганическими кислотами: 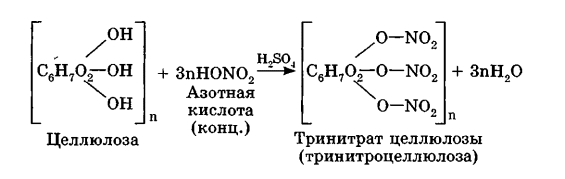 В результате реакции обычно образуется смесь моно-, ди- и тринитратов целлюлозы; б) взаимодействие с органическими кислотами 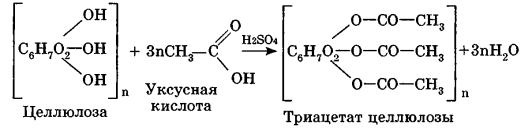 Образуется смесь моно-, ди- и триацетатов целлюлозы. 3. Горение — полное окисление: 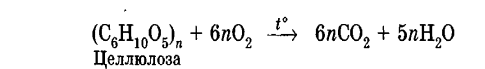 4. Термическое разложение целлюлозы без доступа воздуха: 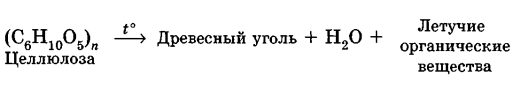 Применение целлюлозы Являясь составной частью древесины, целлюлоза используется в строительном и столярном деле и как топливо (горение идет с выделением энергии); из древесины получают бумагу и картон, этиловый спирт. В виде волокнистых материалов (хлопка, льна, конопли) целлюлоза используется для изготовления тканей, нитей; эфиры целлюлозы идут на изготовление нитролаков, кинопленок, бездымного пороха, пластмасс, медицинского коллодия, искусственного волокна. |
