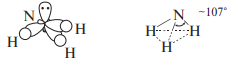Документ Microsoft Word. Физические свойства и строение алифатические амины
 Скачать 195.94 Kb. Скачать 195.94 Kb.
|
|
| Связь | Энергия, кДж/моль (ккал/моль) | Длина, нм | Полярность, D |
| С–N | 305 (73) | 0,147 | 0,45 |
| N–H | 389 (93) | 0,103 | 1,31 |
В табл. 23.1 приведены некоторые параметры связей в молекулах аминов. Вследствие полярности связи N–H амины образуют водородные связи.
Эти связи, однако, менее прочны, чем у воды или спиртов, из-за меньшей (чем у атома кислорода) электроотрицательности атома азота. Поэтому ами- ны кипят при более низкой температуре, чем спирты. Температуры кипения и другие физические свойства некоторых аминов перечислены в табл. 23.2.
Физические свойства аминов
| Амины | Мол. масса | Т. пл., °С | Т. кип., °С | d20 4 |
| Первичные: | | | | |
| CH3NH2 | 31 | –94 | –6,5 | 0,6628 |
| CH3CH2NH2 | 45 | –81 | 16,6 | 0,6829 |
| CH3CH2CH2NH2 | 59 | –83 | 47,8 | 0,7173 |
| CH3CH2CH2CH2NH2 | 73 | –49 | 77,8 | 0,7414 |
| Вторичные: | | | | |
| (CH3)2NH | 45 | –93 | 7,4 | 0,6804 |
| (CH3CH2)2NH | 73 | –48 | 56,3 | 0,7056 |
| (CH3CH2CH2)2NH | 101 | –40 | 110 | 0,7400 |
| (CH3CH2CH2CH2)2NH | 129 | –60 | 159 | 0,7670 |
| Третичные: | | | | |
| (CH3)3N | 59 | –117 | 2,9 | 0,6356 |
| (CH3CH2)3N | 101 | –114 | 89,7 | 0,7256 |
| (CH3CH2CH2)3N | 143 | –94 | 155 | 0,7558 |
| (CH3CH2CH2CH2)3N | 185 | –70 | 213 | 0,7771 |
Эти связи, однако, менее прочны, чем у воды или спиртов, из-за меньшей (чем у атома кислорода) электроотрицательности атома азота. Поэтому ами- ны кипят при более низкой температуре, чем спирты. Температуры кипения и другие физические свойства некоторых аминов перечислены в табл. 23.2.
Четвертичные аммониевые соли
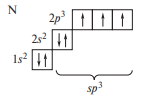
Хотя в алкиламинах атом азота находится в состоянии sp3-гибридизации, пира- мидальная конфигурация их молекул не является устойчивой. Для таких ами- нов характерны быстрые взаимные переходы между двумя конфигурациями. При наличии трех различных заместителей у атома азота речь идет о быстрых взаимопревращениях энантиомеров. Этот процесс называют инверсией азота. По этой причине указанные амины не обнаруживают оптической активности.
Для простых аминов энергия активации процесса инверсии весьма мала и составляет 25 кДж/моль (6 ккал/моль). В плоском переходном состоя- нии азот имеет sp2-гибридизацию с НЭП, находящейся на 2pz-орбитали.
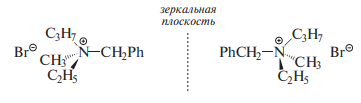
Четвертичные аммониевые соли могут существовать как устойчивые
энантиомеры, поскольку инверсия азота в этих соединениях невозможна. Это видно на примере бензилметилпропилэтиламмонийбромида:
Ароматические амины
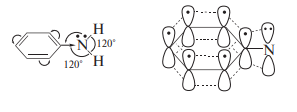
Атом азота и в ариламинах формально находится в состоянии sp3-гибриди- зации. Однако структурные характеристики молекулы анилина согласуют- ся скорее с sp2-гибридным состоянием атома азота.
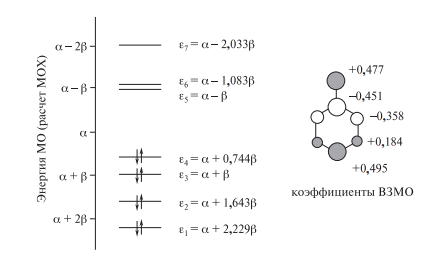
Энергетическая диаграмма молекулярных -орбиталей и коэффициенты ВЗМО анилина
Этот факт объясняется эффективным сопряжением орбитали, занимае- мой НЭП на атоме азота, с -орбиталями бензольного ядра. Об этом гово- рят и результаты квантово-химических расчетов анилина, в том числе про- стым методом МОХ. Включение в базис расчета семи атомных орбиталей, на которых находятся восемь электронов, дает семь молекулярных -орби- талей (их энергии показаны на рис. 23.1). орто- и пара-Положения в моле- куле анилина имеют повышенные значения и суммарной электронной плотности, и плотности на ВЗМО (на рисунке показаны значения коэффи- циентов ВЗМО анилина).
Л И Т Е Р А Т У Р А
1. Органическая химия [Электронный ресурс] : учебное пособие для вузов : в 3 т. Т. III / В. Ф. Травень. — 4-е изд. (эл.). — Электрон. текстовые дан. (1 файл pdf : 391 с.). — М. : БИНОМ. Лаборатория знаний, 2015. — (Учебник для высшей школы). — Систем. требования: Adobe Reader XI ; экран 10".
1. R.W. Alder et al. // J. Amer. Chem. Soc. 1981, v. 103, p. 6137.
2. D.H. Aue, H.M. Webb, M.T. Bowers // J. Amer. Chem. Soc. 1975, v. 97, p. 4136.
3. R.W. Alder, R.J. Arrowsmith, A. Casson // J. Chem. Soc. Chem. Commun. 1982, p. 940.
4. J.D. Dunitz. X-Ray Analysis and the Structure of Organic Molecules. ItacaLondon: Cornell Univ. Press, 1979, 514 p.
5. а) В.Ф. Травень. Электронная структура и свойства органических молекул, М.: Химия, 384 с.; б) V. Traven. Frontier Orbitals and Properties of Organic Molecules. Chichester: Ellis Horwood, 1992, 401 p.
6. D. Martin, B. Mayer // Angew. Chem. 1983, v. 95, p. 281.
7. Enamines: Synthesis, Structure and Reactions, A.G. Cook, ed., N.Y.: Dekker, 1988.
8. P.W. Hickmott // Tetrahedron. 1982, v. 38, p. 1975.
9. P.W. Hickmott // Tetrahedron. 1982, v. 38, p. 3363.
10. В.Г. Граник // Успехи химии. 1984, т. 53, с. 651.
11. V.G. Granik, A.V. Kadushkin, C. Liebsher // Advances Het. Chem. 1999, v. 72, p. 79.
12. V.G. Granik, V.A. Makarov, C. Parkanyi // Advances Het. Chem. 1999, v. 72, p. 283.
13. G. Stork, R. Terrell, J. Szmuszkovicz // J. Amer. Chem. Soc. 1954, v. 76, p. 6137.
14. J.-L. Bernier, J.-P. Henichart // J. Org. Chem. 1981, v. 46, p. 4197.
15. S. A. Monti // J. Org. Chem. 1966, v. 31, p. 2669.
Химические свойства
В молекулах алифатических аминов атом азота находится в состоянии
SP3 -гибридизации, поэтому они, подобно аммиаку, имеют пирамидальную конфигурацию. Например, углы связей С—N—С в триметиламине равны 108° и очень близки к величинам углов Н—N—Н в молекуле аммиака.
Теоретически вторичные и третичные амины с разными углеводородными радикалами могут существовать в виде энантиомеров, однако обычные алифатические и ароматические амины до сих пор не выделены в виде индивилуальных энантиомеров. Это объясняется тем, что молекулы аммиака и аминов постоянно претерпевают пирамидальную инверсию, которую следует рассматривать как быстрое обращение конфигурации. Инверсия осуществляется через тригональное переходное состояние (в центре схемы):
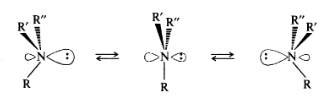
Частота инверсии молекулы аммиака составляет 2,5 1011 обращений в секунду, а энергия активации этого процесса составляет —25 кДж/моль. Для аминов с небольшими алифатическими радикалами эти величины имеют примерно такие же значения.
В молекулах ароматических аминов неподеленная пара электронов атома азота находится в сопряжении с -олектронами ароматического кольца, вследствие чего амплитуда, с которой совершается пирамидальная инверсия, значительно уменьшается.
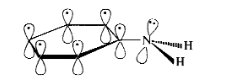
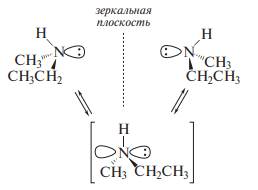
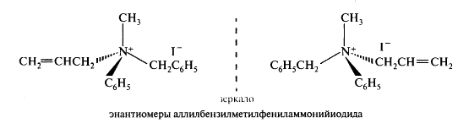
Четвертичные аммониевые соли, имеющие четыре разных радикала, могут быть разделены на индивидуальные энантиомерные формы, т.е. эти формы обладают конфигурационной устойчивостью.
Так, аллилбензилметилфениламмонийиодид выделен в виде индивиду альных энантиомеров, каждый из которых обладает оптической активностью:
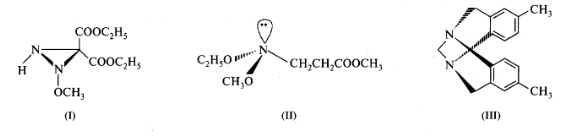
Соединения с трехвалентным атомом азота могут существовать в виде
энантиомеров в тех случаях, когда он включен в трехчленный азиридиновый
цикл (1) или соединен с гетероатомом, имеющим неподеленную пару электро нов (11). В этих случаях энергия активации пирамидальной инверсии превышает 100 кДж/моль, что позволяет разделить вещества на индивидуаль ные оптически активные формы при комнатной температуре. Довольно давно известны в виде оптически активных форм основания Трегера (Ш)- соедине-
ния, в молекулах которых атом азота включен в жесткую каркасную систему,
поэтому пирамидальная инверсия здесь в принципе невозможна.
Основные свойства
Амины, как и аммиак, проявляют основные свойства, что обусловлено наличием в их молекулах атома азота с неподеленной парой электронов. При
взаимодействии с кислотами амины превращаются в аммониевые соли:
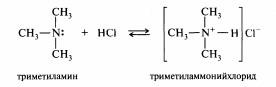
Соли аминов в отличие от других ониевых солей гидролитически устойчивы, хорошо растворимы в воде, легко кристаллизуются из водных растворов и, rак правило, более устойчивы, чем свободные основания. Многие лекарственные вещества, относящиеся к классу аминов, применяются в виде солей с минеральными и реже органическими кислотами.
Алифатические амины — сильные основания, значения рKвн+ большин-
ства алифатических аминов больше 10,5. Водные растворы аминов имеют ще-
лочную среду по лакмусу:
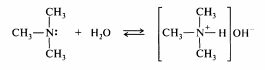
Можно предположить, что третичные амины с тремя алкильными заместителями, обладающими +I-эффектом, будут более сильными основаниями, чем вторичные и первичные амины. Однако стерические факторы, определяющие доступность основного центра для атаки протоном, оказывают противоположное влияние. Чем больше у атома азота радикалов и чем они разветвленнее, тем сильнее экранирована неподеленная пара электронов атома азота и затруднено ее взаимодействие с протоном. Поэтому самыми сильными основаниями должны быть первичные и вторичные амины со сравнительно короткими и неразветвленными радикалами. Сольватация (взаимодействие молекулы растворенного вещества с молекулами растворителя) оказывает на основность влияние, сходное с влиянием стерических факторов, поскольку с увеличением числа и разветвленности углеводородных радикалов уменьшается способность катиона замещенного аммония (сопряженной кислоты) связывать молекулы растворителя.
Многие кспериментальные данные не укладываются в изложенные выше сравнительно простые схемы. Например, при сравнении данных, приведенных в табл. 21.1, непонятно, почему основность метиламинов (метиламин, диметиламин и триметиламин имеют значения рKвн+ 10,6, 10,7 и 9,8 соответственно) ниже основности этиламинов (значения рKвн+ этиламина, диэтиламина и триэтиламина равны соответственно 10,7, 10,9 и 10,9). Не поддается объяснению на порялок более низкая, чем у остальных метил- и этиламинов, основность триметиламина, а также тот факт, что амин с разветвленными радикалами — диизопропиламин (рKвн+ 11,1) — более сильное основание, чем амины с более простыми радикалами. Таким образом, чисто умозрительные рассуждения не могут служить достоверной основой для предсказания сравнительной основности алифатических аминов.
На практике можно руководствоваться тем, что значения рKвн+ большинства алифатических аминов укладываются в сравнительно узкий интервал: от 10,6 до 11,2 (см. табл. 21.1). Такое небольшое различие в основности не обеспечивает существенного преимущества какому-нибудь из аминов в конкурентной реакции протонирования. Например, если к раствору соли какого-либо амина добавить свободное основание другого амина, то в системе установится равновесие с близкими значениями концентраций всех четырех компонентов:
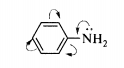
Основность ароматических аминов существенно ниже, чем у аминов алифатического ряда. Это объясняется тем, что неподеленная пара электронов
атома азота вступает в рул-сопряжение с электронами бензольного кольца:
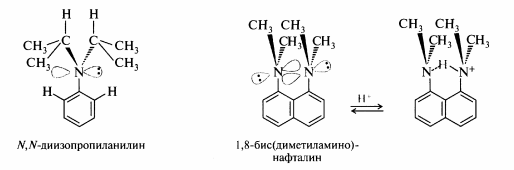
Если из-за стерических затруднений неподеленная пара электронов выводится из сопряжения, то основность амина значительно возрастает. Так, объемные алкильные радикалы N, N-диизопропиланилина не могут расположиться в одной плоскости с бензольным кольцом из-за взаимного отталкивания с атомами водорода в орто-положениях, поэтому его основность (рKвн+ 7,4) значительно выше, чем у анилина. Аналогичного рода стерические затруднения возникаюту N, N -диалкиланилинов, имеющих одновременно заместители в положениях 2 и 6. В молекуле 1,8-бис(диметиламино)нафталина обе диметиламиногруппы также не могут расположиться в одной плоскости с ароматической системой, и это соединение обладает удивительно высокой основностью (рKвн+ 12,4), его протонированная форма устойчива за счет того, что протон прочно удерживается неподеленными парами электронов двух атомов азота.
Л И Т Е Р А Т У Р А
1. Органическая химия: Учеб. лля вузов: В 2 кн. / В. Л. Белобородов, С. Э. Зу0-64 рабян, А. П. Лузин, Н. А. Тюкавкина; Под ред. Н.А. Тюкавкиной. — 2-е изд., стереотип. — М.: Дрофа, 2003. — Кн. 1: Основной курс. — 640 с.: ил.
(Высшее образование: Современный учебник).