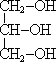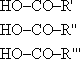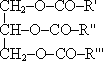Кислородсодержащие органические соединения.. Кислородсод орган соединения.. Одноатомные спирты
 Скачать 129.99 Kb. Скачать 129.99 Kb.
|
|
Спирты - органические соединения, в состав молекул которых входит одна или несколько гидроксильных групп, соединенных с углеводородным радикалом. По числу гидроксильных групп в молекуле спирты делятся на одноатомные, двухатомные трехатомные и т. д. Одноатомные спирты Общая формула одноатомных спиртов - R—OH. По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические. Общая формула предельных одноатомных спиртов - CnN2n+1—OH. Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C6H5—OH - гидроксобензол (фенол). По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R') и третичные (RR'R''C—OH) спирты. CnN2n+2O - общая формула и предельных одноатомных спиртов, и простых эфиров. Предельные одноатомные спирты изомерны простым эфирам - соединениям с общей формулой R—O—R'. Изомеры и гомологи Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия. Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей: 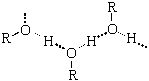  С этим же связана и хорошая растворимость в воде низших спиртов. Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит. Химические свойства спиртов Горение: C2H5OH + 3O2 →2CO2 +3H2O + Q Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства): Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них). 2Na + 2H—O—H → 2NaOH + H2 ↑ 2Na + 2R—O—H → 2RONa + H2 ↑ Атомы натрия легче восстанавливают те атомы водорода, у которых больше положительный частичный заряд (  +). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей. +). И в молекулах воды, и в молекулах спиртов этот заряд образуется за счет смещения в сторону атома кислорода, обладающего большой электроотрицательностью, электронных облаков (электронный пар) ковалентных связей.Молекулу спирта можно рассматривать как молекулу воды, в которой один из атомов водорода замещен углеводородным радикалом. А такой радикал, богатый электронными парами, легче, чем атом водорода, позволяет атому кислорода оттягивать на себя электронную пару связи R→O. Атом кислорода как бы "насыщается", и за счет этого связь O—H оказывается менее поляризованной, чем в молекуле воды (  + на атоме водорода меньше, чем в молекуле воды). + на атоме водорода меньше, чем в молекуле воды).В результате атомы натрия труднее восстанавливают атомы водорода в молекулах спиртов, чем в молекулах воды, и реакция идет намного медленнее. Иногда, основываясь на этом, говорят, что кислотные свойства спиртов выражены слабее, чем кислотные свойства воды. Из-за влияния радикала кислотные свойства спиртов убывают в ряду метанол → первичные спирты → вторичные спирты →третичные спирты С твердыми щелочами и с их растворами спирты не реагируют. Реакции с галогеноводородами: C2H5OH + HBr Внутримолекулярная дегидратация (t > 140oС, образуются алкены): C2H5OH Межмолекулярная дегидратация (t < 140oС, образуются простые эфиры): 2C2H5OH Окисление (мягкое, до альдегидов): CH3CH2OH + CuO Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида). Получение спиртов Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH → C2H5OH + NaCl. Гидратация алкенов: C2H4 + H2O Брожение глюкозы : C6H12O6 → 2C2H5OH + 2CO2 ↑ Синтез метанола: CO + 2H2 Многоатомные спирты Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль) HO—CH2—CH2—OH и трехатомный спирт пропантриол-1,2,3 (глицерин) HO—CH2—CH(OH)—CH2—OH. Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит. Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее. Качественной реакцией на многоатомные спирты является их реакция с гидроксидом меди(II) в щелочной среде, при этом образуется ярко-синие растворы сложных по строению веществ. Например, для глицерина состав этого соединения выражается формулой Na2[Cu(C3H6O3)2]. Фенолы Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C6H5—OH. Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой. Химические свойства Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
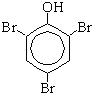
C6H5OH + NaOH →C6H5ONa + H2O Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических. Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной  -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение). -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).а) Реакция с бромной водой (качественная реакция):
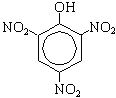
Образуется 2,4,6-трибромфенол - осадок белого цвета. б) Нитрование (при комнатной температуре) C6H5—OH + HNO3(разб.) →H2O + O2N—C6H4—OH (смесь орто- и пара-изомеров)
По вторй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота). Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы: 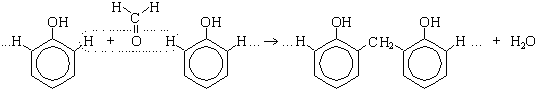 Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета. Простые эфиры Физические свойства Простые эфиры — это прозрачные бесцветные жидкости, обладающие характерным «эфирным» запахом. Они являются легколетучими и пожароопасными. Растворимость простых эфиров Простые эфиры растворимы в протонных кислотах, что связано с основными свойствами эфирного кислорода. Этот кислород имеет две свободные электронные пары, которые не могут использоваться для проявления обычной валентности и принять электроны. Однако для осуществления связи кислород может предоставить свою электронную пару в общее пользование: 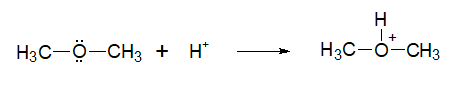 В зависимости от строения эфира, они могут иметь хорошую растворимость в воде или вовсе не растворяться (см. таблицу ниже). В большинстве органических растворителей простые эфиры хорошо растворимы. Точки плавления и кипения простых эфиров Простые эфиры кипят при гораздо более низких температурах, чем соответствующие спирты. Например, метиловый спирт кипит при +65°С, а метиловый эфир – при -23,7°С. Это связано с тем, что эфиры, в отличие от спиртов, лишены гидроксильного водорода и поэтому не имеют возможности образовывать водородные связи, объединяющие одну молекулу с другой. Т.е. простые эфиры не способны к ассоциации молекул. Химические свойства простых эфиров Простые эфиры – малореакционноспособная группа органических соединений, проявляющие слабоосновные свойства. Они могут расщепляются лишь некоторыми веществами при нагревании (концентрированной йодистоводородной кислотой или воздействием металлического натрия). Водные растворы кислот и щелочей не действуют на простые эфиры. Образование оксониевых солей при воздействии сильных кислот: 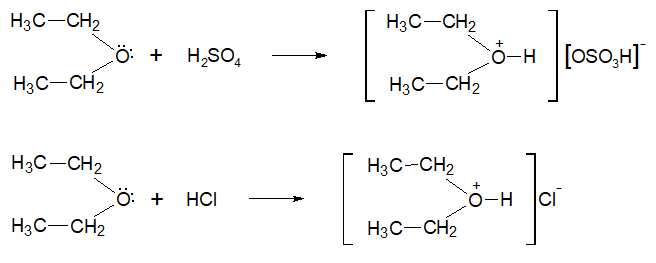 Образование комплексных соединений с солями (Меервейн Г.Л.):  Расщепление простых эфиров: Под действием концентрированных йодоводородной или бромоводородной кислот: Под действием активных металлов при повышенной температуре (Шорыгин П.П.): Под действием серной кислоты: 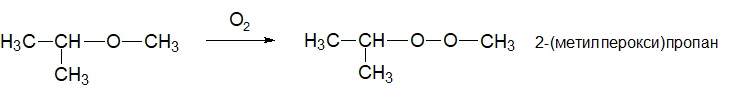 Окисление простых эфиров происходит с образованием перекисных соединений (автоокисление):  Простые эфиры при хранении легко окисляются кислородом воздуха с образованием перекисей. При использовании простых эфиров, особенно при перегонке их необходимо хорошо очистить от накопленных перекисей, которые могут стать причиной взрыва. Альдегиды - органические вещества, молекулы которых содержат карбонильную группу — Общая формула альдегидов Кетоны - органические вещества, молекулы которых содержат карбонильную группу — Общая формула кетонов Альдегиды и кетоны называются карбонильными соединениями, их общая формула - CnH2nO. Изомеры и гомологи В молекулах альдегидов, а тем более кетонов, в отличие от спиртов нет атомов водорода со значительным положительным частичным зарядом, поэтому между молекулами как альдегидов, так и кетонов нет водородных связей. Физические свойства: формальдегид - газ с удушливым запахом, растворим в воде (с молекулами воды водородные связи образуются, 40 %-ный водный раствор называется формалином с увеличением температуры растворимость уменьшается); ацетальдегид - бесцветная легкокипящая жидкость с фруктовым запахом, растворим в воде; ацетон - бесцветная жидкость с резким запахом, растворим в воде. В ряду алканы →альдегиды (кетоны) →спирты растворимость в воде и температура кипения увеличивается. Химические свойства Химические свойства альдегидов и кетонов в значительной степени обусловлены наличием в их молекулах сильно полярной карбонильной группы (связь  +) на атоме углерода этой группы, тем выше активность соединения. +) на атоме углерода этой группы, тем выше активность соединения.Горение: 2CH3CHO + 5O2 → 4CO2 + 4H2O 2CH3COCH3 + 9O2 → 6CO2 + 6H2O Присоединение (по двойной связи карбонильной группы). В ряду HCHO  RCHO RCHO  RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы. RCOR' склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.а) Гидрирование (восстановление водородом): HCHO + H2 CH3—CO—CH3 + H2 Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные. Окисление: CH3CHO + Ag2O  + CH3COOH (реакция "серебряного зеркала" - качественная реакция) + CH3COOH (реакция "серебряного зеркала" - качественная реакция)HCHO + 2Cu(OH)2 Кетоны слабыми окислителями не окисляются. Замещение атомов водорода в углеводородном радикале (замещение происходит в
Получение альдегидов и кетонов Окисление спиртов. а) Первичных CH3OH + CuO б) Вторичных CH3—CH(OH)—CH3 + [O] Дегидрирование спиртов. а) Первичных CH3CH2OH б) Вторичных CH3—CH(OH)—CH3 Окисление метана: CH4 + O2 →HCHO + H2O (При 500oС в присутствии оксидов азота) Гидратация ацетилена (реакция Кучерова; лабораторный способ): C2H2 + H2O →CH3CHO Окисление этилена: 2C2H4 + O2 Карбоновые кислоты Карбоновые кислоты - органические вещества, молекулы которых содержат одну или несколько карбоксильных групп. Карбоксильная группа По числу карбоксильных групп карбоновые кислоты делятся на одноосновные, двухосновные и т.д. Общая формула одноосновных карбоновых кислот R—COOH. Пример двухосновной кислоты - щавелевая кислота HOOC—COOH. По типу радикала карбоновые кислоты делятся на предельные (например, уксусная кислота CH3COOH), непредельные [например, акриловая кислота CH2=CH—COOH, олеиновая CH3—(CH2)7—CH=CH—(CH2)7—COOH] и ароматические (например, бензойная C6H5—COOH). Изомеры и гомологи Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров Физические свойства предельных одноосновных карбоновых кислот в значительной степени обусловлены наличием между молекулами прочных водородных связей (более прочных, чем между молекулами спиртов). Поэтому температуры кипения и растворимость в воде у кислот больше, чем у соответствующих спиртов. Химические свойства кислот Упрочнение Горение: Кислотные свойства. Из-за высокой полярности связи O-H карбоновые кислоты в водном растворе заметно диссоциируют (точнее, обратимо с ней реагируют): HCOOH Все карбоновые кислоты - слабые электролиты. С увеличением числа атомов углерода сила кислот убывает (из-за снижения полярности связи O-H); напротив, введение атомов галогена в углеводородный радикал приводит к возрастанию силы кислоты. Так, в ряду HCOOH →CH3COOH →C2H5COOH сила кислот снижается, а в ряду
- возрастает. Карбоновые кислоты проявляют все свойства, присущие слабым кислотам: Mg + 2CH3COOH → (CH3COO)2Mg + H2↑ CaO + 2CH3COOH → (CH3COO)2Ca + H2O NaOH + CH3COOH → CH3COONa + H2O K2CO3 + 2CH3COOH →2CH3COOK + H2O + CO2 ↑ Этерификация (реакция карбоновых кислот со спиртами, приводящая к образованию сложного эфира):
В реакцию этерификации могут вступать и многоатомные спирты, например, глицерин. Сложные эфиры, образованные глицерином и высшими карбоновыми кислотами (жирными кислотами) - это жиры.
Жиры представляют собой смеси триглицеридов. Предельные жирные кислоты (пальмитиновая C15H31COOH, стеариновая C17H35COOH) образуют твердые жиры животного происхождения, а непредельные (олеиновая C17H33COOH, линолевая C17H31COOH и др.) - жидкие жиры (масла) растительного происхождения. Замещение в углеводородном радикале:
Замещение протекает в Особенность муравьиной кислоты HCOOH состоит в том, что это вещество - двуфункциональное соединение, оно одновременно является и карбоновой кислотой, и альдегидом: Поэтому муравьиная кислота кроме всего прочего реагирует и с аммиачным раствором оксида серебра (реакция серебряного зеркала; качественная реакция): HCOOH + Ag2O(аммиачный раствор) Получение карбоновых кислот Окисление альдегидов. В промышленности: 2RCHO + O2 Лабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др. Окисление спиртов: RCH2OH + O2 Окисление углеводородов: 2C4H10 + 5O2 Из солей (лабораторный способ): CH3COONaкр. + H2SO4 конц.  + NaHSO4 + NaHSO4Список литературы Артеменко, А. И. Органическая химия / А.И. Артеменко. - М.: Высшая школа, 2002. - 560 c. Березин, Б. Д. Органическая химия. В 2 томах. Том 1. Учебник / Б.Д. Березин, Д.Б. Березин. - М.: Юрайт, 2016. - 314 c. Каминский, В. А. Органическая химия в 2 ч. Часть 2 : учебник для академического бакалавриата / В. А. Каминский. Юрайт, 2019. — 314 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||