Оксид кремния. Кремниевая кислота.. Оксид кремния. Кремниевая кислота 2021. Оксид кремния. Кремниевая кислота. 9 класс. Цели
 Скачать 220.81 Kb. Скачать 220.81 Kb.
|
|
Оксид кремния. Кремниевая кислота. 9 класс. Цели:предполагается, что к окончанию урока учащиеся будут: знать: о свойствах оксида кремния и кремниевой кислоты уметь: записывать уравнения химических реакций, характеризующих химические свойства оксида кремния и кремниевой кислоты Задачи урока: способствовать формированию познавательной активности; владению навыками самостоятельного приобретения новых знаний; развитие навыков решения задач и химических уравнений реакции для обеспечения мотивации и целеполагания учебной деятельности; способствовать воспитанию убежденности в возможности познания природы. Учебно-методическое обеспечение: учебное пособие, рабочая тетрадь, периодическая таблица Д. И. Менделеева. Ход урока. Организационный этап. Приветствие учащихся, проверка готовности к уроку, отметка отсутствующих. Проверка домашнего задания. Выборочно проверяются рабочие тетради с выполненным домашним заданием. На доске учащиеся записывают уравнения химических реакций, характеризующих химические свойства кремния. Целемотивационный этап. Актуализация знаний и умений учащихся. Учащимся предлагается прочитать высказывание В. И. Вернадского: «Кремний вырисовывается в мироздании как элемент, обладающий исключительным значением». Учащимся предлагается ответить на вопросы: Что такое кислотные оксиды? Что образуется при взаимодействии кислотных оксидов с водой? Существуют ли кислородсодержащие кислоты, которые не могут образовываться путем взаимодействия соответствующего оксида с водой? Изучение нового материала. Физические свойства и нахождение в природе Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:  Химические свойстваОксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства. 1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты. Например, диоксид кремния взаимодействует с гидроксидом калия: SiO2 + 2KOH → K2SiO3 + H2O Еще пример: диоксид кремния взаимодействует с оксидом кальция. SiO2 + CaO → CaSiO3 2. Оксид кремния (IV) не взаимодействует с водой, т.к. кремниевая кислота нерастворима. 3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ: SiO2 + K2CO3 → K2SiO3 + CO2 Кремниевая кислотаСтроение молекулы и физические свойстваКремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде. Метакремниевая H2SiO3 существует в растворе в виде полимера: 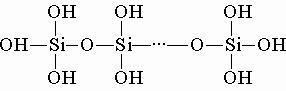 Способы полученияКремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов). Например, при действии соляной кислоты на силикат натрия: Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl При нагревании кремниевая кислотаразлагаетсяна оксид и воду: H2SiO3→ SiO2+ H2O Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом». Закрепление нового материала Предлагается ответить на вопросы теста: 1. Кремниевая кислота обладает следующими свойствами а) Изменяет окраску индикаторов, взаимодействует с металлами б) Не изменяет окраску индикатора, растворима в воде в) Не изменяет окраску индикатора и нерастворима в воде 2. Силикаты это соли: а) кремниевой кислоты б) серной кислоты в) угольной кислоты 3. Кремниевую кислоту получают: а) при взаимодействии оксида кремния с водой б) при взаимодействии гидрооксида с оксидом кремния в) при взаимодействии силиката и кислоты 4) У кремния и его оксида кристаллическая решетка: а) атомная б) ионная в) молекулярная. 5) Оксид кремния растворяется в воде: а) хорошо б) плохо в) нерастворим Осуществите превращения по схеме: 1) Si → SiO2 → Na2SiO3 → H2SiO3 →SiO2 2) Si → Mg2Si → SiH4 → SiO2 Информация о домашнем задании. §37, упр. 5,6,8 Подведение итогов урока. В конце урока учитель подводит итоги, выставляет и кооментирует отметки. Рефлексия - Какой вид работы сегодня на уроке понравился больше всего? - Где могут понадобиться полученные знания в жизни? - Что ещё Вы хотели бы узнать по этой теме? |
