Практическое Зан.№24. Определение минеральных удобрений
 Скачать 92.45 Kb. Скачать 92.45 Kb.
|
|
Практическая работа № 24 Тема «Определение минеральных удобрений» Цели: продолжить совершенствовать навыки проведения химического эксперимента практической направленности с использованием малых количеств веществ, соблюдать правила ТБ, аккуратность при выполнении работы, описывать наблюдения и делать выводы, записывать уравнения реакций в ионном виде. Форма работы: парная. Оборудование: на каждый стол: удобрения, стаканчики с водой , AgNO3 ( раствор), КОН (конц.), ВаСI2 ( раствор), 3-х литровая емкость для слива неорганичеких веществ, стеклянная палочка. Задание. В 3-х пронумерованных пробирках находятся суперфосфат, хлорид калия, сульфат аммония. Определить каждое вещество. Записать уравнения химических реакций и разобрать их с точки зрения диссоциации. Задание оформить в виде таблицы. а) К содержимому пробирок добавляем воду. Наблюдения. В одной из пробирок вещество растворилось не полностью. Выводы. Это суперфосфат, так как ________________. б) К этому раствору добавляем раствор нитрата серебра. Наблюдения: Выделяется желтый осадок. Уравнения реакции: Ca(H2PO4)2 +6AgNO3= Выводы. В данной пробирке находится суперфосфат, т.к. данная реакция является ___________________________. в) К оставшимся растворам добавляем раствор хлорида бария. Наблюдения. В одной из пробирок выпадает белый осадок. Уравнения реакции: BaCL2 + (NH4)2 SO4= Выводы. В данной пробирке находится сульфат аммония, т.к. данная реакция является __________________________. г) К оставшемуся веществу добавляем раствор нитрата серебра . Наблюдения. Образуется белый осадок. Уравнения реакции: KCL + AgNO3= Выводы. Эта реакция является ________________ поэтому в данной пробирке содержится хлорид калия.
Тема «Анализ лекарственных препаратов, производных салициловой кислоты, производных n-аминофенола.» Цель: состоит в ознакомлении с химическим составом и инструкциями по применению важнейших лекарственных препаратов,представление об их составе, свойствах и применении. Оборудование и реактивы: ТСО, производные салициловой кислоты(салициловая кислота, ацетилсалициловая кислота, салол); вода, спирт, раствор гидроксида натрия; препарат n- аминофенола-парацетамол; мыло, стиральный порошок, раствор фенолфталеина, спиртовка, стеклянная палочка, пробирки, держатель для пробирок, ступка. Опыт1. 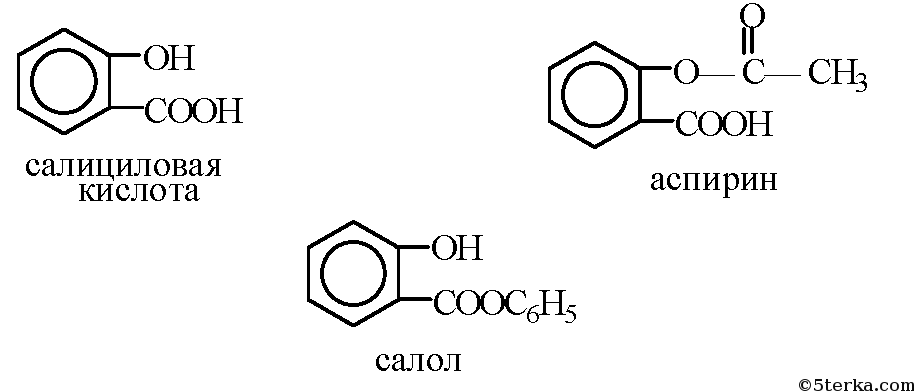 Часть 1. Цель: Исследование растворимости ацетилсалициловой кислоты и обнаружение карбоксильной группы. В ступке растерли таблетки каждого из этих лекарств. Перенесли в пробирки по 0,1 г каждого лекарства. В каждую пробирку добавили немного воды, таблетки почти не растворились. На спиртовке нагрели пробирки до кипения, растворение порошков так и не произошло. 2. В пробирки внесли по 0,1 г порошков и добавили немного этанола. На спиртовке нагрели пробирки, наблюдаем растворение осадков. В этаноле лекарства растворяются лучше. 3. В пробирки внесли по 0,1 г порошков и добавили немного раствора NaOH, содержимое взболтали. Порошки растворились, т.к. происходит реакция, а образовавшиеся соли растворимы в воде. 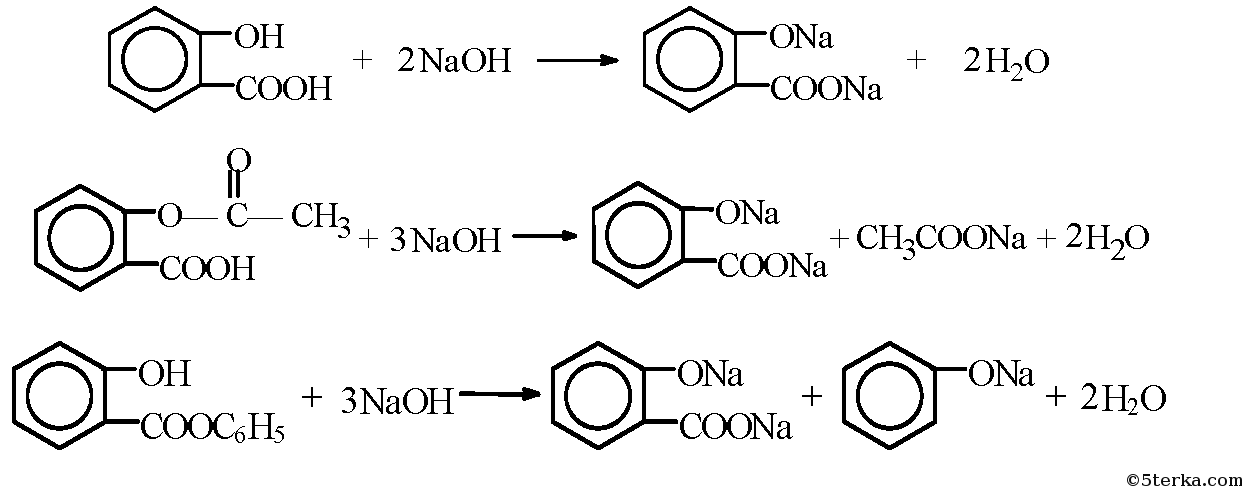  Часть 2 . Цель: Определение наличия фенольного соединения. 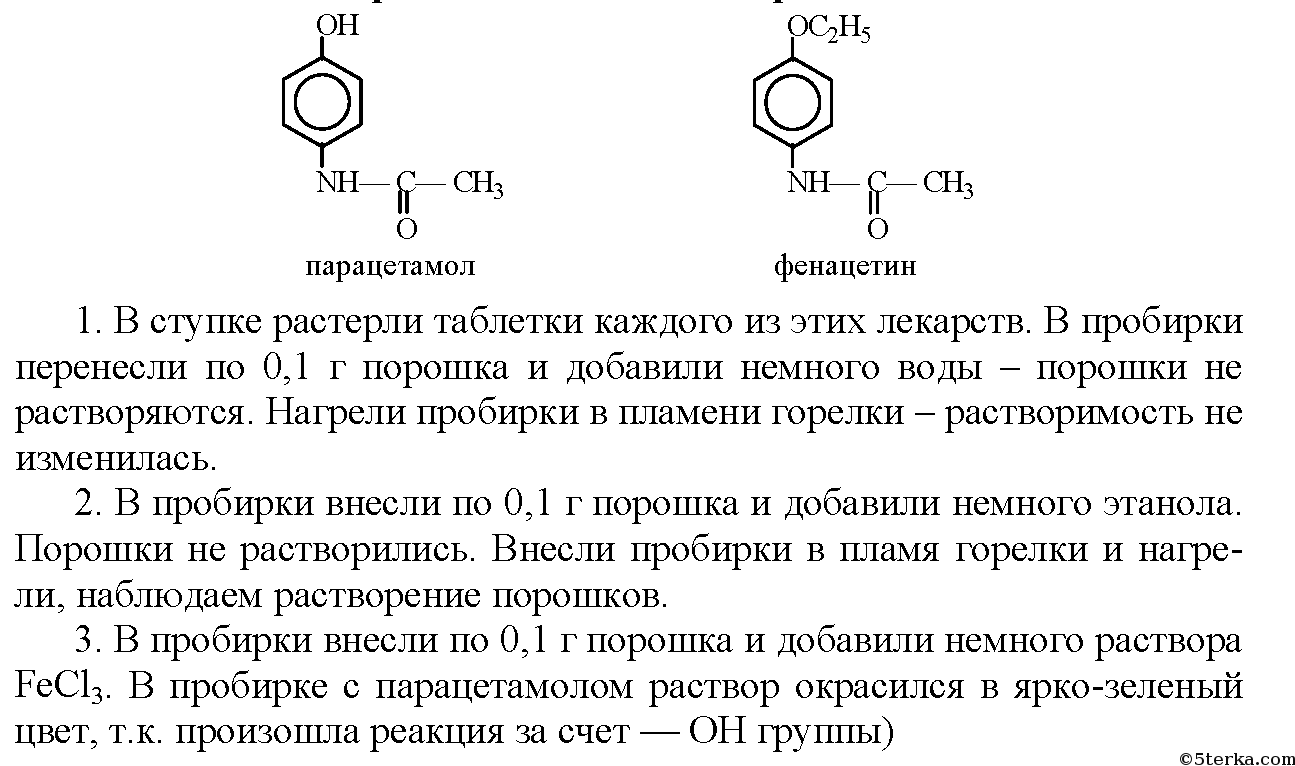 Данные занесите в таблицу.
Вывод Опыт2. Тема «Сравнение свойств мыла и синтетических моющих средств.» Цель работы: исследование моющего действия растворов мыла и синтетического порошка. Оборудование и реактивы: штатив с пробирками, 1% растворы мыла и синтетического порошка, приготовленные на дистиллированной воде, фенолфталеин, жесткая вода, раствор серной кислоты. Ход работы: 1. Налейте в две пробирки по 1 мл жесткой (водопроводной) воды: в одну добавьте по каплям раствор мыла, в другую – раствор порошка. Не забудьте взбалтывать содержимое пробирок после добавления каждой капли. Обратите внимание, в каком случае приходится прибавлять больше раствора для образования устойчивой пены. Какой можно сделать вывод? Какое моющее средство не утрачивает своего действия в жесткой воде. 2. В пробирки с растворами мыла и порошка прилейте несколько капель фенолфталеина. Что наблюдаете? По итогам проведенных опытов заполните таблицу, сделайте вывод.
Вывод: Начало формы Конец формы Начало формы Конец формы |
