Лабораторная работа 1 Определение рН растворов кислот, щелочей
 Скачать 74.63 Kb. Скачать 74.63 Kb.
|
|
16.09.22 г. Пишут все, кроме Логунова Саши Лабораторная работа № 1 Определение рН растворов кислот, щелочей Реактивы: штатив с пробирками, пробка, стеклянная палочка, штатив с кольцом, фильтровальная бумага, ножницы, химическая воронка, стаканы, фарфоровая ступка с пестиком, мелкая терка, чистый песок. Химическая посуда и лабораторное оборудование: универсальная индикаторная бумага, испытуемый раствор, кипяченая вода, плоды, ягоды и другой растительный материал, раствор гидроксида натрия, гидроксида кальция, соляной кислоты и серной кислоты. Техника безопасности. Требуется соблюдение правил работы с растворами кислот, щелочей и нагревательными приборами. Задание 1. Определить рН раствора при помощи универсального индикатора. Ход работы. Выполнить опыт из здания 1. Результаты оформить в виде таблицы.
После таблицы необходимо написать вывод!!! (подсмотреть можно на стр 43) Задание 2. Определить рН некоторых растворов и соков при помощи универсального индикатора. Ход работы. Определить рН в растворах некоторых пищевых продуктов№ ВЫполнить задания по алгоритму? Результаты занести в таблицу№
После таблицы необходимо написать вывод!!! 28.09.22 г. Пишут все, кроме Коваленко Лианы Лабораторная работа № 2 Гидролиз солей Реактивы: растворы солей: KCl, Na2CO3, AlCl3, Na2S, NaNO3, универсальный индикатор. Химическая посуда и лабораторное оборудование: пробирки, штативы для пробирок. Ход работы Опыт 1. В пять пробирок налили по 3-4 мл раствора каждой соли. При помощи универсального индикатора определили рН в каждом растворе.
Вывод: Гидролизу подвергаются соли образованные слабым основанием и сильной кислотой, сильным основанием и слабой кислотой, слабым основанием и слабой кислотой. Опыт 2. В отдельной пробирке смешали растворы солей AlCl3 и Na2S. 2AlCl3 + 3Na2S+6H2O=2 Al(OH)3↓ +6NaCl+3H2S↑ Мы наблюдали выпадение белого осадка гидроксида алюминия, так же выделяется сероводород, газ, который имеет специфический запах. Вывод: в ходе выполнения данной лабораторной работы мы ознакомились с типичными случаями и условиями протекания гидролиза солей. Таким образом, гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Соль, образованная сильным основанием и сильной кислотой, гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной. 30.09.22 г. Пишут все, кроме Коваленко Лианы Лабораторная работа № 3 Определение катионов Li+, Na+, K+, Ca2+, Sr2+, Ba2+, Cu2+ по окрашиванию пламени Реактивы: кристаллы LiCl, NaCl, KCl, CaCl2, SrCl2, BaCl2, CuCl2. Химическая посуда и лабораторное оборудование: нихромовая проволока, спиртовка. Ход работы Нагрели в пламени петельку из проволоки нихрома, чтобы путем нагревания очистить ее от примесей. Затем прикрепили кристаллы LiCl, NaCl, KCl, CaCl2, SrCl2, BaCl2, CuCl2 и петельки и уедерживали их в горячей, бесцветной зоне пламени спиртовки. Наблюдали за изменением цвета пламени под влиянием кристаллов солей.
Вывод: изменение цвета пламени доказывает присутствие катионов в кристаллах. 30.09.22 г. Пишут все, кроме Коваленко Лианы Лабораторная работа № 4 Качественные реакции на катионы Fe2+, Fe3+, Cu2+ взаимодействием со щелочами Реактивы: растворы хлоридов или сульфатов железа (II), железа (III) и меди (II), гидроксида натрия. Химическая посуда и лабораторное оборудование: пробирки и штатив для пробирок. Техника безопасности. Требуется соблюдение правил работы с растворами кислот, щелочей и нагревательными приборами. Ход работы Опыт. В три пробирки налили по 2 мл растворов сульфатов железа (II), железа (III) и меди (II) соответственно. Пронаблюдали за изменениями растворов.
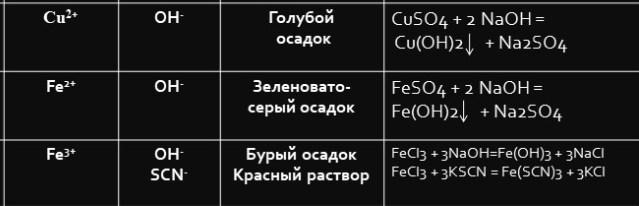 Вывод: Экспериментальным путем исследовали качественные реакции на ионы металлов. 05.10.22 г. Лабораторная работа № 5 Определение анионов Cl-, Br -, I -, PO43-, SO42-, CO32-, NO3 -,SiO32- в водных растворах Реактивы: растворы азотной кислоты (HNO3), хлорида калия, бромида калия, йодида калия, ортофсфата калия, нитрата серебра, сульфата натрия, хлорида бария, карбоната калия, соляной кислоты, известковой воды Ca(OH)2, силиката натрия, кристаллы нитрата натрия, конц. H2SO4. Химическая посуда и лабораторное оборудование: кусочек медной проволоки, пробирки и штативы для пробирок, газоотводная трубка. Техника безопасности. Требуется соблюдение правил работы с растворами кислот, щелочей и нагревательными приборами. Ход работы Опыт 1. Определение анионов Cl-, Br -, I -, PO43-. В 4 пробирки налили по 3 мл раствора хлорида калия, бромида калия, йодида калия, ортофосфата калия. Каждую пробирку добавили несколько капель раствора нитрата серебра. Чтобы цвета были лучше заметны, приложили пробирки к белому листу. Уравнения реакций: KCl + AgNO3 -> AgCl + KNO3 KBr + AgNO3 -> AgBr + KNO3 KI + AgNO3 -> AgI + KNO3 К3РО4+3 AgNO3 -> Ag3 РО4+KNO3 В каждой из пробирок выпадет осадок: AgCl, AgBr, AgI, Ag3 РО4. Различить их можно по цвету: AgCl - белый, AgBr - бледно-желтый, AgI - насыщенно-желтый, Ag3 РО4 – желтые кристаллы. Опыт 2. Определение анионов SO42-. Налили в пробирку 2 мл раствора сульфата натрия и добавили в пробирку несколько капель хлорида бария. Na2SO4 + BaCl2 = 2NaCl + BaSO4 Увидели выделение белого металлокристаллического осадка. Опыт 3. Определение анионов CO32-. В пробирку с карбонатом натрия прилили несколько капель соляной кислоты. Пробирку закрыли пробкой с газоотводной трубкой. Конец трубки вставили в раствор известковой воды. Na₂CO₃+2HCl=2NaCl+H₂O+CO₂↑ Появление пузырьков известковой воде говорит о выделении углекислого газа, который не имеет запаха. Опыт 4. Определение анионов NO3-. Этот опыт проводили в вытяжном шкафу. В пробирку поместили немного нитрата натрия и кусочек медной проволоки. К содержимому в пробирке добавили несколько капель раствора конц-ой серной кислоты. 3Cu + 4H2SO4 + 2NaNO3 → 4Н2O + Na2SO4 + 2NO 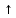 + 3CuSO4 + 3CuSO4Выделяется оксид азота. Сульфат меди кристаллизуется с молекулами воды, образуя прозрачные синие кристаллы. В таком виде он называется медным купоросом. Опыт 4. Определение анионов SiO32-. В пробирку налили 2 мл силиката натрия и добавили несколько капель соляной кислоты. Na₂SiO₃ + 2HCl → H₂SiO₃↓ + 2NaCl . выделяется белый студенистый осадок |
