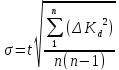лаба федор. Определение степени диссоциации слабого электролита
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей и физической химии Лабораторная работа №1 По дисциплине:Химия, часть 2 Тема: Определение степени диссоциации слабого электролита кондуктометрическим способом Выполнили: ст. группы НБШ – 21 /Федорова А.Р./ (должность) (подпись) (Ф.И.О) Проверил: доцент / Сергеев В.В. / (должность) (подпись) (Ф.И.О) РЕФЕРАТ Вопрос диссоциации электролитов в растворе занимал многих ученых, в том числе Вант-Гоффа и Аррениуса. Было замечено, что изотонический коэффициент iвыражается не целыми числами, как это могло быть, если бы электролиты на ионы диссоциировали полностью, а дробными, которые с разбавлением раствора, возрастая, приближаются к целым числам. Как объяснил Аррениус, в растворе лишь часть электролита диссоциирует на ионы. Он ввел понятие степени диссоциации электролита для количественного описания данного явления. Позднее установили, что электролиты можно разделить на сильные и слабые, причем для первых понятие степени диссоциации неприменимо: они распадаются на ионы в растворе практически без остатка, а отклонение изотонического коэффициента обуславливается взаимным притяжением противоположных ионов друг к другу. Так как слабые электролиты диссоциируют частично, то в растворе устанавливается динамическое равновесие между ионами и недиссоциированными молекулами. К слабым электролитам относятся едва ли не все органические кислоты и основания, например амины, малорастворимые и нерастворимые неорганические вещества, некоторые растворимые кислоты (Н2СО3, H2S, HCN) и основания (NH4OH). Метод кондктометрического анализа заключается в исследовании зависимости концентрации электролита от электропроводности раствора. Кондуктометрическое титрование, одна из разновидностей кондуктометрии, – способ определения содержания вещества по излому кривой титрования. Связь между электропроводностью раствора и концентрацией веществав 1885 году ввел немецкий физик Кольрауш. Различные методы кондуктометрии могут быть использованы практически для любых реакций и сред, например, высокочастотное кондуктометрическое титрование характеризуется отсутствием контакта электродов со средой, что применяется при исследованиях алкалоидов и фармацевтичеких препаратов. В настоящее время существуют методики, основанные на методе кондуктометрии, для определения количества поваренной соли в сычужном сырье (пищевая промышленность), малых количеств углерода в сталях металлов и даже для изучения фитопланктона, концентрации и размеров клеток с помощью кондутометрического цитометра. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ В настоящем отчете применяются следующие термины с соответсвтующими определениями:
ОСНОВНАЯ ЧАСТЬ Цель работы Получить зависимость удельной электропроводности от содержания слабого электролита в растворе, проанализировать концентрацию раствора слабой кислоты методом кондуктометрического титрования. Используемое оборудование Кондуктометр; магнитная мешалка; химический стакан объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 1 шт.; химический стакан объемом 250 мл – 1 шт.; мерные колбы объемом 250 мл – 4 шт.; мерная пипетка объемом 50 мл – 1 шт.; мерная пипетка объемом 10 мл – 1 шт.; бюретка для титрования объемом 25 мл – 1 шт.; гидроксид натрия – раствор 1 моль/л; слабая кислота – СН3СООН– раствор 1 моль/л. Ход эксперимента Приготовить 4 последовательно разведенных раствора уксусной кислоты. Отобрать пробы в стакан и измерить кондуктометром удельную электропроводность растворов, начиная с самого разбавленного, полностью погружая электроды в раствор и промывая их соответсвующим исследуемым раствором перед каждым измерением. Для получения данных построения кривой титрования подготовить бюретку, залить в нее раствор щелочи и довести нижний мениск жидкости до нуля, отобрать пробу (аликвоту) уксусной кислоты в химический стакан 250 мл, поставить его на магнитную мешалку, погрузить в стакан электрод, дистиллированной водой довести уровень жидкости в стакане до полного покрытия ею электродов, включить магнитную мешалку, определить показания кондуктометра, через каждые 2 минуты добавлять к кислоте 1 мл раствора щелочи и записывать показания прибора, продолжать титрование до 20 мл использованного раствора щелочи. Содержание протокола Таблица 1 – Результаты исследования
Таблица 2 – Зависимость удельной электропроводности от концентрации слабого электролита
Таблица 3 – Индивидуальное контрольное задание
Продолжение таблицы 3
Обработка результатов 1 Построение и исследование кривой кондуктометрического титрования 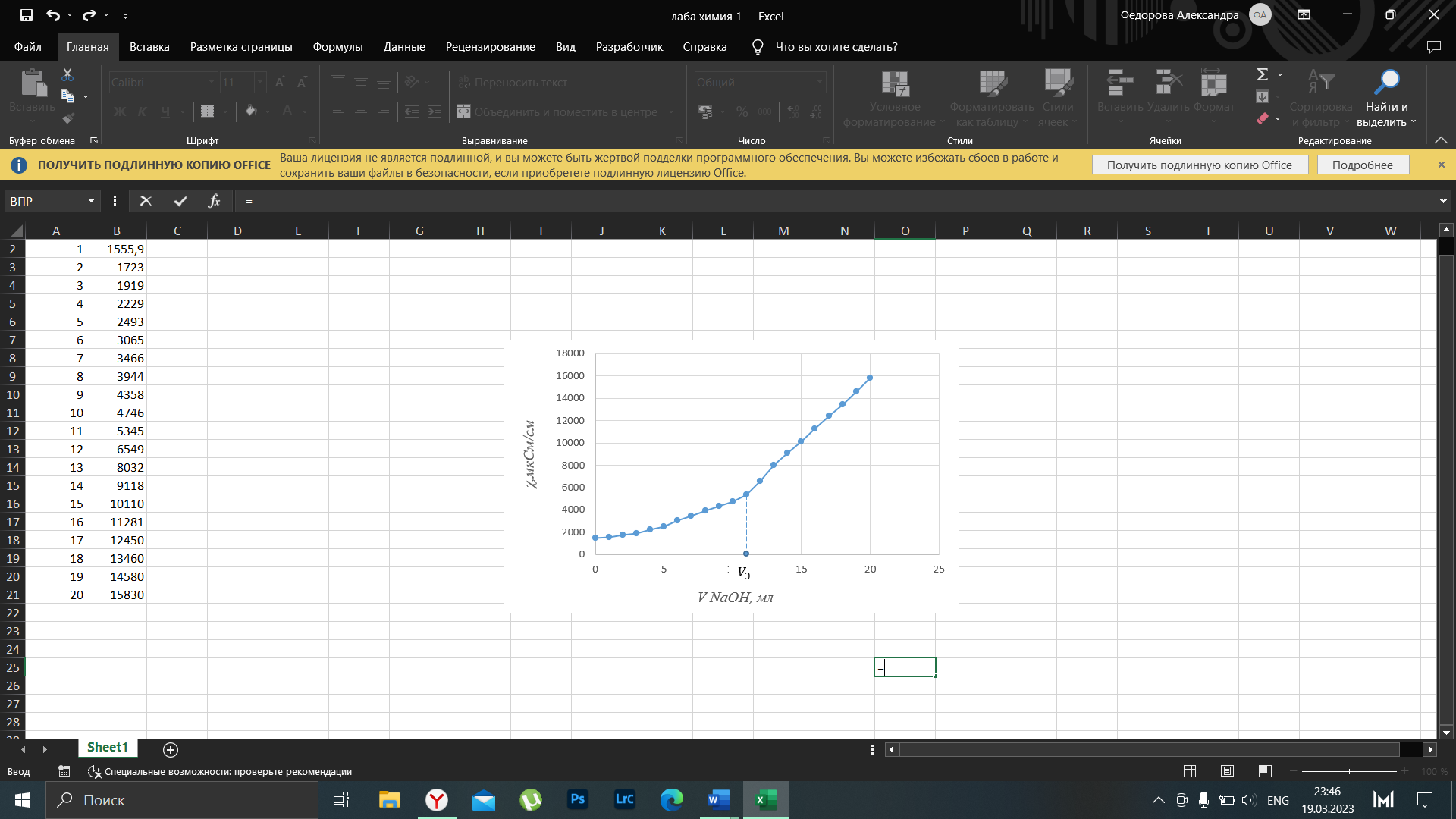 Рисунок 1 – Обработанное изображение кондуктометрической кривой титрования. По графику эквивалентный объем щелочи 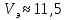 мл. мл.Точное значение концентрации слабого электролита вычисляется по формуле:
где 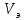 – эквивалентный объем щелочи, определенный по кривой титрования, мл; – эквивалентный объем щелочи, определенный по кривой титрования, мл;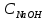 – концентрация раствора щелочи, экв./л; – концентрация раствора щелочи, экв./л;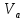 – объем аликвоты слабого электролита, мл. – объем аликвоты слабого электролита, мл.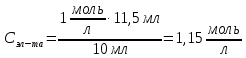 2 Определение константы и степени диссоциации слабого электролита 2.1 Вычисление эквивалентной электропроводности каждого раствора по формуле:
где 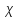 – удельная электропроводность, См/м; – удельная электропроводность, См/м;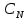 – нормальная концентрация раствора слабого электролита, экв/л. – нормальная концентрация раствора слабого электролита, экв/л.Пример расчета эквивалентной электропроводности для СN=0,1экв/л. Для последующих значений вычисления проведены аналогично. 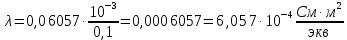 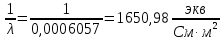 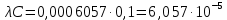 Таблица 4 – Зависимость величин эквивалентной и удельной электропроводностей раствора от концентрации слабого электролита
Примечание – Так как уксусная кислота одноосновна, то ее молярная масса равна эквиваленту. Следовательно, нормальная концентрация равна молярной концентрации. 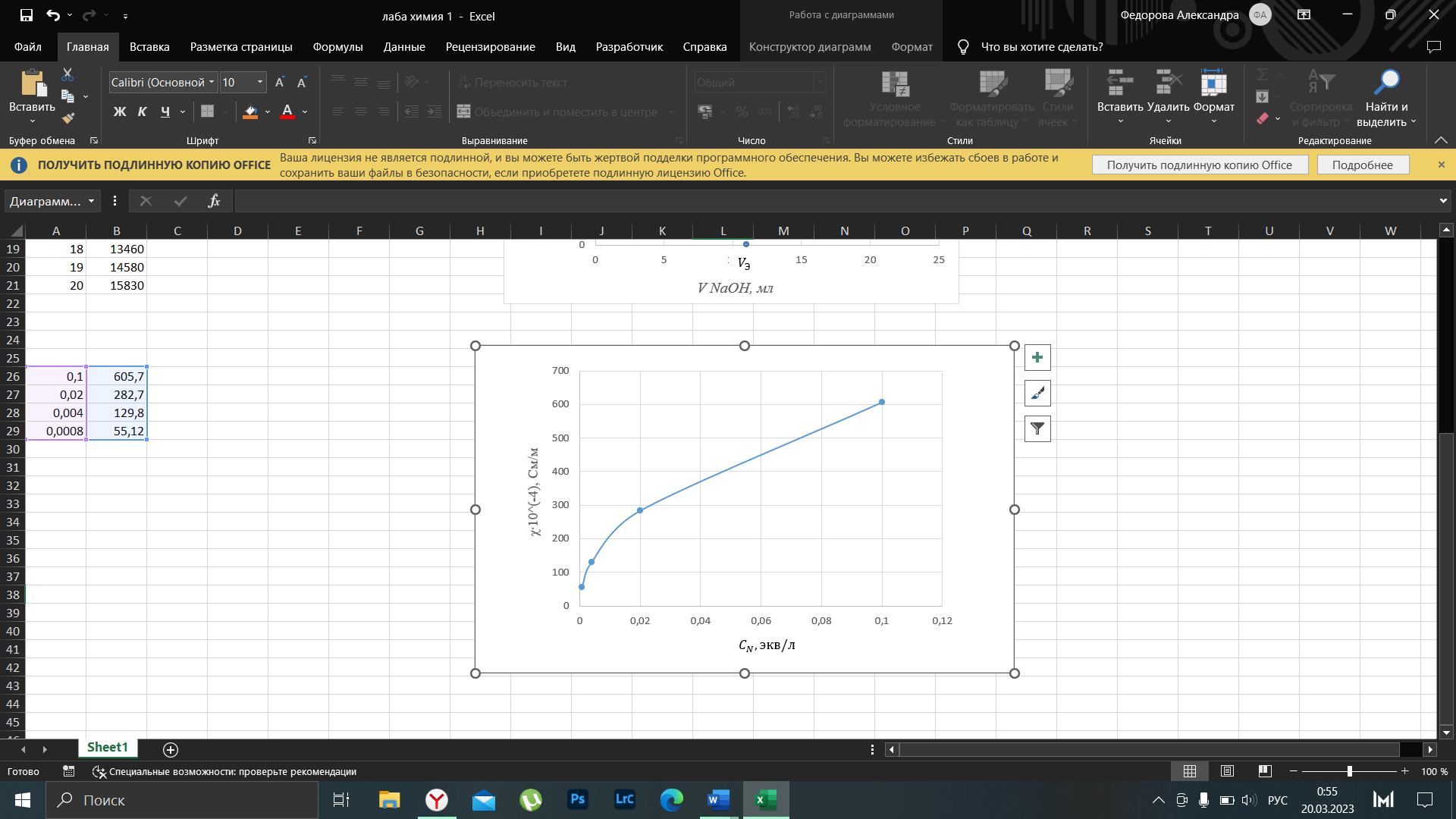 Рисунок 3 – График зависимости = f(C) 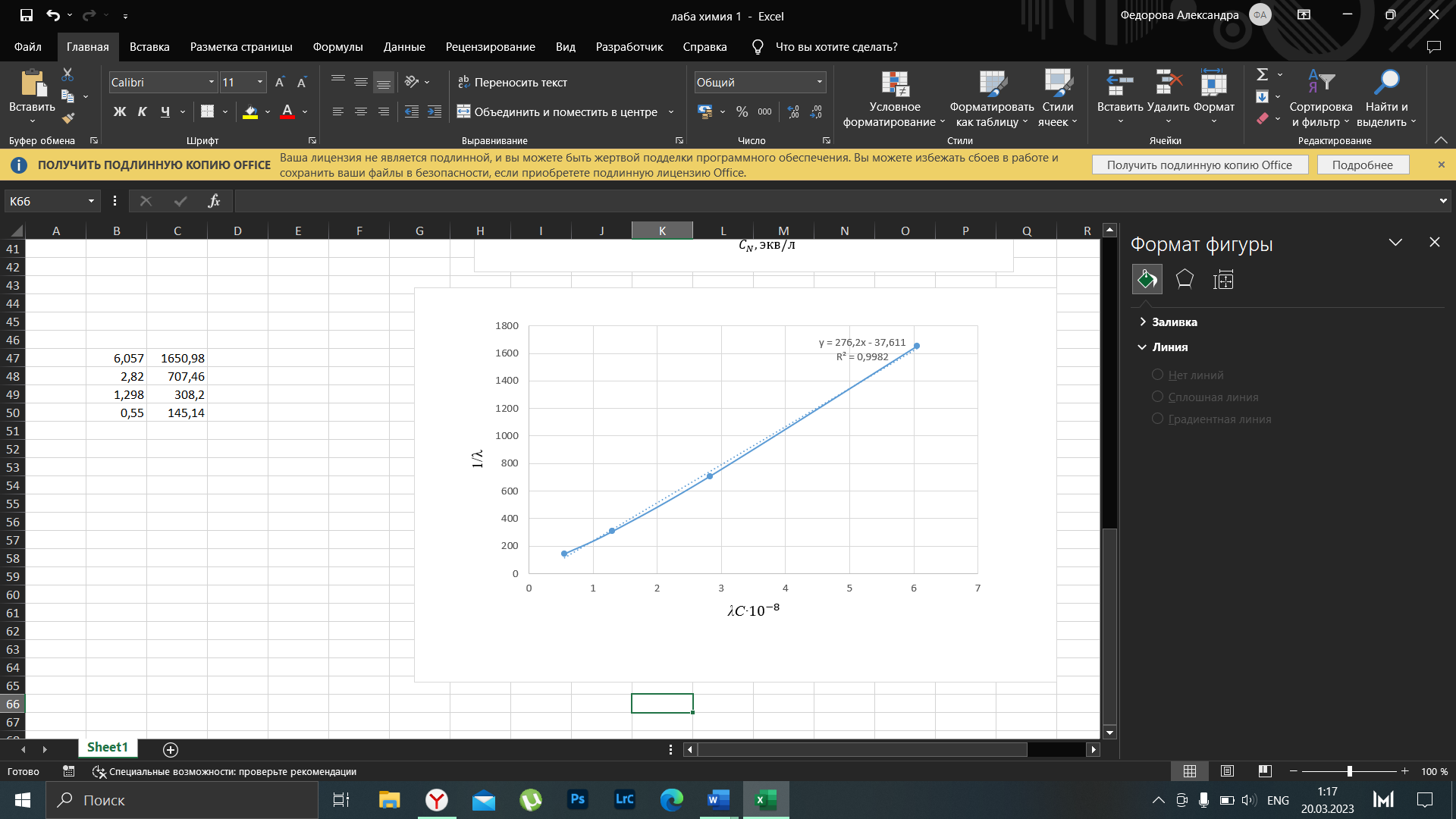 Рисунок 4 – График зависимости 1/λ = f(λС) По графику линия тренда пересекает ось ординат при 1/λ=-37,611. Используя абсолютное значение 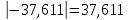 , получим следующее: , получим следующее: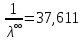 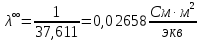 По справочным материалам для уксусной кислоты: 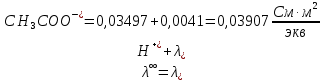 2.2 Расчет значения степени диссоциации по уравнению:
где 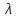 – эквивалентная электропроводность соответсвующего раствора, См∙м2/экв; – эквивалентная электропроводность соответсвующего раствора, См∙м2/экв;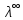 – предельная эквивалентная электропроводность уксусной кислоты при – предельная эквивалентная электропроводность уксусной кислоты при 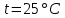 , , 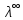 =0,03907См∙м2/экв. =0,03907См∙м2/экв.Пример расчета степени диссоциацииСN=0,1экв/л. Для последующих значений вычисления проведены аналогично. 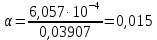 2.3 Расчет значения константы диссоциации по уравнению:
где 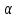 – степень диссоциации соответсвующего раствора; – степень диссоциации соответсвующего раствора;С – концентация, моль/л. Пример расчета константы диссоциации для С=0,1моль/л. Для последующих значений вычисления проведены аналогично. 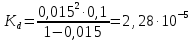 Таблица 5 – Значения степени и константы диссоциации
2.4 Расчет среднеквадратичного отклонения по уравнению:
где t– коэффициент Стьюдента. Для доверительной вероятности 0,95t = 3,2; n – количество измерений. 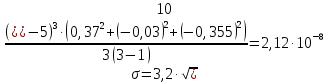 2.5 Окончательный результат 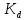 =(2,65±2,12)∙10-5 =(2,65±2,12)∙10-5 ЗАКЛЮЧЕНИЕ В процессе выполнения лабораторной работы были получены навыки кондуктометрического титрования, использования кондуктометра для измерения удельной электропроводности растворов. Практически полученное значение константы диссоциации уксусной кислоты несколько меньше теоретического при t=25˚C(Kd=2,65∙10-5). Возможно, неточность является следствием отличной от комнатной температуры в лаборатории и малого опыта экспериментальной работы обучающихся. Порядок вычисленного значения предельной эквивалентной электропроводности раствора уксусной кислоты совпадает со справочным, но экспериментально полученную величину не следует использовать в дальнейших расчетах из-за низкой точности. Вероятно,такое расхождение получено вследствие недостаточного очищения (промывки) электродов кондуктометра от предыдущего раствора. При выполнении работы была по достоинству оценена необходимость внимательности и аккуратности в проведении эксперимента. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ Глинка Н.Л. Общая химия — 1985. — С. 228-233 Расчет равновесий в аналитической химии. Константы диссоциации некоторых кислот[Электронный ресурс] URL: https://chemequ.ru/справочники/константы_диссоциации_кислот/ Санкова Л.А. КубГТУ. Применение метода кондуктометрического титрования в пищевой промышленности. Студенческий научный форум – 2017. [Электронный ресурс] URL: https://scienceforum.ru/2017/article/2017032001 Санкт-Петербург 2023 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

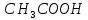
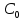 , моль/л
, моль/л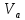 , мл
, мл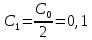
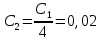
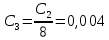
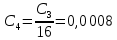
 ,мл
,мл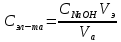
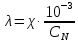
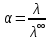
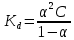
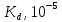
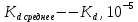
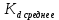 =2,65
=2,65