коллоквиум 1. Организация промышленного производства лекарственных препаратов. Промышленное производство растворов
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
Уникальность промышленных регламентов Во избежание возможных ошибок в процессе промышленного производства лекарственных средств не допускается составление и утверждение групповых регламентов даже в производстве с простыми технологическими процессами и однотипным оборудованием (таблетирование, ампулирование, изготовление мазей, капсул, настоек и т.п.). Исключение составляют регламенты, разработанные на производство лекарственных средств одного наименования разных дозировок (не более 3-х), выпускаемых по одной фармакопейной статье на однотипном оборудовании, а также регламенты на упаковку готовых лекарственных средств и производство фасованного лекарственного растительного сырья (трава, цветки, корни и т.п.) (не более 3-х). Допускается составление промышленного регламента с включением нескольких технологических линий однотипного оборудования при простых технологических процессах производства одного вида продукции, выпускаемого по одной технологической схеме. В этом случае на каждый препарат должны разрабатываться отдельные технологические инструкции. Фармакопейная статья (ФС) — это нормативно-технический документ, устанавливающий требования к качеству лекарственного средства или лекарственного растительного сырья, его упаковке, условиям и сроку хранения, методам контроля качества, утверждаемый уполномоченным федеральным органом исполнительной власти и носящий характер государственного стандарта. Материальный баланс. Его значение. Расчеты выхода, траты, расходного коэффициента, расходных норм. При производстве готовых лекарственных средств количество готового продукта, с учетом побочных продуктов и отходов, всегда меньше количества исходных материалов, Объясняется это имеющимися на каждом производстве материальными потерями, которых тем больше, чем менее совершенен технологический процесс. Это положение можно выразить следующим равенством: С1=(С2 + С3 + С4) + С5, приведенное уравнение называется уравнением материального баланса. Материальный баланс – соотношение между количеством исходного сырья, материалов, полупродуктов и промежуточной продукции (С1), использованных в производстве, и количеством фактически полученной готовой продукции (С2), побочных продуктов (С3), отходов или отбросов (С4) и потерь (С5), т, е. сравнение теоретически возможного и практически полученного выхода готовой продукции, В случае, если отходы и побочные продукты производства отсутствуют, уравнение материального баланса примет более простой вид: С1=С2+С5. Материальный баланс имеет большое практическое значение, так как он отражает степень совершенства технологического процесса. Чем он полнее составлен, тем, следовательно, детальнее изучена технология данного препарата; чем меньше в балансе разного рода потерь, тем правильнее осуществляется процесс производства. Наоборот, чем больше в балансе материальных потерь, тем меньше освоена технология данного препарата и тем больше в ней разного рода неполадок. Таким образом, материальный баланс дает возможность определить абсолютную величину материальных потерь (трату Σ). Из уравнения материального баланса находят технологический выход (η) и расходный коэффициент (Красх). Технологический выход η - это отношение массы готового продукта (G2) к массе взятых исходных материалов (G1), выраженное в процентах: η = G2/ G1* 100% , или при наличии отходов производства: η = G2/ G1- (G3 + G4 )* 100% Технологическая трата (Σ) - это отношение массы материальных потерь (G5) к массе исходных материалов (G1), выраженное в процентах: Σ = G5/ G1 *100% , или при наличии отходов производства Σ = G5/ G1- (G3 + G4 )*100% Чем меньше технологическая трата (Σ), тем рентабельнее производство. Расходный коэффициент (Красх)- это отношение массы взятых исходных материалов к массе полученного готового продукта. Красх величина безразмерная. Красх= G1 / G2 *100% или Красх= G1- (G3 + G4 ) / G2 *100% Расходный коэффициент всегда больше единицы, рассчитывается с точностью до 0,001. Чем меньше Красх, тем лучше организован технологический процесс. Умножая цифры прописи, составленной без учета материальных потерь, на расходный коэффициент получают рабочие прописи. Это необходимо для обеспечения выхода заданного количества готового продукта. Отражение контроля производства в технологическом (промышленном) регламенте. Понятие «контрольная точка» процесса производства лекарственного препарата. Примеры контрольных точек. Изложение технологического процесса (сведения о видах и количестве используемых и получаемых в производстве сырья, материалов, промежуточных продуктов, об отходах, допустимых потерях и выходе готового продукта) Описание технологических работ содержит: - санитарную подготовку персонала, помещений и оборудования; - осмотр и подготовку оборудования к работе; - подготовку и загрузку сырья; - ведение и контроль технологических работ; - выгрузку и передачу на дальнейшую обработку продуктов (промежуточных продуктов, отходов); - упаковку, маркировку и отгрузку готовой продукции. Критическая контрольная точка — это этап или процедура, где необходимо применение контроля, чтобы предотвратить, устранить или уменьшить опасность до приемлемого уровня. Примерами ККТ могут служить: температурная обработка, охлаждение, проверка ингредиентов на присутствие остатков химических веществ, контроль за составом продукта, проверка продукта на загрязнение металлами. Концепция критических Контрольных точек Применительно к процессу производства ССР (Critical Control Points) означает такую производственную операцию, при которой технологические параметры должны постоянно контролироваться (непрерывно измеряться в заданных пределах) для обеспечения требуемого качества продукции. В результате творческого развития ССР и была создана система НАССР, гарантировавшая производство готовой продукции необходимого качества. Система НАССР регламентирует все стадии производственного процесса — от обработки сырья до хранения и потребления конечных продуктов. При этом в качестве ССР был принят производственный процесс тех стадий, при которых изменение технологических параметров могло повысить вероятность производства опасных для потребителя продуктов питания. Терминология, раскрывающая риски и управление рисками в фармацевтическом производстве. Описание стандартного процесса управления рисками для качества продукции. Подходы к управлению рисками. Риски на фармпроизводстве и управление ими Управление рисками, связанными с качеством, является неотъемлемой частью эффективной системы менеджмента качества фармацевтического производства. Компании используют риск-ориентированный подход, который гарантирует, что процессы соответствуют требованиям системы менеджмента качества и локальным регуляторным требованиям. Анализ рисков в технологическом процессе Для каждого значимого показателя последовательно рассматривают операции технологического процесса, оказывающие на него влияние. При этом оценивают возможность обеспечения нормы рассматриваемого показателя (или его 100%-ного контроля) на последующих операциях. Основные принципы управления рисками Эффективность оценка рисков должна быть направлена на защиту пациента Научность при оценке рисков необходимо использовать научный подход и знания; Соразмерность уровень усилий, затраченных на оценку, документирование и устранение рисков должен соответствовать уровню рисков; ОБЯЗЯТЕЛЬНОСТЬ где применимо, принципы непрерывного улучшения системы менеджмента качества должны быть применимы КОМАНДА ПО УПРАВЛЕНИЮ РИСКАМИ Деятельность по управлению рисками качества осуществляют кросс-функциональной командой, которую возглавляет сотрудник отдела обеспечения качества. Кросс-функциональная команда включает экспертов в различных сферах. Для каждого процесса управления рисками определяются лица, имеющие необходимый опыт и знания, имеющие право принимать надлежащие и своевременные решения по управлению рисками качества. ЗАЧЕМ УПРАВЛЯТЬ РИСКАМИ? Управление рисками для качества на фармацевтическом производстве должно включать систематические процессы, предназначенные для координации, облегчения и совершенствования принятия научно-обоснованных решений в отношении рисков. Карты (схемы) процессов могут быть использованы для облегчения понимания, разъяснения и анализа сложных процессов и связанных с ними потенциальными рисками. ЭТАПЫ ПЛАНИРОВАНИЯ УПРАВЛЕНИЯ РИСКАМИ Определение проблемного и/или представляющего риск вопроса, включая соответствующие предположения, устанавливающие возможность риска; Сбор исходной информации и/или данных о потенциальной опасности, вреде или влиянии на здоровье человека, которые имеют отношение к общей оценке рисков; Выбор экспертов в группу (комитет), по общей оценке, рисков, назначение стартового совещания; Определение лидера группы и необходимых ресурсов; Проработка карт процессов (при необходимости) для целей определения рисков на каждом шаге процесса, визуализации шагов и их взаимосвязей и выявления критических шагов процесса. Этапы оценки рисков идентификация. Идентификация является описанием проблемы или аспектов риска на основании имеющихся данных и информации. Анализ. Предварительная оценка риска, связанная с идентификацией опасностей, процесс установления качественной и количественной связи между вероятностью происшествия и тяжестью потенциального вреда. Для некоторых инструментов управления рисками возможность определить опасность (способность к выявлению) также является фактором оценки риска. На основании анализа данных проводится оценка риска Оценка. «оценка риска» («Risk evaluation») означает сравнение идентифицированного и проанализированного риска с установленными критериями приемлемости. Технические и организационные меры для предупреждения и контроля рисков перекрёстной контаминации. Для предотвращения перекрестной контаминации следует предусмотреть такие технические и организационные мероприятия как: - разделение зон производства (обязательное для таких препаратов, пенициллины, живые вакцины, бактериальные препараты из живых микроорганизмов и некоторые другие биологические препараты) или разделение циклов их производства во времени, с соответствующей уборкой помещения и оборудования между циклами; - организация воздушных шлюзов и вытяжных устройств; - снижение риска контаминации, вызываемой рециркуляцией или повторным поступлением необработанного или недостаточно обработанного воздуха; - содержание защитной одежды в пределах зон производства продукции, создающей высокий риск перекрестной контаминации; - использование высокоэффективных методов очистки и обработки, вследствие того, что недостаточно эффективная очистка часто является причиной перекрестной контаминации. - использование «замкнутых схем» производства; - контроль наличия остатков и маркировка оборудования с указанием статуса чистоты. Претензии и отзыв продукции с фармацевтического рынка: принцип, претензии, отзыв продукции. Претензии и отзыв продукции с рынка Все претензии и информация, касающиеся потенциально недоброкачественных лекарственных средств, тщательно расследуются в соответствии с утвержденными процедурами. Производитель имеет систему быстрого и эффективного отзыва с рынка продукции с выявленными или предполагаемыми нарушениями качества. - п. 256. Правил GMP. Претензия Все претензии и информация, касающиеся потенциально недоброкачественных лекарственных средств, тщательно расследуются в соответствии с утвержденными процедурами. Производитель имеет систему быстрого и эффективного отзыва с рынка продукции с выявленными или предполагаемыми нарушениями качества. Производитель должен назначить работника, ответственного за рассмотрение претензий и принятие решений, имеющего право привлекать необходимый персонал. Если этот работник не является уполномоченным лицом, то уполномоченное лицо должно быть поставлено в известность обо всех фактах предъявления претензий, расследований и отзывов продукции. Действия по рассмотрению претензий на потенциально недоброкачественные лекарственные средства и по принятию решения об отзыве продукции должны быть изложены в соответствующих утвержденных процедурах. Любая претензия по качеству продукции должна быть зарегистрирована с указанием исходных данных и тщательно расследована. К этой работе, как правило, следует привлекать лицо, ответственное за контроль качества продукции. Если обнаружено или подозревается несоответствие качества какой-либо серии продукции установленным требованиям, необходимо принять решение о проверке аналогичных серий, а также тех серий, которые могут включать продукты, полученные при переработке недоброкачественной серии. Решения и меры, принятые по результатам рассмотрения любой претензии, должны быть зарегистрированы и включены в соответствующее досье на серию. Записи рассмотрения претензий должны регулярно анализироваться с целью выявления специфических и повторяющихся факторов, которые требуют особого внимания и могут привести к отзыву продукции. Особое внимание необходимо уделять оценке того, является ли причиной претензии фальсификация продукции. В случае если производитель предпринимает действия, являющиеся следствием возможных ошибок в производстве, ухудшения качества продукции, выявления фальсифицированной продукции или других серьезных проблем, связанных с качеством продукции, должен быть проинформирован соответствующий уполномоченный федеральный орган исполнительной власти. Отзыв продукции с рынка Производитель должен назначить работника, ответственного за своевременный отзыв продукции с рынка, имеющего право привлекать необходимый персонал. Как правило, этот работник должен быть независимым от подразделений реализации и маркетинга. Если этот работник не является уполномоченным лицом, то уполномоченное лицо должно быть осведомлено обо всех фактах отзыва продукции. Порядок отзыва продукции должен быть регламентирован утвержденной процедурой, которую следует регулярно проверять и при необходимости пересматривать. Отзыв продукции должен осуществляться оперативно и в любое время. Компетентные органы всех стран, куда была направлена продукция, должны быть немедленно информированы о принятии решения об отзыве продукции в связи с подозрением или обнаружением несоответствия ее качества. Записи по отгрузке должны быть доступны лицу (лицам), ответственному(ым) за отзыв продукции, и содержать достаточную информацию об организациях оптовой торговли лекарственными средствами и прямых заказчиках (адреса, номера телефонов и (или) факсов в рабочее и в нерабочее время, номера серий и объемы поставок), включая экспортные поставки и поставки образцов лекарственных средств. Отозванную продукцию необходимо промаркировать и хранить отдельно в безопасной зоне вплоть до принятия решения о ее дальнейшем использовании или уничтожении. Последовательность действий при отзыве продукции должна быть оформлена документально. Окончательный отчет должен содержать материальный баланс между количеством поставленной и возвращенной продукции. Эффективность мероприятий по отзыву продукции должна регулярно анализироваться. Самоинспекция на фармацевтическом предприятии: цель, объекты самоинспекции ,лица, проводящие самоинспекцию, результаты. Самоинспекция на производстве Самоинспекция проводится с целью проверки выполнения производителем требований настоящих Правил и предложения необходимых корректирующих действий. Вопросы, касающиеся персонала, помещений, оборудования, документации, технологического процесса, контроля качества, реализации лекарственных средств, мероприятий по работе с претензиями, отзывов продукции, а также деятельности по проведению самоинспекций, должны регулярно анализироваться в соответствии с заранее утвержденной программой по определенному графику для проверки их соответствия принципам фармацевтической системы качества. Самоинспекция должна проводиться независимо и тщательно специально назначенными квалифицированными лицами, состоящими в штате производителя. При необходимости может быть проведен независимый аудит производителя экспертами сторонних организаций. Результаты самоинспекций должны быть оформлены документально. Отчеты, составленные по результатам самоинспекций, должны включать в себя всю полученную информацию и необходимые корректирующие действия (где применимо). Действия, предпринимаемые по результатам проведенных самоинспекций, также следует оформлять документально. Характеристика и классификация растворов промышленного производства. Способы получения. Основные технологические стадии изготовления водных растворов, получаемых растворением индивидуальных веществ. Используемое оборудование.. Жидкие лекарственные формы - это свободные дисперсные системы с жидкой дисперсионной средой. Фармацевтические субстанции в них могут быть в трех агрегатных состояниях: твердом, жидком, газообразном. В зависимости от степени измельчения лекарственных веществ жидкие лекарственные формы могут представлять собой истинные растворы низкомолекулярных и высокомолекулярных соединений, коллоидные растворы, суспензии, эмульсии, а так же сочетание нескольких типов этих систем - комбинированные системы. Классификация ЖЛФ 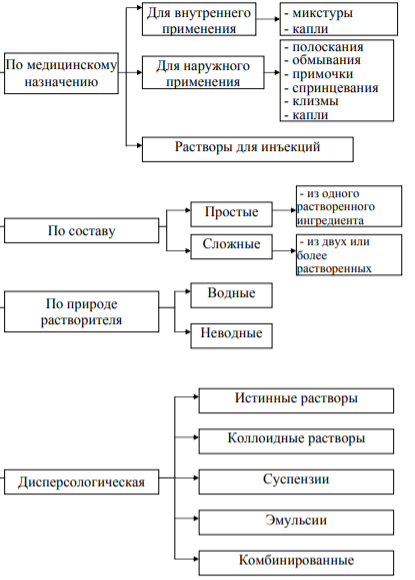 Виды ЖЛФ |
