Физика. Орієнтовний розподіл навчального часу
 Скачать 3.21 Mb. Скачать 3.21 Mb.
|
|
Тематична контрольна робота Варіант 1 1. (1 бал) На рисунку наведена схема електричного кола й показання амперметра. А Ціна поділки шкали амперметра 0,5 А. Б Напруга на резисторі дорівнює 1,5 В. В Сила струму в перерізі B менше, ніж у перерізі A. Г За 5 с у резисторі виділиться кількість теплоти, більша за 50 Дж.   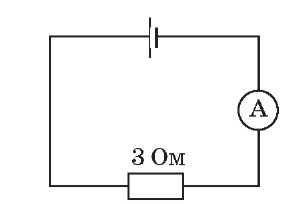 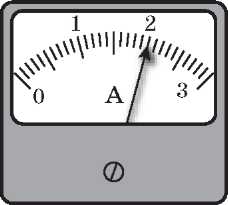 2. (1 бал) На рисунку наведені графіки залежності сили струму від напруги для провідників A і B. 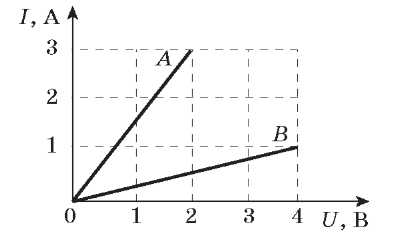 А Опір провідника A менший, ніж опір провідника B. Б Опір провідника A менший за 0,5 Ом. В Опір провідника B більший за 5 Ом. Г За той самий час за однакової напруги в провіднику A виділиться менша кількість теплоти, ніж у провіднику B. (2 бали) Чому тепловий рух електронів у провіднику не може бути названо електричним струмом? Поясніть свою відповідь. (2 бали) До кінців мідного й алюмінієвого провідників однакових розмірів прикладені однакові напруги. Чи однакові сили струму в них? Поясніть свою відповідь. (3 бали) Знайдіть напругу на резисторах R1 = 3 Ом ,R2 = 2 Ом, R3 = 4 Ом , якщо амперметр показує 6 А. 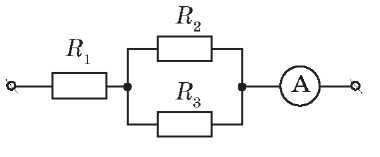 6. (3 бали) З якого матеріалу виготовлена спіраль нагрівного елемента, потужність якого 480 Вт, якщо його довжина дорівнює 16 м, переріз 0,224 мм2 і напруга в мережі 120 В?  ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ 1. Електронна провідність металів Класична електронна теорія так пояснює розходження властивостей провідників і діелектриків: в одних тілах наявні вільні носії зарядів, що можуть переміщатися в різних напрямках, а в інших тілах носії електричних зарядів зв'язані і можуть лише трохи зміщуватися в той чи інший бік. З-поміж твердих тіл зустрічаються тіла однакові за хімічним складом, але різні за електричними властивостями (наприклад, алмаз і графіт). Електричні властивості залежать, мабуть, від типу зв'язку атомів у твердих тілах. За фізичною природою зарядів — носіїв електричного струму в даному середовищі електропровідність поділяється на такі види: електронну, іонну та змішану. Між атомами в кристалах існує ковалентний зв'язок, за якого електрони слабко утримуються іонами кристалічних решіток. Ці так звані вільні електрони провідності можуть створювати струм у металах.  КирикЛ. А. · «Усі уроки фізики. 9 клас» Природа носіїв зарядів у металах доведена класичними дослідами Рікке, Мандельштамма-Папалексі та Толмена-Стюарта. Досвід Рікке дозволяє зробити висновок, що струм у металах здійснюється не іонами, а електронами. У цьому досліді з трьох послідовно з'єднаних металевих циліндрів (мідного, алюмінієвого й мідного) однакового радіуса й довжини було утворене коло. Через нього протягом року пропускали струм. Загалом через циліндри пройшов заряд 3,5 · 106 Кл. Ніяких слідів міді чи алюмінію при цьому не виявилося. Отже, електропровідність металів обумовлена переміщенням таких заряджених частинок, що, будучи загальними для всіх металів, не пов'язані з відмінностями їхніх фізичних і хімічних властивостей. Такими частинками є електрони. Прямі свідчення електронної природи струму в металі дали досліди Мандельштама-Папалексі (1913) і Толмена-Стюарта (1916). У цих дослідах було встановлене відношення заряду електрона до його маси: що відповідає виявленому раніше з інших дослідів. 2. З'ясуємо, чому виникає електричний опір у металах За відсутності електричного поля вільні електрони рухаються безладно. Поводження електронів при цьому нагадує поводження молекул у газі. Тому структуру металу можна уявити як іонний кістяк, поміщений в електронний газ. ^ Концентрація електронів провідності для більшості металів значна (1028-1029 м-3). Цим пояснюється гарна провідність металів. У зовнішньому електричному полі рух електронів уже не буде цілком хаотичним: вони одержують додаткову швидкість спрямованого руху в напрямку позитивного полюса джерела струму. Електрони починають спрямовано переміщатися між іонами, що знаходяться у вузлах кристалічних решіток, і виникає електричний струм. Під час руху електрони зіштовхуються з іонами кристалічних решіток. Ці зіткнення гальмують спрямований рух елек- тронів. Так спрощено можна пояснити причину електричного опору провідників. Під час зіткнення електрони передають іонам енергію, накопичену в електричному полі, що призводить до нагрівання провідника. Так звучить пояснення закону Джоу-ля-Ленца. Переконаймося в тому, що опір металів залежить від температури. Оскільки зі збільшенням температури зростає швидкість коливального руху йонів у кристалічних решітках металу, то ймовірність зіткнень електронів з іонами різко зростає. Можна припустити, що в разі підвищення температури опір металів збільшується. Як показують досліди, опір R провідника лінійно залежить від його температури: R = R0 (1 + at), де R0 — опір за 0 °C, t — температура, a — температурний коефіцієнт опору. Знайомимося з явищем надпровідності 1911 року голландський учений Г. Камерлінг-Оннес експериментально досліджував опір ртуті за низької температури. Під час охолодження ртуті рідким гелієм до температури 4,1 К (близько -269 °С) її опір падав до нуля. Це явище одержало назву надпровідності. Властивість надпровідності виявлена в багатьох металів (свинець, алюміній та ін.) і значній кількості сплавів. 1986 — 1987 рр. були відкриті високотемпературні надпровідники. Їхній опір перетворюється на нуль за температури 100 К. Явище надпровідності широко використовується в науці й техніці. Наприклад, надпровідні матеріали застосовують для одержання сильних магнітних полів. Якщо обмотку електромагніту виготовити з надпровідного провідника, то сила струму в обмотці досягає великих значень і, відповідно, електромагніт створює сильне магнітне поле. Практичне застосування надпровідності безупинно розширюється. Особливо великі надії покладаються на використання високотемпературних надпровідників. ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ 1. Якісні питання Як показати, що одні тіла є провідниками, а інші — непровідниками? Як рухаються електрони провідності в металевому провіднику, коли в ньому: а) немає електричного поля; б) створене електричне поле? Чому струм при замиканні кола починає текти одночасно по всіх провідниках? З якою швидкістю поширюється в провіднику електричне поле? 2. Навчаємося розв'язувати задачі Сила струму в провіднику 1 А. Скільки електронів проходить через поперечний переріз проводу за 1 нс? (Відповідь: 6,25 109.) До якої температури треба охолодити мідний провід, щоб його опір зменшився на 20 %? Початкова температура дорівнює 0 °С. (Відповідь: -47 °C. ) Що ми дізналися на уроці Електричний струм у металах являє собою спрямований рух вільних електронів. Будь-який провідник чинить опір електричному струму. Під час зіткнення електрони передають іонам енергію, накопичену в електричному полі, що призводить до нагрівання провідника. Домашнє завдання Підр.: § 18. Зб.: № 11.1; 11.2; 11.3; 11.18; 11.19; 11.36. Урок 25/31 Тема. Електричний струм у рідинах мета уроку: роз'яснити учням фізичну природу електропровідності рідин. Тип уроку: урок вивчення нового матеріалу. План уроку
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ 1. Знайомимося з електролітами Чи проводять рідини електричний струм? Розглянемо дослід. У посудину з дистильованою водою опустимо два електроди. Зберемо коло із джерела струму, ключа, лампочки та чутливого амперметра. Якщо замкнути коло, то стрілка амперметра не відхилиться. Це означає, що дистильована вода не містить вільних носіїв заряду й у колі немає струму. У такий же спосіб можна переконатися, що суха кам'яна сіль так само є діелектриком. А тепер «об'єднаємо» ці два діелектрики: насиплемо у посудину з водою дві-три ложки кам'яної солі. Ми побачимо, що лампочка загориться, причому в міру розчинення солі розжарення лампи збільшується. 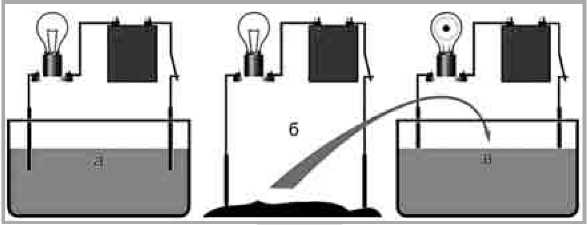 Цей дослід доводить, що підсолена вода є провідником, причому носії заряду з'являються під час розчинення солі у воді. За допомогою подібних дослідів можна визначити, що практично усі водні розчини солей, кислот і лугів є провідниками електричного струму. ^ Електролітами називаються речовини, розчини яких проводять електричний струм. Чим же обумовлюється провідність електролітів? 2. Електричний струм в електролітах Молекули солей, кислот і лугів утворені позитивними й негативними йонами, що утримуються силами електростатичного притягування. Наприклад, у молекулах кам'яної солі NaCl позитивно заряджений іон натрію Na+ притягується до негативного йона хлору Cl-. У водяному розчині молекули води послаблюють зв'язок між іонами: 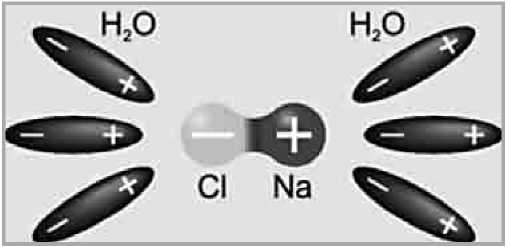 При зіткненнях, обумовлених тепловим рухом, молекула розпадається на позитивні й негативні йони, що стають носіями заряду в електроліті. Таким чином, носіями заряду в електролітах є йони, тобто електроліти мають іонну провідність. ^ Розпад молекул на йони називають електролітичною дисоціацією. Зі збільшенням температури ступінь дисоціації зростає, а, отже, збільшується концентрація позитивно і негативно заряджених іонів. У розчині може відбуватися також процес, що називається рекомбінацією. ^ Рекомбінація — процес з'єднання йонів у нейтральні молекули. Між процесами електролітичної дисоціації й рекомбінації йонів за незмінних умов установлюється динамічна рівновага, за якої число молекул, що розпадаються на йони за одиницю часу, дорівнює числу пар іонів, що за цей час з'єднуються в нейтральні молекули. Іони в електролітах рухаються хаотично доти, поки в рідину не опускаються електроди. Тоді на хаотичний рух іонів накладається їхній упорядкований рух до відповідних електродів, і в рідині виникає електричний струм. За йонної провідності проходження струму пов'язане з переносом речовини. На електродах відбувається виділення речовин, що входять до складу електролітів. ^ Процес виділення речовини на електродах при проходженні електричного струму через електроліт називають електролізом. На аноді негативно заряджені йони віддають свої зайві електрони (у хімії цей процес називається окисною реакцією), а на катоді позитивні йони одержують електрони, яких не вистачає (відновна реакція). 3. Закон Фарадея Кожний іон, що в процесі електролізу нейтралізується на електроді й виділяється на ньому у вигляді нейтрального атома, має визначену масу. Але водночас він переносить через електроліт визначений заряд. Тому і маса речовини, що виділилася, і кількість електрики, що пройшла, пропорційні числу йонів, що підходять до даного електроду. Кількісно закон електролізу був установлений дослідним шляхом Майклом Фарадеєм у першій половині ХІХ сторіччя. Фарадей виявив, що ^ маса речовини, яка виділилась на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт.  КирикЛ. А. · «Усі уроки фізики. 9 клас» m = kq. Оскільки q = It, де I — сила струму, t — час проходження струму, то m = kit. Сталу k називають електрохімічним еквівалентом речовини. Зміст цього коефіцієнта можна з'ясувати з виразу: ^ Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики. Як бачимо, електрохімічні еквіваленти неоднакові не тільки для різних речовин, але й для тієї самої речовини в різних сполуках, у яких вона має різну валентність (наприклад, CuCl і CuSO4). Питання до учнів у ході викладу нового матеріалу ? Що являє собою електричний струм у рідинах? ? Які речовини є електролітами? Наведіть приклади. ? Чи відбувається дисоціація в розчині, у якому немає електричного струму? ? Яка умова необхідна для виникнення спрямованого руху йонів у електроліті? ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ 1. Якісні питання Які речовини є електролітами? Чому електроліт загалом елек-тронейтральний? Що являє собою електричний струм в електролітах? Якими діями супроводжується проходження струму через електроліти? Чому при проходженні струму через розчин електроліту відбувається перенос речовини, а при проходженні через металевий провідник перенос речовини не відбувається? 2. Навчаємося розв'язувати задачі 1. Виразіть електрохімічний еквівалент речовини через масу й заряд іона цієї речовини.  Електромагнітні явища. Електричний струм Розв'язок. Маса m речовини, що виділилася на електроді, пов'язана з масою m0 одного йона і числом іонів N, які досягли електрода, співвідношенням m = Nm0. Заряд q, перенесений іонами, виразимо через кількість іонів N і заряд одного йона en, де е — модуль заряду електрона, а n — число зайвих (або тих, що не вистачає) електронів в іона (його валентність). Таким чином, одержуємо q = Nen. Таким чином, електрохімічний еквівалент дорівнює За якої сили струму проводився електроліз розчину CuSO4, якщо за 25 хв на катоді виділилося 2 г міді? (Відповідь: 4 А.) У процесі електролізу з водного розчину срібної солі виділилося 500 мг срібла. Який заряд пройшов через електролітичну ванну? (Відповідь: 450 Кл.) Що ми дізналися на уроці Електролітами називаються речовини, розчини яких проводять електричний струм. Розпад молекул на йони називають електролітичною дисоціацією. Рекомбінація — процес з'єднання йонів у нейтральні молекули. Процес виділення речовини на електродах під час проходження електричного струму через електроліт називають електролізом. Маса речовини, що виділилась на електроді при проходженні електричного струму, пропорційна заряду, що пройшов через електроліт. m= kq. Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики. Домашнє завдання Підр.: § 19. Зб.: рів1 — № 11.4; 11.5; 11.6; 11.20. рів2 — № 11.21; 11.22; 11.23; 11.24. рів3 — № 11.37, 11.38; 11.39; 11.40. Урок 26/32 |
