к занятию 1 БХ. Основные термины Аминокислоты
 Скачать 281.5 Kb. Скачать 281.5 Kb.
|
|
Основные термины: Аминокислоты - производные карбоновых кислот, у которых один атом водорода замещен на аминогруппу. Пептиды - органические вещества, состоящие из остатков аминокислот (<50), соединенных пептидной связью. В живых клетках пептиды синтезируются из аминокислот либо являются продуктами обмена белков. Многие природные пептиды обладают биологической активностью. Различают дипептиды, трипептиды и т.д., а также полипептиды. Пептидная (амидная) связь - ковалентная связь, возникающая в результате конденсации карбоксильной и аминогруппы. Полипептиды - полимеры, построенные из остатков аминокислот (>50). Условная граница между полипептидами и белками лежит в области молекулярной массы 6000 (приблизительно 100 аминокислотных остатков). Многие антибиотики, гормоны, токсины по химической природе полипептиды. Белки (протеины) - природные полимеры аминокислот, содержащие более 100 аминокислотных остатков. Конформация молекулы – расположение частей молекулы белка в пространстве. Для большинства классов белков пространственная структура в физиологических условиях полностью определяется аминокислотной последовательностью. Гидролиз белка – расщепление белка на аминокислоты с участием воды. Ионизация радикалов аминокислот в воде – диссоциация карбоксильных и протонирование аминогрупп. Изоэлектрическое состояние аминокислот и белков – равенство отрицательных и положительных зарядов в молекулах аминокислот или белков. Изоэлектрическая точка аминокислот и белков – значение рН среды, при котором наступает изоэлектрическое состояние. Амфотерность белка – способность белка проявлять кислотные и основные свойства. Растворимость белка – распределение молекул белка среди молекул растворителя (воды). Факторы растворимости белка: заряд аминокислот и белков, гидратная оболочка и целостная третичная структура. Осаждение белка – утрата факторов растворимости белка и выпадение белка в осадок. Изоэлектрическое осаждение белка – нейтрализация белка (суммарный заряд = 0) в результате изменения рН среды и выпадение белка в осадок. Денатурация белка – разрушение четвертичной, третичной и вторичной (но не первичной) структур белка, разворачивание полипептидной цепи с выходом гидрофобных групп на контакт с водой с последующей потерей растворимости и биологической активности (нативных свойств) белка. Высаливание белка – осаждение белка при воздействии электролитов (солей щелочных и щелочноземельных металлов, слабых кислот, щелочей и т.д.) вследствие дегидратации и нейтрализации заряда молекул белка. Диализ – свойство мембран пропускать только вещества с малой молекулярной массой и задерживать высокомолекулярные соединения. Сложные белки – содержат простой белок (апопротеин) и небелковый компонент (простетическую группу). Простетическая группа – небелковая часть сложного белка. Поскольку разные белки высаливаются (осаждаются) при различной концентрации солей, этот метод широко используется для фракционирования белков и получения относительно гомогенных белковых препаратов (альбуминов, глобулинов, белков-ферментов и др.). 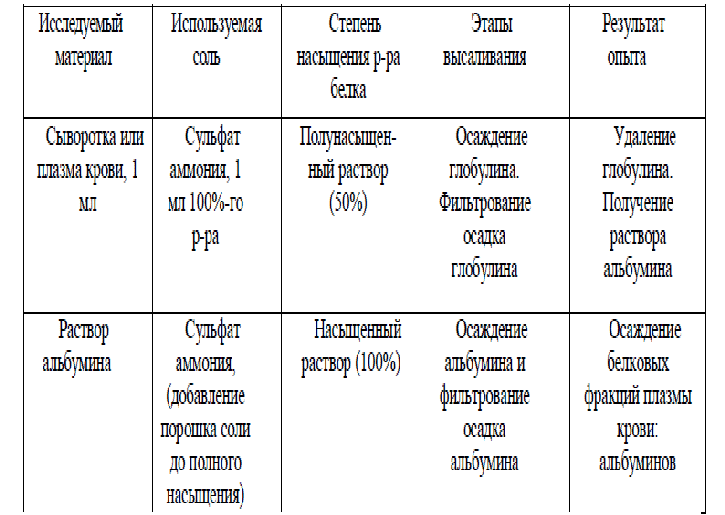 Под влиянием различных физических и химических факторов (нагревания, действия ультразвука, ультрафиолетового и радиоактивного излучения, концентрированных кислот, щелочей, солей тяжелых металлов, органических соединений, алкалоидов и многих других) белки денатурируют. При этих воздействиях в молекуле белка происходит разрушение слабых связей (водородных, электростатических, гидрофобных), формирующих четвертичную, третичную и вторичную структуры. Полипептидная цепь разворачивается, и гидрофобные радикалы понижают растворимость белка. Изменяются при этом физико-химические и, главное, биологические свойства белка.  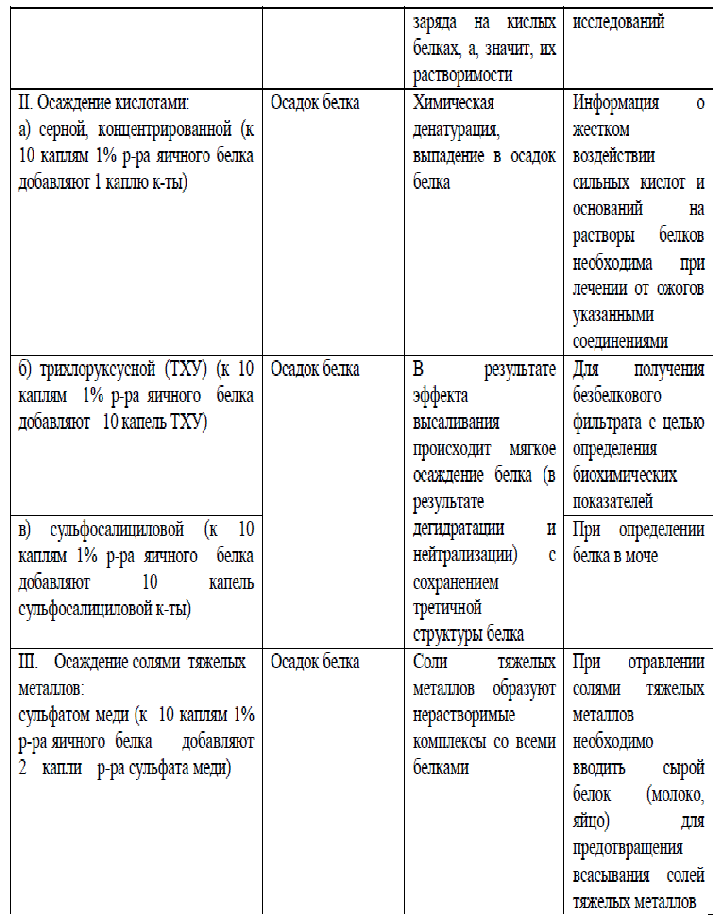 |
