Документ Microsoft Word. Особенности функционирования олигомерных белков
 Скачать 1 Mb. Скачать 1 Mb.
|
|
4.Особенности функционирования олигомерных белков. Кооперативность. Эволюционные преимущества олигомерных белков перед мономерными (сравнение гемоглобина и миоглобина). Регуляция функционирования гемоглобина. Особенности функционирования олигомерных белков. Олигомерные белки способны взаимодействовать с несколькими лигандами в центрах, удаленных от активного центра. Такие центры называются аллостерическими, а лиганды, способные с ними взаимодействовать,аллостерическими лигандами. Связывание одного протомера с лигандом изменяет конформацию этого протомера, а также всего олигомера (кооперативный эффект) и, кроме того, сродство к другим лигандам. Таким образом, функциональная активность олигомерных белков может регулироваться аллостерическими лигандами. 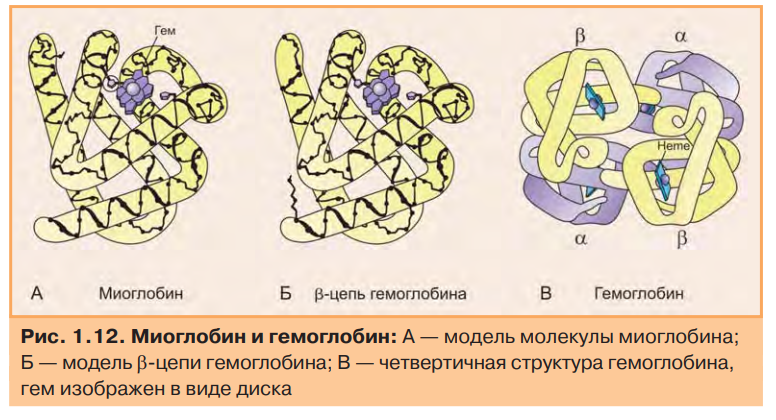 Особенности функционирования олигомерных белков можно рассмотреть на примере двух родственных гемопротеинов: миоглобина и гемоглобина. Миоглобин — мономер (состоит из одной полипептидной цепи), основная его функция — запасание кислорода в тканях. Имея высокое сродство к кислороду, миоглобин легко присоединяет его и отдает митохондриям только при интенсивной мышечной работе, когда парциальное давление кислорода падает ниже 10 мм рт.ст. Гемоглобин — тетрамер (состоит из четырех протомеров). Основная функция гемоглобина — транспорт кислорода от легких к тканям. В легких, где парциальное давление кислорода высокое, гемоглобин взаимодействует с четырьмя молекулами кислорода. Транспорт кислорода из капилляров в ткани происходит в результате снижения парциального давления О2 и сродства оксигенированного гемоглобина к кислороду. На рис. приведены данные о способности миоглобина и гемоглобина связывать кислород. 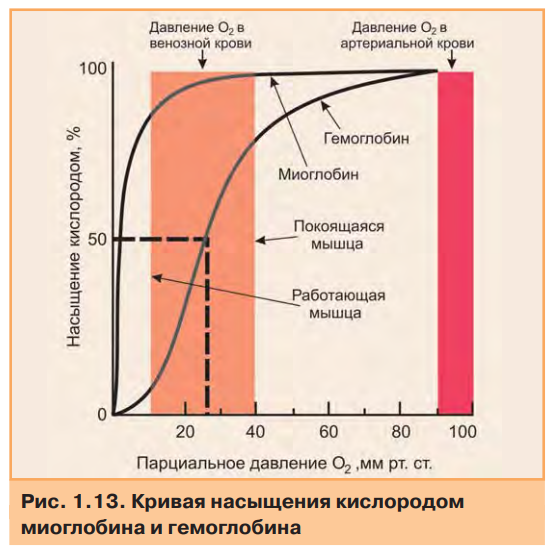 Гиперболическая форма кривой у миоглобина характерна для процесса связывания одной молекулы лиганда (в данном случае О2) с активным центром в белковой молекуле, состоящей из одной полипептидной цепи. Сигмоидная кривая, полученная для гемоглобина, характерна для белков, содержащих несколько пептидных цепей и имеющих несколько мест связывания. На ход кривой влияет кооперативный эффект, который наблюдается при связывании нескольких лигандов с олигомерной молекулой. Связывание О2 с атомом Fe2+ вызывает его перемещение в плоскость гема. А это, в свою очередь, вызывает перемещение остатка гистидина, связанного с атомом Fe2+ (рис. 1.14А). Изменение положения гистидина приводит к разрыву некоторых слабых связей в протомере, вследствие чего несколько изменяется конформация этого протомера, а поскольку все протомеры связаны между собой, то также и других протомеров. Изменение конформации облегчает взаимодействие протомеров с О2. В результате присоединение четвертой молекулы О2 происходит в 300 раз легче, чем первой (рис. 1.14Б). 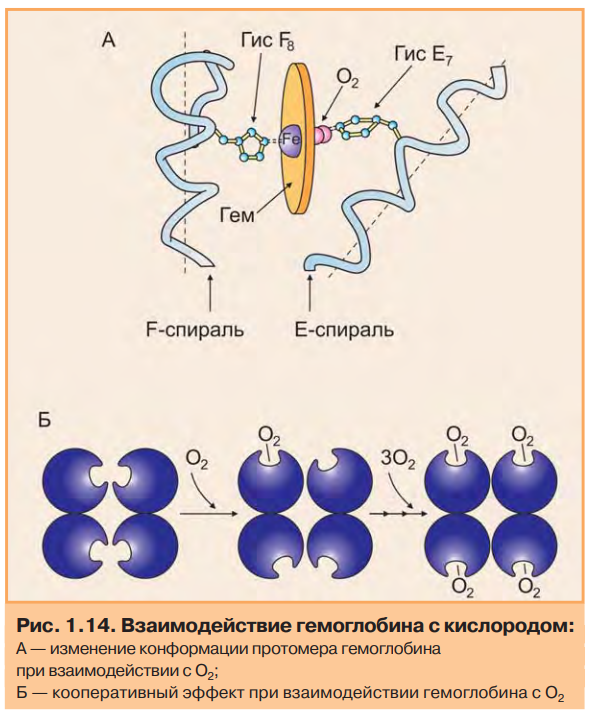 Таким образом,кооперативный эффект в изменении конформации протомеров олигомерного белка проявляется в результате взаимодействия одного протомера со специфическим лигандом, ведущего к конформационным изменениям не только данного протомера, но и всего олигомерного белка, что приводит к изменению сродства других протомеров к лигандам. Регуляция функции олигомерных белков на примере изменения сродства гемоглобина к кислороду. Скорость и полнота переноса кислорода из легких в ткани зависит от изменения сродства гемоглобина к кислороду. В легких сродство Hb к кислороду повышается при присоединении каждой из последующих молекул кислорода по сравнению с предыдущими. Эта положительная регуляция описана ранее. Кроме того, существуют вещества: 2,3-бисфосфоглицерат (2,3-БФГ), ионы водорода — Н+ и СО2, снижающие сродство Hb к О2. Это отрицательная регуляция. С другой стороны, О2 снижает сродство Hb к этим веществам. Кислород, 2,3-БФГ, Н+ и СО2 действуют на сродство Hb как аллостерические регуляторы. В 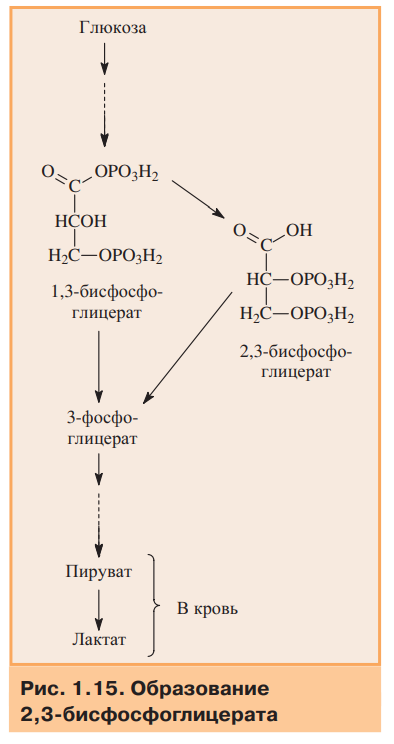 лияние 2,3-бисфосфоглицерата. 2,3-БФГ синтезируется в эритроцитах из 1,3-бисфосфоглицерата — метаболита, образующегося при окислении глюкозы (рис. 1.15). 2,3-БФГ имеет большой отрицательный заряд. В центральной части тетрамерной молекулы Hb имеется полость, содержащая положительно заряженные группы, расположенные на поверхностях обоих β-протомеров, приближенных друг к другу. 2,3-БФГ взаимодействует своими отрицательно заряженными фосфатными и карбоксильной группами с положительно заряженными группами β-цепей в центральной полости молекулы Hb (рис. 1.16). Результатом этого взаимодействия является образование 5 дополнительных ионных связей, что приводит к изменению конформации и снижению сродства Hb к О2, вследствие чего кислород поступает в ткани. В легких взаимодействие Hb с кислородом приводит к изменению конформации белка и вытеснению 2,3-БФГ из центральной полости. 2,3-БФГ реагирует только с дезоксигемоглобином, так как в оксигемоглобине полость с центром связывания 2,3-БФГ закрыта. лияние 2,3-бисфосфоглицерата. 2,3-БФГ синтезируется в эритроцитах из 1,3-бисфосфоглицерата — метаболита, образующегося при окислении глюкозы (рис. 1.15). 2,3-БФГ имеет большой отрицательный заряд. В центральной части тетрамерной молекулы Hb имеется полость, содержащая положительно заряженные группы, расположенные на поверхностях обоих β-протомеров, приближенных друг к другу. 2,3-БФГ взаимодействует своими отрицательно заряженными фосфатными и карбоксильной группами с положительно заряженными группами β-цепей в центральной полости молекулы Hb (рис. 1.16). Результатом этого взаимодействия является образование 5 дополнительных ионных связей, что приводит к изменению конформации и снижению сродства Hb к О2, вследствие чего кислород поступает в ткани. В легких взаимодействие Hb с кислородом приводит к изменению конформации белка и вытеснению 2,3-БФГ из центральной полости. 2,3-БФГ реагирует только с дезоксигемоглобином, так как в оксигемоглобине полость с центром связывания 2,3-БФГ закрыта.Влияние Н+ и СО2. СО2 является конечным продуктом катаболизма органических веществ. Окисление органических веществ происходит с использованием кислорода, доставляемого гемоглобином из легких. Образовавшийся СО2 поступает из тканей в кровь, и в эритроцитах происходит реакция образования Н2СО3, катализируемая карбангидразой (рис. 1.17). Угольная кислота затем диссоциирует на протон и ион бикарбоната. Протоны способны присоединяться к гемоглобину в участках, удаленных от гема. Протонирование гемоглобина изменяет конформацию и снижает его сродство к О2, тем самым способствуя поступлению кислорода в ткани. После освобождения кислорода в ткани эритроциты с током венозной крови попадают в капилляры легких, где происходят превращения, противоположные тем, которые протекали в тканях (рис. 1.17). В легких дезоксигемоглобин насыщается кислородом, что приводит к уменьшению сродства гемоглобина к протонам. Освобождающиеся Н+ нейтрализуют НСО3- с образованием Н2СО3, которая расщепляется карбангидразой на СО2 и Н2О. Образующийся СО2 удаляется с выдыхаемым воздухом. Равновесие реакции СО2 + Н2О ←→ Н2СО3 ←→ Н+ + НСО3- смещается влево в капиллярах легких и вправо в капиллярах тканей. Повышение сродства гемоглобина к кислороду в легких и снижение этого свойства гемоглобина в тканях обусловлены конформационными изменениями в олигомерной молекуле Hb. Эти перестройки являются следствием связывания молекулы Hb с лигандами — О2 или Н+. Регуляция сродства Hb к кислороду протонами называется эффектом Бора (датский физиолог). Эффект Бора тесно связан с транспортом СО2. Из вышеизложенного можно сделать вывод, что СО2 вытесняет О2 из Hb в тканях и обратное явление наблюдается в легких. Таким образом, продукты катаболизма органических веществ регулируют количество освобождаемого гемоглобином О2. Чем интенсивнее катаболизм веществ и выше концентрация ионов водорода и СО2, тем больше кислорода освобождается в тканях из оксигемоглобина. Из рассмотренных примеров следует заключить, что 2,3-БФГ и Н+, взаимодействующие с Hb в иных по сравнению с О2 участках (аллостерических центрах), вызывают значительные изменения в белковой молекуле, которые благодаря кооперативному эффекту влияют на активность центров связывания Hb с О2. Кооперативные изменения конформации олигомерных белков составляют основу регуляции активности не только Hb, но и многих других белков. |
