Обмен белков. Остаточный азот крови
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. 1. Окислительное дезаминирование Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. 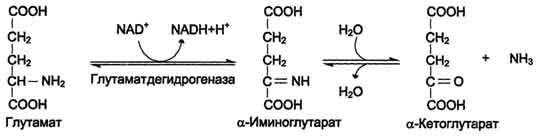 473 2. Неокислительное (гидролитическое) дезамитровате В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина неокислительным путём. 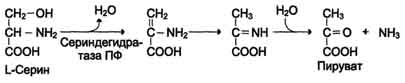 Ферменты пиридоксальфосфатзависимые. Ферменты пиридоксальфосфатзависимые.3. Неокислительное дезаминирование гистидина под действием фермента гистидазы (гистидин-аммиаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. 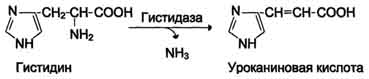 4. Внутримолекулярное дезаминирование с восстановлением. Тоже + реакция с НАД*Н.
Продуктами реакции являются СО2 и амины, которые оказывают выраженное биологическое действие на организм (биогенные амины): 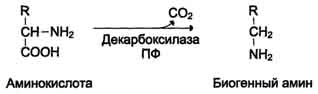 Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат.
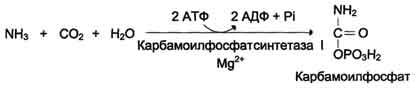
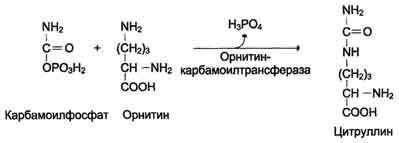
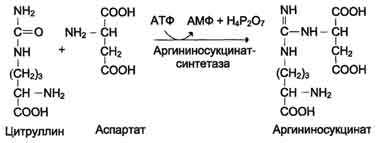
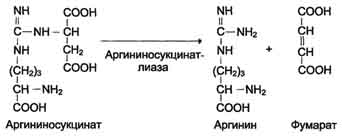
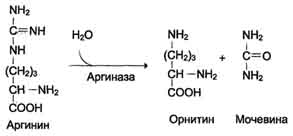
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. Процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта".
Аминокислоты, невсосавшиеся в клетки кишечника, используются микрофлорой толстой кишки в качестве питательных веществ. Ферменты бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения. Этот процесс иногда называют гниением белков в кишечнике. В основе гниения лежат реакции декарбоксилирования и дезаминирования аминокислот. Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путём разрушения боковых цепей аминокислот микробами. Всосавшиеся продукты по воротной вене поступают в печеНb, где обезвреживание фенола и крезола может происходить путём конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру. Скатол и индол обезвреживаются в печени в 2 этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана. Синтез гиппуровой кислоты из бензойной кислоты и глицина протекает у человека и большинства животных преимущественно в печени.
Франсуа Жакоб и Жак Моно в 1961 г. сформулировали гипотезу оперона, которая объясняла механизм контроля синтеза белков у прокариотов. Согласно теории Жакоба и Моно, оперонами называют участки молекулы ДНК, которые содержат информацию о группе функционально взаимосвязанных структурных белков, и регуляторную зону, контролирующую транскрипцию этих генов. Транскрипция структурных генов зависит от способности РНК-полимеразы присоединяться к промотору, расположенному на 5'-конце оперона перед структурными генами. Связывание РНК-полимеразы с промотором зависит от присутствия белка-репрессора на смежном с промотором участке, который называют "оператор". Белок-репрессор синтезируется в клетке с постоянной скоростью и имеет сродство к операторному участку. Структурно участки промотора и оператора частично перекрываются, поэтому присоединение белка-репрессора к оператору создаёт стерическое препятствие для присоединения РНК-полимеразы.
Клетки Е. coli обычно растут на среде, используя в качестве источника углерода глюкозу. Если в среде культивирования глюкозу заменить на дисахарид лактозу, то по прошествии нескольких минут клетки адаптируются к изменившимся условиям. Они начинают продуцировать 3 белка, обеспечивающих утилизацию лактозы. Перенос клеток на среду, содержащую лактозу, вызывает индукцию - увеличение количества молекул каждого из ферментов до 5000. Теория оперона объясняет это явление следующим образом. В отсутствие индуктора (лактозы) белок-репрессор связан с оператором. А поскольку участки оператора и промотора перекрываются, то присоединение репрессора к оператору препятствует связыванию РНК-полимеразы с промотором, и транскрипция структурных генов оперона не идёт. Когда в среде появляется индуктор, т.е. лактоза, то он присоединяется к белку-репрессору, изменяет его конформацию и снижает сродство к оператору. РНК-полимераза связывается с промотором и транскрибирует структурные гены. Когда клетки Е. coli растут на среде, содержащей в качестве единственного источника азота соль аммония, то им приходится синтезировать все аминокислоты. Однако если добавить в среду культивирования одну из аминокислот, например триптофан или гистидин, то клетка перестанет вырабатывать весь набор ферментов, необходимых для синтеза этих аминокислот. Это явление теория оперона объясняет следующим образом: при отсутствии в среде Гис или Три регуляторный белок-репрессор не имеет сродства к оператору и происходит синтез ферментов, осуществляющих образование этих аминокислот. Когда в среду добавляют, например, Гис, то эта небольшая молекула, получившая название "корепрессор", присоединяется к белку-репрессору. В результате конформационных изменений в молекуле репрессора комплекс бел-ка-репрессора и корепрессора (Гис) приобретает сродство к оператору, присоединяется к нему, и транскрипция оперона прекращается. 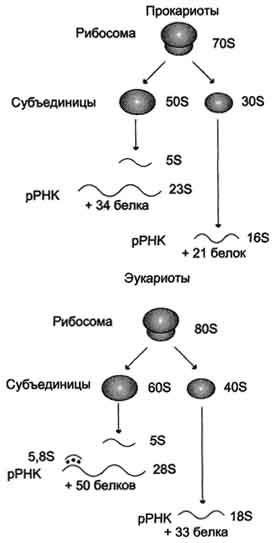
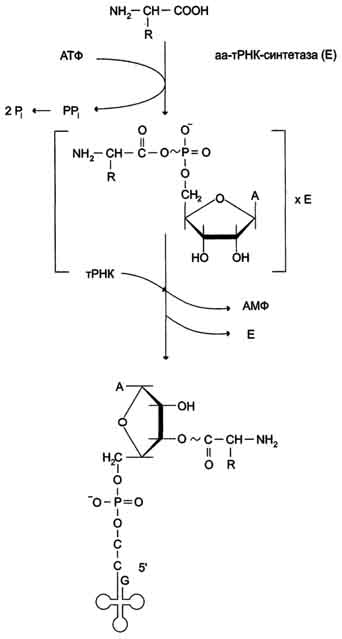
Роль. Служат для синтеза полипептидов из аминоксилот на основе заданной мРНК. =>
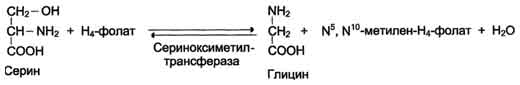 Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (Н4-фолат) Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат.
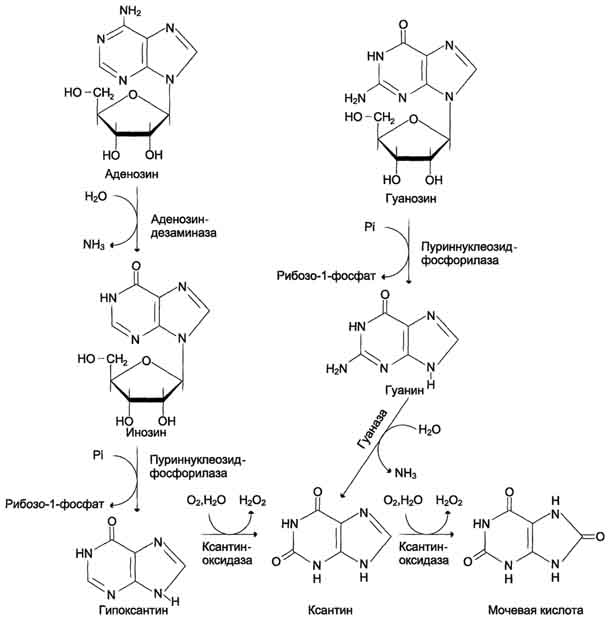
В сыворотке крови в норме содержание мочевой кислоты составляет 0,15-0,47 ммоль/л или 3-7 мг/дл. Ежесуточно из организма выводится от 0,4 до 0,6 г мочевой кислоты и уратов. Когда в плазме крови концентрация мочевой кислоты превышает норму, то возникает гиперурикемия. Вследствие гиперурикемии может развиться подагра - заболевание, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, синовиальной оболочке, подкожной клетчатке с образованием подагрических узлов, или тофусов. Основным препаратом, используемым для лечения гиперурикемии, является аллопуринол - структурный аналог гипоксантина (псевдосубстрат).
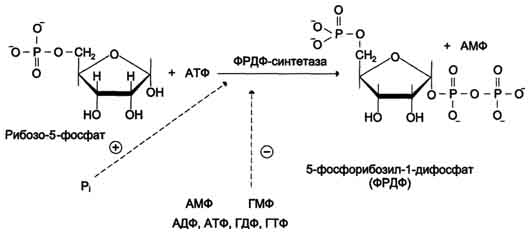
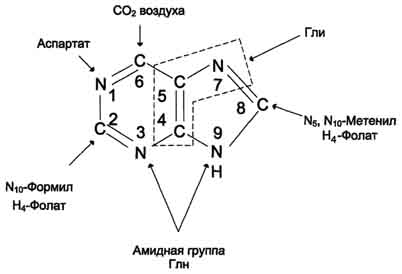
 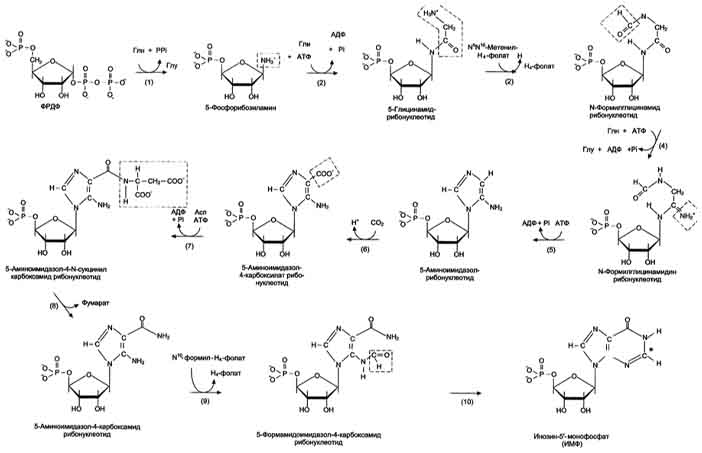 (1) – амидофосфорибозилтрансфераза. Далее к аминогруппе 5-фосфорибозил-1-амина присоединяются остаток глицина, N5,N10-метенил-Н4-фолата ещё одна амидная группа глутамина, диоксид углерода, аминогруппа аспартата и формильный остаток N10-формил Н4-фолата. Результатом этой десятистадийной серии реакций является образование первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ). (1) – амидофосфорибозилтрансфераза. Далее к аминогруппе 5-фосфорибозил-1-амина присоединяются остаток глицина, N5,N10-метенил-Н4-фолата ещё одна амидная группа глутамина, диоксид углерода, аминогруппа аспартата и формильный остаток N10-формил Н4-фолата. Результатом этой десятистадийной серии реакций является образование первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ). 
Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение (синтез фосфатидилхолина, карнитина, креатина). Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. 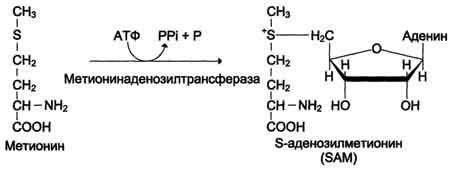 В результате отщепления метильной группы SAM превращается в S-аденозилгомоцистеин (SAT), который при действии гидролазы расщепляется на аденозин и гомоцистеин. S-аденозилгомоцистеин + Н2О → Аденозин + Гомоцистеин 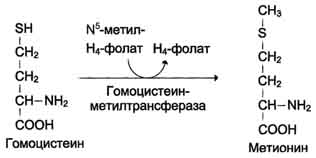 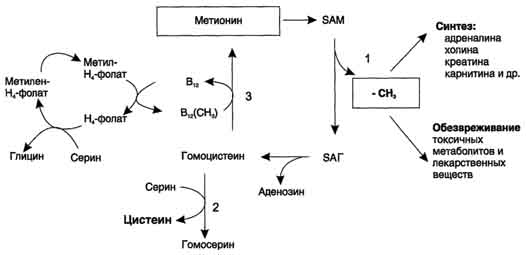 Рис. 9-27. Метаболизм метионина. 1 - реакции трансметилирования; 2 - синтез цистеина; 3 - регенерация метионина. 2. Обмен цистеина Для синтеза цистеина необходимы 2 аминокислоты: Серин - источник углеродного скелета; Метионин - первичный источник атома S (см. схему А). 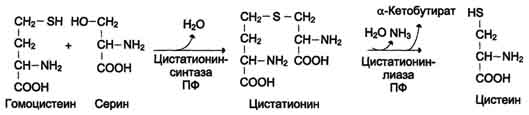 Катаболизм цистеина происходит окислительным путём. 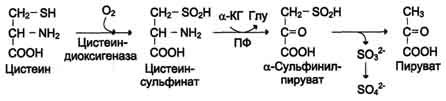
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ). 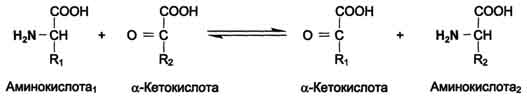 Основным донором аминогруппы служит глутамат. 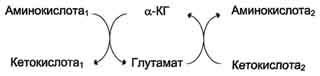 Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT). Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов. В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты. Для этой болезни характерно выделение с мочой большого количества гомогентизиновой кислоты, которая, окисляясь кислородом воздуха, образует тёмные пигменты алкаптоны. 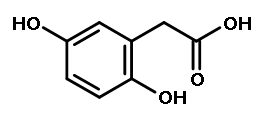
|