Обмен белков. Остаточный азот крови
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
Небелковый азот крови, азот веществ, остающихся после удаления белков плазмы. Состоит из азота мочевины (50%), АМК (25%), мочевой кислоты (4%), креатина (5%), креатинина (2,5%), эрготианина (8%),аммиака и индикана (0,5%). Еще 5% - глутатион, билирубин и др. белковые соединения. Норма 14,3-28,6 ммоль/л.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат. 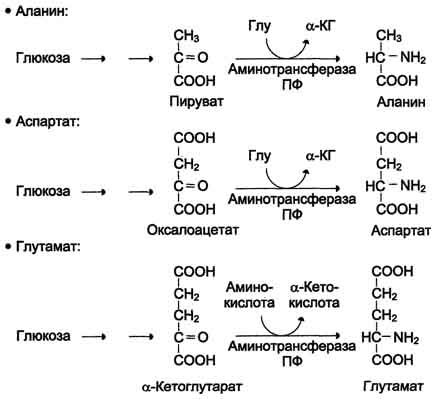 Амиды глутамин и аспарагин синтезируются из соответствующих дикарбоновых аминокислот Глу и Асп.
1) из серина с участием производного фолиевой кислоты в результате действия се-риноксиметилтрансферазы: 2) в результате действия фермента глицинсинтазы в реакции: 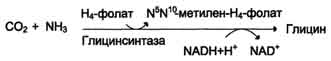
Кроме восьми перечисленных заменимых аминокислот, в организме человека могут синтезироваться ещё четыре аминокислоты. Частично заменимые аминокислоты Apr и Гис синтезируются сложным путём в небольших количествах. Большая их часть должна поступать с пищей.
Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно.
Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс - разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс может быть положительным (азота поступает больше, чем выводится) у детей, а также у пациентов, выздоравливающих после тяжёлых болезней. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний. Минимальное количество белков в пище, необходимое для поддержания азотистого равновесия, соответствует 30-50 г/cyt.
Детям до 12 лет достаточно 50-70 г белков в сутки. Безбелковое питание (особенно продолжительное) вызывает серьёзные нарушения обмена и неизбежно заканчивается гибелью организма. Исключение даже одной незаменимой аминокислоты из пищевого рациона ведёт к неполному усвоению других аминокислот и сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста и нарушениями функций нервной системы. Недостаточность белкового питания приводит к заболеванию, получившему в Центральной Африке название "квашиоркор. Заболевание развивается у детей, которые лишены животных белков. Квашиоркор характеризуется задержкой роста, анемией, гипопротеинемией (часто сопровождающейся отёками), жировым перерождением печени. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Часто это заболевание сопровождается атрофией клеток поджелудочной железы. В результате нарушается секреция панкреатических ферментов и не усваивается даже то небольшое количество белков, которое поступает с пищей. Происходит поражение почек, вследствие чего резко увеличивается экскреция свободных аминокислот с мочой. Длительная недостаточность белка приводит к необратимым нарушениям не только физиологических функций, но и умственных способностей. Заболевание исчезает при своевременном переводе больного на богатую белком диету, включающую большие количества мясных и молочных продуктов. Один из путей решения проблемы - добавление в пищу препаратов лизина.
Физиологический минимум белка, азотистый минимум – наименьшее количество поступающего с пищей белка, пи котором сохраняется азотистое равновесие = 30-50 г белков в сутки. Принятые нормы белкового питания для взрослых и детей учитывают климатические условия, профессию, условия труда и другие факторы. Взрослый человек при средней физической нагрузке должен получать 100-120 г белков в сутки. При тяжёлой физической работе эта норма увеличивается до 130-150 г. Детям до 12 лет достаточно 50-70 г белков в сутки. При этом подразумевается, что в пишу входят разнообразные белки животного и растительного происхождения.
Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов - гастринов, которые, в свою очередь, вызывают секрецию НСI и профермента - пепсиногена. Под действием НСl происходит денатурация белков пищи. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген (частичный протеолиз) и создаёт оптимум рН для действия пепсина. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) и несколько медленнее - образованные лейцином и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты. У детей грудного возраста в желудке находится фермент реннин (химозин), вызывающий свёртывание молока. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. В слизистой оболочке желудка человека найдена ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника.
17,2 кДж = 4,1 ккал
Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона – холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбоксипептидазы А и В. Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы. Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов. Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В. Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз (отщепляют N-концевые АМК) и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Те аминокислоты, синтез которых сложен и неэкономичен для организма, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят фенилаланин, метио-нин, треонин, триптофан, валин, лизин, лейцин, изолейцин. 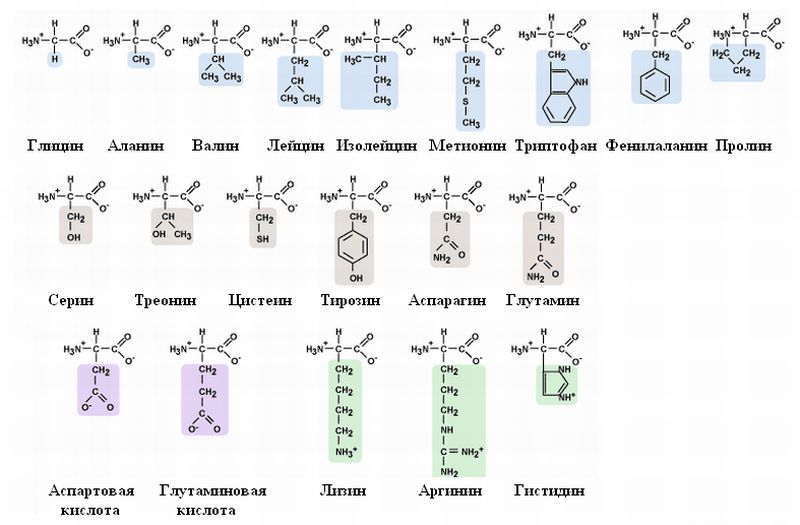 Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Некоторые их них содержат полный набор незаменимых аминокислот в оптимальных соотношениях, другие не содержат одной или нескольких незаменимых аминокислот. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном.
Белки, которые содержат неполный набор аминокислот, особенно незаменимых. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот.
Состояние белкового обмена определяется множеством факторов, как экзогенных (окружающая среда, характер питания и др.), так и эндогенных (физиологическое состояние организма, включающее нервно-гормональный статус, ферментная оснащенность и др.). Направление и интенсивность обмена белков в первую очередь определяются физиологическим состоянием организма и регулируются нейрогормональными факторами. Более интенсивно обмен белков протекает в детском возрасте, при активной мышечной работе, беременности и лактации, т.е. в случаях, когда резко повышаются потребности в белках. Существенное влияние на белковый обмен оказывает характер питания и, в частности, количественный и качественный белковый состав пищи. При недостаточном поступлении белков с пищей происходит распад собственных белков ряда тканей. Более существенное значение имеет, однако, качественный белковый состав пищи, так как отсутствие или недостаток хотя бы одной какой-либо незаменимой аминокислоты может служить лимитирующим фактором биосинтеза всех белков в организме. Степень усвоения белков и аминокислот пищи зависит также от количественного и качественного состава углеводов и липидов, которые резко сокращают энергетические потребности организма за счет белков. Обмен белков регулируется, кроме того, деятельностью желез внутренней секреции. Например, после введения АКТГ и гормонов щитовидной железы наблюдается интенсивный распад тканевых белков. Другие гормоны, в частности СТГ, андрогены и эстрогены, напротив, стимулируют анаболические реакции и способствуют синтезу белка.
См. вопросы 8 и 6. Биохимическую регуляцию обеспечивают гормонами ЖКТ. Ацетилхолин - стимулирует секрецию соляной кислоты через М-холинорецепторы париетальных клеток. Одновременно усиливает секрецию панкреатического сока. Гастрин - пептидный гормон, секретируется G-клетками пилорического отдела желудка в ответ на растяжение стенки желудка или повышение рН желудочного содержимого. Воздействует на главные и обкладочные клетки слизистой желудка, стимулируя секрецию как пепсиногена, так и соляной кислоты. Соматостатин - подавляет секрецию различных гормонально активных пептидов, вырабатываемых в желудке, кишечнике, печени и поджелудочной железе. Холецистокинин - пептидный гормон, синтезируемый, главным образом, клетками слизистой оболочки двенадцатиперстной кишки в ответ на поступление из желудка белков и жирных кислот в составе химуса. Он стимулирует сокращение желчного пузыря, секрецию желчи и пищеварительных ферментов поджелудочной железы.
Желудочный сок - продукт нескольких типов клеток. Обкладочные (париетальные) клетки стенок желудка образуют соляную кислоту, главные клетки секретируют пепсиноген. Добавочные и другие клетки эпителия желудка выделяют муцинсодержащую слизь. Париетальные клетки секретируют в полость желудка также гликопротеин, который называют "внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию. За сутки в желудке взрослого человека вырабатывается около 2 л желудочного сока.
НСI образуется в обкладочных клетках желудочных желёз в ходе реакций. Источником Н+ является Н2СО3, которая образуется в обкладочных клетках желудка. Ионы С1- поступают в просвет желудка через хлоридный канал. Концентрация НСl в желудочном соке может достигать 0,16 М, за счёт чего значение рН снижается до 1,0-2,0. Под действием НСl происходит денатурация белков пищи, не подвергшихся термической обработке, что увеличивает доступность пептидных связей для протеаз. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Кроме того, соляная кислота активирует пепсиноген и создаёт оптимум рН для действия пепсина.
Механизм активации – частичный протеолиз. От предшественника под действием какого-либо фактора (HCl, энтеропептидаза для трипсиногена, трипсин для хемотрипсиногена) происходит отщепление части белковой молекулы, что ведет к конформационному изменению фермента.
Поджелудочная железа, помимо всего прочего, синтезирует профермент прокарбоксипептидазу, которая в кишечнике под действием трипсина путем частичного протеолиза активируется и превращается в карбоксипептидазу.
Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка. Повышенная кислотность желудочного сока обычно сопровождается изжогой, диареей и может быть симптомом язвы желудка и двенадцатиперстной кишки, а также гиперацидного гастрита. Пониженная кислотность бывает при некоторых видах гастритов. Полное отсутствие НСl и пепсина (желудочная ахилия) наблюдается при атрофических гастритах и часто сопровождается пернициозной анемией вследствие недостаточности выработки фактора Касла и нарушения всасывания-витамина В12. Анацидность (рН желудочного сока >6,0) свидетельствует о значительной потере слизистой оболочкой желудка обкладочных клеток, секретирующих соляную кислоту, что часто вызывает рак желудка. Кислотность желудочного сока выражается в титрационных единицах (ТЕ) - количество 0,1 М NaOH в 1 мл, затраченное на титрование 100 мл желудочного сока по определённому индикатору. При определении кислотности желудочного сока различают: общую кислотность, связанную НСl и свободную НСl.
Молочная кислота в норме в желудочном соке отсутствует. Она образуется при уменьшении содержания или отсутствии свободной соляной кислоты в результате размножения молочнокислых бактерий или при злокачественных опухолях желудка, в клетках которых глюкоза окисляется анаэробным путём.
Заменимые аминокислоты: глицин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, серин, пролин, аланин. См. вопр.9.
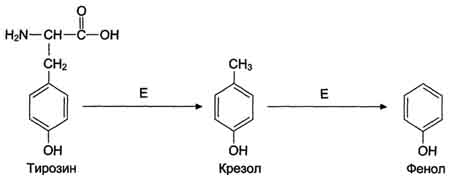 Под действием ферментов бактерий путём разрушения боковых цепей аминокислот микробами. Под действием ферментов бактерий путём разрушения боковых цепей аминокислот микробами.
|
