Определение степени диссоциации слабого электролита. Отчёт Лабораторная работа 3 По дисциплине Химия, часть 2 (наименование учебной дисциплины согласно учебному плану) Тема работы Определение константы диссоциации слабого электролита кондуктометрическим способом
 Скачать 178.14 Kb. Скачать 178.14 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра физической химии Отчёт Лабораторная работа №3 По дисциплине Химия, часть 2 (наименование учебной дисциплины согласно учебному плану) Тема работы: Определение константы диссоциации слабого электролита кондуктометрическим способом Выполнил: студент гр. НБ-21-1 Мотигулин Р.Р. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил руководитель работы: (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2023 Цель работы: определить степень и константу диссоциации слабой кислоты путем измерения электропроводности раствора. Сущность работы: электропроводность раствора электролита зависит от концентрации ионов в растворе и их подвижности. В растворах слабых электролитов концентрация ионов зависит от степени диссоциации. Получив зависимость электропроводности от концентрации электролита, вычисляют его степень диссоциации и константу диссоциации слабого электролита. Оборудование и реактивы: Кондуктометр; магнитная мешалка; химический стакан объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 1 шт.; химический стакан объемом 250 мл – 1 шт.; мерные колбы объемом 250 мл – 4 шт.; мерная пипетка объемом 50 мл – 1 шт.; мерная пипетка объемом 10 мл – 1 шт.; бюретка для титрования объемом 25 мл – 1 шт.; гидроксид натрия – раствор (концентрация указана на емкости с реактивом); слабая кислота – СН3СООН или НСООН – раствор (примерное значение концентрации указано на емкости с реактивом). Ход работы: I. Получение зависимости удельной электропроводности от содержания слабого электролита в растворе 1) Мерной пипеткой объемом 50 мл отбираем исходный раствор уксусной кислоты, помещаем его в мерную колбу № 1 на 250 мл, доводим до метки дистиллированной водой и перемешиваем; 2) Из колбы № 1 в колбу № 2 переносим при помощи мерной пипетки 50 мл раствора, доводим объем в колбе № 2 дистиллированной водой до метки и перемешиваем; 3) Повторяем с колбами № 3 и № 4; 4) Пробы приготовленных и исходного растворов отбираем в маркированные химические стаканы объемом 100 мл; 5) Измеряем удельную электропроводность приготовленных растворов слабой кислоты путем погружения электрода кондуктометра в стакан с раствором и заносим результаты в таблицу. II. Анализ концентрации раствора слабой кислоты методом кондуктометрического титрования. 1) Отбираем аликвоту уксусной кислоты 10 мл в химический стакан объемом 250 мл; 2) В бюретку заливаем раствор гидроксида натрия и «зануляем» бюретку. 3) Ставим пробу на магнитную мешалку, помещаем в раствор якорь магнитной мешалки и погружаем в стакан электрод кондуктометра; 4) Доливаем в стакан для титрования дистиллированную воду до закрытия щели электрода раствором, включаем магнитную мешалку и фиксируем показания кондуктометра. 5) Приливаем гидроксид натрия из бюретки порциями по 1 мл, фиксируя после каждой порции щелочи значение электропроводности раствора. 6) Титрование продолжаем до получения изменения хода зависимости удельной электропроводности от объема щелочи, данные заносим в таблицу. Экспериментальные данные: Таблица №1. Исходные данные
Таблица 2. Зависимость удельной электропроводности от концентрации слабого электролита
Таблица 3. Данные для построения кривой кондуктометрического титрования
Обработка экспериментальных данных: I. Определение точного значения концентрации слабого электролита 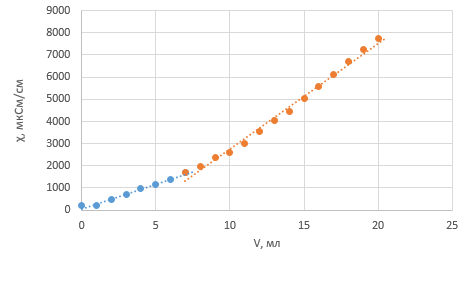 Обработка результатов эксперимента Обработка результатов эксперимента Рисунок 1 - Кривая кондуктометрического титрования Исходя из графика кривой, делаем вывод, что эквивалентный объем Vэ = 7 мл. Точное значение концентрации слабого электролита вычислим по формуле: 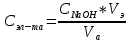 , ,где: VЭ – эквивалентный объем щелочи, определенный по кривой титрования, [мл]; СNaOH – концентрация раствора щелочи, 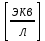 ; Va – объем аликвоты слабого электролита, [мл]. ; Va – объем аликвоты слабого электролита, [мл].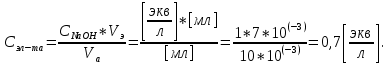 II. Определение константы и степени диссоциации слабого электролита. 1. Вычислим эквивалентную электропроводность каждого раствора по формуле: 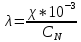 Приведу подробное вычисление для 1 первого раствора: 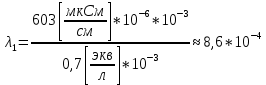 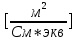 ; ;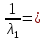 = =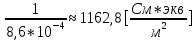 . .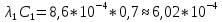 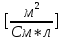 . .2. Заполним таблицу, используя данные эксперимента Таблица 4. Результаты вычислений
3. По данным таблицы построить графики зависимостей ꭓ= f(C) 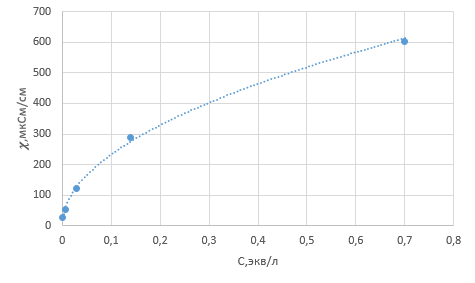 Рисунок 2 – График зависимости электропроводности от концентрации 4. По данным таблицы построить графики зависимостей 1/λ = f(λС) 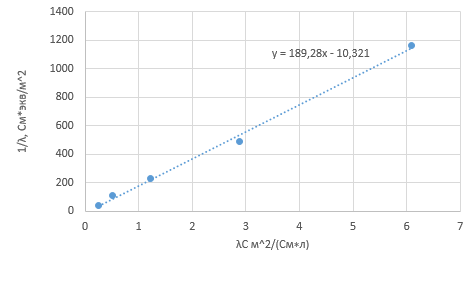 Рисунок 3 – График 1/λ = f(λС) 5. По графику 1/λ = f(λС) найдём 1/λ∞ посредством экстраполяции зависимости на ось ординат 1/λ и вычислим λ∞ 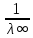 = 10,321 = 10,321 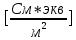 . Отсюда λ∞ . Отсюда λ∞  0,097 0,097 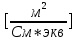 . .6. Рассчитаем значение степени диссоциации по уравнению: 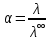 . .Значение константы диссоциации по формуле 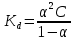 Пример вычисления для первой колбы: 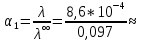 0,009 0,009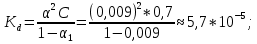 7. Результаты вычислений занесём в таблицу:
8. Среднее квадратичное отклонение σ рассчитывают по уравнению: 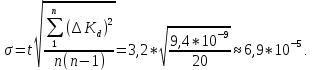 t = 3,2 – коэффициент Стьюдента для 95 %. 9. Окончательный результат: 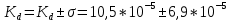 . .Вывод: в ходе лабораторной работы методом кондуктометрического анализа был найден эквивалентный объём щелочи и концентрация кислоты. Возрастание электропроводимости до точки эквивалентности обусловлено заменой слабо-диссоциирующих молекул уксусной кислоты на полностью диссоциирующий ацетат натрия. Более резкое увеличение электропроводимости после точки эквивалентности вызвано появлением в растворе избытка весьма подвижных гидроксид-ионов. Также получена константа диссоциации слабого электролита, она составила: 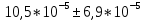 Было установлено, что с уменьшением концентрации кислоты её степень и константа диссоциации возрастают, что подтверждает закон разбавления Оствальда. Это объясняется тем, что с увеличением количества воды, т.е. с разбавлением раствора, число диссоциированных ионов возрастает, то есть процесс диссоциации происходит более активно. |

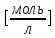
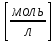
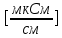
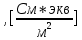
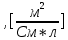
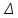 Kd = (Kd среднее -K)
Kd = (Kd среднее -K)