преддипломная практика. Отчет о преддипломной практике сибирский федеральный университет
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Федеральное государственное автономное образовательное учреждение высшего образования «СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» Институт цветных металлов и материаловедения Кафедра физической и неорганической химии ОТЧЕТ О ПРЕДДИПЛОМНОЙ ПРАКТИКЕ СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ (г. КРАСНОЯРСК) ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ХАРАКТЕРИСТИК ФАЗОВЫХ ПЕРЕХОДОВ СОЕДИНЕНИЙ СО СТРУКТУРОЙ АПАТИТА МЕТОДОМ ДИФФЕРЕНЦИАЛЬНОЙ СКАНИРУЮЩЕЙ КАЛОРИМЕТРИИ Руководитель __________ Е.О. Голубева Студент ЦМ17-01Б, 061723339 __________ Я.Е. Сысоева Красноярск 2021 СОДЕРЖАНИЕ Введение 31 Литературная часть 51.1 Соединения со структурой апатита 5 1.2 Термические метода анализа 5 1.2.1 Дифференциально-термический анализ 5 1.2.2 Дифференциально-сканирующая калориметрия 7 1.2.3 Синхронный термический анализ 9 1.3 Термодинамические характеристики и методы их измерения 10 1.3.1 Стандартная теплота образования 11 1.3.1.1Теплота образования сложных соединений 11 1.3.2 Стандартная энтропия 12 1.3.2.1 Метод Герца 12 1.2.3Стандартная теплоемкость 13 1.2.3.1 Метод Неймана-Коппа 13 1.2.3.2 Метод Л. И. Ивановой 14 2 Экспериментальная часть 15 2.1 Приборы и реактивы 15 2.2 Результаты эксперимента и расчет термодинамических характеристик 15 2.2.1 Стандартная теплоемкость 15 2.2.2 Стандартная теплота образования 18 2.2.3 Стандартная энтропия 19 Заключение 21 Список литературы 22 ВВЕДЕНИЕ В процессе сбора и анализа литературы, посвященной минералам группы апатита (в том числе и справочной), было установлено, что за многие годы такому детальному исследованию не подвергалось ни одно химическое соединение. Вследствие специфики своего состава и строения подробное знание об апатите представляет собой как научный, так и практический интерес. Потребность в изучении новых соединений со структурой апатита, в частности, ванадатогерманатов свинца, связана с огромными возможностями их применения. Такие соединения используют в качестве лазерных и флуоресцентных материалов, применяют в медицине как совместимые с костной тканью биоматериалы. Можно использовать их в энергетике (в качестве ионных проводников) и нефтепереработке (выступают катализаторами). Особое значение эти соединения приобретают в области охраны окружающей среды – это эффективные сорбенты экологически вредных и радиоактивных веществ. Интересная особенность «апатитподобных» соединений состоит в том, что некоторые их элементы можно заместить другими ионами. Если частично заменить в структуре апатита некоторые ионы — например, ионы двухвалентных металлов на ионы редкоземельных элементов, то можно получить люминесцентные (светящиеся) и лазерные материалы. Если, например, заменить свинец в соединении Pb5(GeO4)(VO4)2 на лантаноиды, то получатся соединения с общей формулой Pb10-xLnx(GeO4)2+x(VO4)4-x (x = 0–3), которые могут применяться как новые люминофоры. Люминофоры уже сейчас широко применяются для выпуска телевизоров с улучшенной «сверхреалистичной» передачей изображения, также с их помощью можно «прокачать» экраны смартфонов и планшетов. Но при этом их свойства изучены недостаточно, особенно термодинамические. Термоаналитические методы служат для исследования химических реакций, фазовых и других физико-химических превращений, происходящих под влиянием тепла в химических соединениях, или (в случае многокомпонентных систем) между отдельными соединениями. Термические процессы, будь то химические реакции, изменение состояния или превращение фазы, сопровождаются всегда более или менее значительным изменением внутреннего теплосодержания системы. Эти тепловые эффекты могут быть обнаружены методами термического анализа. Превращения во многих случаях связаны также с изменением массы образца, которое может быть, в свою очередь, с большой точностью определено при помощи термогравиметрического метода (ТГ). Эти классические термоаналитические методы успешно применяются в науке уже более ста лет [1]. Термодинамический анализ лежит в основе изучения всех химических систем и процессов. Методы химической термодинамики при наличии современных справочной базы и расчетных возможностей позволяют наиболее рациональным путем найти ответ на многие вопросы, связанные с химическими и фазовыми превращениями. С помощью приближенных методов расчета можно достаточно точно определить необходимые термодинамические характеристики веществ без проведения экспериментальных исследований [2]. Цель работы определение термодинамических характеристик фазовых переходов соединений со структурой апатита методом дифференциальной сканирующей калориметрией и расчетными методами. Для выполнения цели поставили перед собой задачи: Определить температуру плавления соединений со структурой апатита методом ДСК; Рассчитать термодинамические характеристики соединений; Сделать вводы о применимости расчетных методов к данному классу соединений. Глава 1 ЛИТЕРАТУРНАЯ ЧАСТЬ Соединения со структурой апатита Апатиты Pb10 – xМ(GeO4)2+ x(VO4)4 – x (М = Bi, Pr, Nd, Sm, Gd, Tb) синтезированы методом твердофазных реакций при последовательном обжиге на воздухе стехиометрических смесей исходных оксидов (PbO, М2O3, GeO2 и V2O5) в интервале температур 773–1073 K. Рентгенофазовым методом определены зависимости параметров элементарной ячейки от температуры и рассчитаны коэффициенты линейного и объемного термического расширения. Апатитоподобные соединения с общей формулой M10(ZO4)6X2 (M = Ca, Ba, Pb, РЗЭ и др.; Z = V, Ge, Si и др.; X = F, Cl, OH, O, вакансия) привлекают внимание исследователей наличием свойств прикладного характера. Важным свойством соединений со структурой апатита является возможность замещения одних структурных единиц другими [3-5]. Согласно [6], замещение свинца в Pb5(GeO4)4(VO4)2 РЗЭ позволяет получить соединения Pb10 – xRx(GeO4)2 + x(VO4)4 – x (R = РЗЭ, x = 0–3). Свойства ванадатогерманатов свинца, особенно теплофизические, мало исследованы. Термические методы анализа Дифференциально-термический анализ Дифференциальный термический анализ (ДТА) основан на регистрации разности температур исследуемого вещества и инертного образца сравнения при их одновременном нагревании или охлаждении. При изменении температуры в образце могут протекать процессы с изменением энтальпии, как например, плавление, перестройка кристаллической структуры, испарение, реакции дегидратации, диссоциации или разложения, окисление или восстановление. Такие превращения сопровождаются поглощением или выделением тепла, благодаря чему температура образца и эталона начинают различаться. Этим методом удается зафиксировать даже малые изменения температуры образца, благодаря конструкции прибора, а именно тому, что регистрирующие термопары от образца и эталона соединены навстречу друг другу. Повышенная чувствительность дифференциального метода позволяет исследовать образцы малого веса (до нескольких мг). Экспериментальный сигнал от двух ячеек (S и R, см. рисунок 1) измеряется одновременно. Поскольку ячейки сконструированы максимально симметрично, все, не относящиеся непосредственно к образцу связанные с переносом тепла процессы, действуют на них одинаково, и могут быть исключены из рассмотрения путем вычитания сигнала от ячейки сравнения из сигнала от ячейки с образцом [7]. Площадь пика кривой ДТА пропорциональна изменению энтальпии при различных процессах в образце и его массе. Таким образом, ДТА может использоваться как полуколичественный или количественный метод определения теплоты реакции или другого процесса в образце.  Рисунок 1 – Схема и рисунок измерительной ячейки дифференциального термического анализа Метод ДТА является очень востребованным как в фундаментальной, так и в прикладной науке. С помощью метода ДТА можно проводить термодинамические и кинетические исследования. Непосредственно данным методом измеряются теплоты химических и фазовых превращений, а также теплоемкости веществ. Данные ДТА могут служить для построения фазовых диаграмм: с их помощью определяют, как правило, вид изобарных сечений в области равновесий кристаллическая фаза - расплав. По пикам плавления, полученным методом ДТА, можно определять содержание примесей в образце [7]. Конструкция современных приборов позволяет проводить измерения как при низких (от жидкого азота), так и при достаточно высоких температурах. Имеется возможность варьирования скоростей нагревания (охлаждения) от 1 до 50 и выше град/мин, проводить измерения в изотермическом режиме, при высоких давлениях, использовать различную по природе газовую атмосферу (статическую или поток различной скорости). ДТА является экспресс-методом. Этот калориметрический метод достаточно быстрый и, в сравнении со многими другими калориметрическими методами, недорогой. Несмотря на очевидные достоинства дифференциального термического анализа, существует ряд проблем, связанных как с конструктивными особенностями приборов, так и с методикой постановки экспериментов. Основной проблемой данного метода (как и большинства калориметрических методов анализа) являются неизбежно возникающие «утечки тепла». Наличие «тепловых утечек» не только вносит погрешность в экспериментальные данные, но и приводит к необходимости многократной калибровки прибора, что также можно отнести к недостаткам метода, поскольку проведение калибровки связано с дополнительными временными и материальными затратами. Калибровка прибора в конкретных условиях эксперимента необходима для определения теплового потока из экспериментальных данных [7]. Дифференциально-сканирующая калориметрия Калориметрия – группа методов физико-химического анализа, в которых измеряется теплота различных процессов: 1 химических реакций, 2 фазовых переходов, 3 теплоемкость (теплота, необходимая для изменения температуры тела 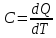 ). ).Теплота – функция, характеризующая процесс перераспределения внутренней энергии в пространстве; ее невозможно измерить при отсутствии процесса теплопереноса. Поэтому в конструкции любого калориметра предусмотрена возможность теплообмена между различными частями измерительной системы, и понимание явлений, связанных с теплопереносом, имеет принципиальное значение в калориметрии [8]. В методе ДСК теплоту определяют через тепловой поток – производную теплоты по времени (отсюда в названии термин «дифференциальный»). Тепловые потоки измеряются по разнице температур в двух точках измерительной системы в один момент времени 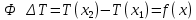 . Измерения можно проводить как в изотермических условиях, таки в динамическом режиме при программируемом изменении температуры оболочки(нагревателя) (калориметры такого типа называют «сканирующими»). В современных приборах предусмотрена возможность задавать различные температурные программы. . Измерения можно проводить как в изотермических условиях, таки в динамическом режиме при программируемом изменении температуры оболочки(нагревателя) (калориметры такого типа называют «сканирующими»). В современных приборах предусмотрена возможность задавать различные температурные программы.Все ДСК (рисунок 2) имеют две измерительные ячейки: одна предназначена для исследуемого образца (sample, S), в другую – ячейку сравнения (reference, R), помещают либо пустой тигель, либо тигель с образцом сравнения – эталоном (инертным в заданном диапазоне условий веществом, по теплофизическим свойствам близким к образцу). Ячейки конструируют максимально симметрично (одинаковые тигли, одинаковые сенсоры, одинаковое расстояние от нагревателя (furnace, F) до сенсора и т.д.). Экспериментально измеряется временная зависимость разницы температур между ячейкой с образцом и ячейкой сравнения [8]. 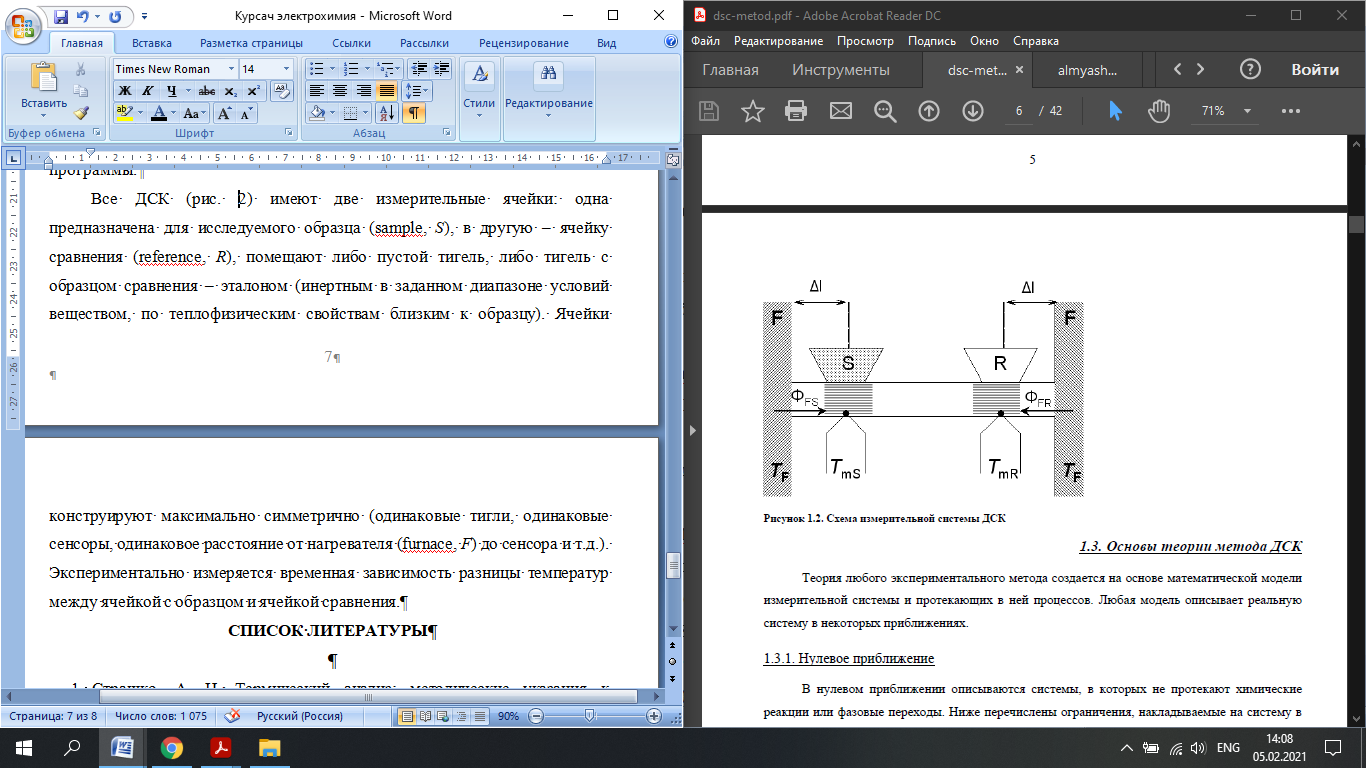 Рисунок 2 – Схема измерительной системы ДСК Синхронный термический анализ Этот метод объединяет в одном измерении термогравиметрию (TGA/DTG) с дифференциальным термическим анализом (DTA) или с дифференциальной сканирующей калориметрией (DSC). Ранее в России были распространены приборы, использующие этот метод и известные под названием дериватограф. Метод основан на одновременной непрерывной регистрации изменений соответствующих характеристик образца (обусловленное фазовыми переходами или химическими реакциями) в зависимости от времени или температуры при нагревании в соответствии с выбранной температурной программой в заданной газовой атмосфере. Метод позволяет получать информацию о составе, термической и окислительной стабильности материалов, фазовых переходах, температурах протекания и кинетике химических реакций. Метод широко применяется в научных и заводских лабораториях: химической индустрии (в производстве пластмасс, резин, лаков и красок); фармацевтической промышленности; пищевой промышленности; горно-рудной промышленности и металлургии; в минералогии, в неорганической, органической и физической химии; при исследованиях и разработке строительных материалов, огнеупоров, керамик и композитов [9]. Схема СТА представлена на рисунке 3. 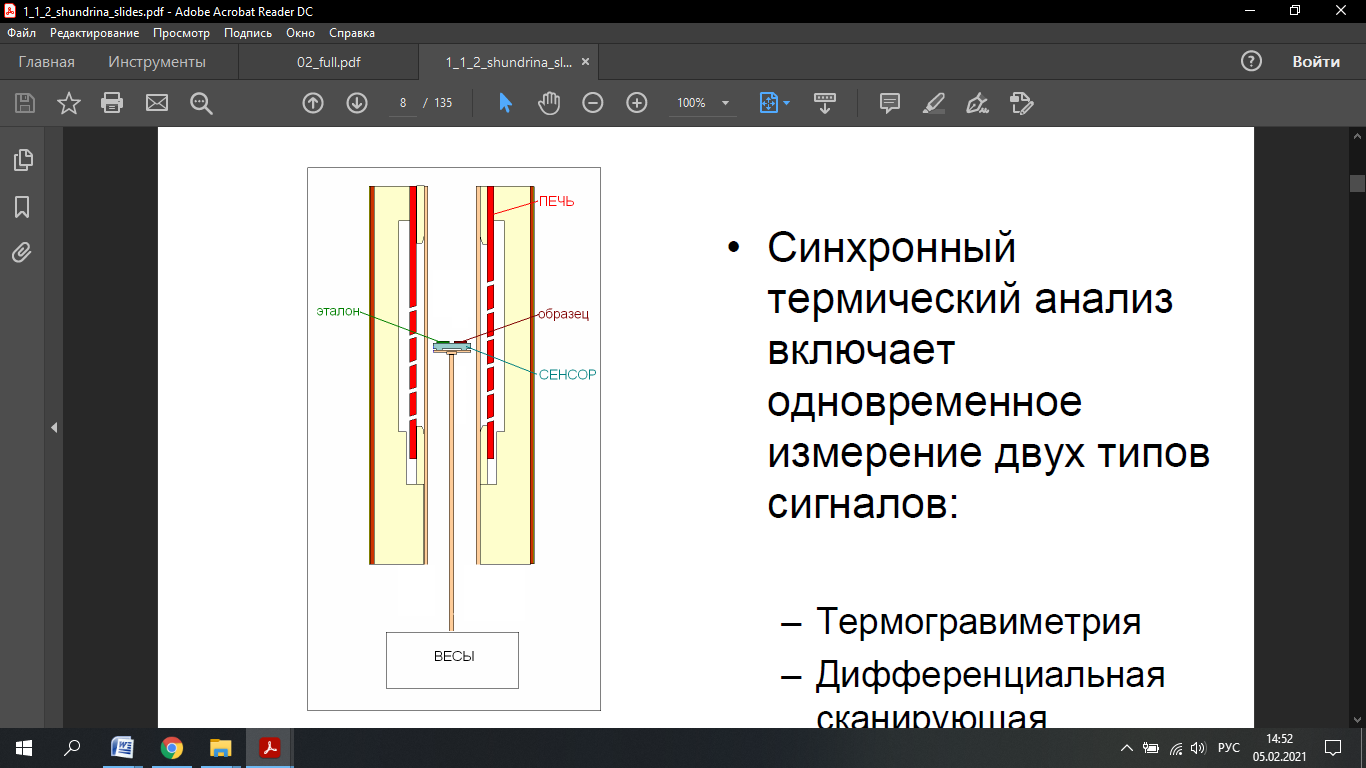 Рисунок 3 –Схема измерительной системы СТА 1.2 Термодинамические характеристики и способы их расчета 1.2.1 Стандартная теплота образования Энтальпия — функция состояния H термодинамической системы, определяемая как сумма внутренней энергии U и произведения давления P на объём V: H≡U+PV. (1) Из уравнения для дифференциала внутренней энергии: dU=TdS−PdV, (2) где T — термодинамическая температура, а S — энтропия, следует выражение для дифференциала энтальпии: dH=TdS+VdP, (3) которое является полным дифференциалом функции H(S,P). Она представляет собой термодинамический потенциал относительно естественных независимых переменных — энтропии, давления и, возможно, числа частиц и других переменных состояния [10]. Понятие энтальпии существенно дополняет математический аппарат термодинамики и гидродинамики. Важно, что в изобарном процессе при постоянном P } изменение энтальпии равное сумме изменения внутренней энергии U2−U1 и совершённой системой работы P(V2−V1), в силу первого начала термодинамики равно количеству теплоты Q, сообщенной системе. Это свойство энтальпии позволяет использовать её для вычисления тепловыделения при различных изобарных процессах, например, химических [11-13]. Отношение малого количества теплоты, TdS=dH, переданного системе в изобарном процессе, к изменению температуры dT является теплоёмкостью при постоянном давлении 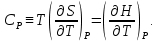 (5) (5)1.2.2 Стандартная энтропия 1.2.2.1 Метод Герца В основе метода лежит эмпирическая формула, установленная Герцем для элементов и неорганических соединений 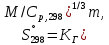 (6) (6)где KГ– некоторая постоянная. Согласно Герцу KГ= 20,5. Метод Герца с фиксированным значением константы Герца (KГ= 20,5) не обеспечивает удовлетворительной точности оценки энтропии неорганических соединений (точность расчета составляет ±22%), поскольку величина KГ для разных соединений меняется в очень широких пределах [14]. Расчеты показывают, что значение KГ остается примерно одинаковым для соединений, принадлежащих к одному и тому же классу веществ. Ниже приводятся усредненные значения константы Герца KГ для разных классов неорганических соединений (в скобках указано число веществ): Бориды 10,23 (10), Силициды 18,78 (13), Карбиды 13,12 (11), Фториды 22,68 (25), Нитриды 16,15 (12), Хлориды 29,81 (20), Оксиды 19,18 (17), Бромиды 33,18 (20), Сульфиды 26,92 (14), Йодиды 33,38 (18). Установлено, что имеется хорошая корреляция между усредненными значениями константы Герца и молярной массой МА элемента, играющего в соединении роль аниона: 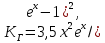 (7) (7)где х = 42,4/МА. Точность определения константы KГ по уравнению (5) составляет ±1%, за исключением сульфидов и силицидов, для которых отклонение составляет соответственно 7,5 и 40%. Точность усовершенствованного метода Герца, расчет по формулам (4) и (5), равна ±9,5% [15,16]. 1.2.3 Стандартная теплоемкость 1.2.3.1 Метод Неймана-Коппа Используется известное правило сложения теплоемкостей элементов, составляющих соединение, а именно: 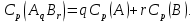 (8) (8)Установлено, что этот метод позволяет достаточно точно оценивать теплоемкости интерметаллических соединений (±4,0%), силицидов (±5,5%), а также обеспечивает удовлетворительную точность для боридов, карбидов и силицидов (±8,0%). [17] 1.2.3.2 Метод Л. И. Ивановой В основе метода лежит простая полуэмпирическая формула, связывающая теплоемкость соединения с температурой первого фазового перехода Tпр (обычно Tпр = Tпл ): 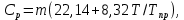 (9) (9)где m – число атомов в молекуле соединения. Метод привлекает своей простотой и доступностью исходных данных. В большинстве случаев можно достаточно точно оценивать теплоемкость твердых неорганических соединений. Точность метода составляет ±6,5%. Наибольшую точность метод обнаруживает в применении к галогенидам, погрешность составляет ±4,5%. Метод не применим к боридам, нитридам и карбидам, для которых его точность снижается в два-три раза по сравнению с вышеуказанной [18, 19]. Глава 2 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1 Приборы и реактивы Дифференциальный сканирующий калориметр STA 449 C Jupiter фирмы NETZSCH; Платиновые тигли с крышками; Весы аналитические METTLER TOLEDO XP205 Delta Range с точностью 1·10-2 мг; Образцы: Pb9Bi(GeO4)3(VO4)3, Pb9Pr(GeO4)3(VO4)3, Pb9Gd(GeO4)3(VO4)3, Pb9Tb(GeO4)3(VO4)3, Pb9Nd(GeO4)3(VO4)3, Pb9Sm(GeO4)3(VO4)3. 2.2 Результаты эксперимента и расчеты 2.2.1 Стандартная теплоемкость С помощью метода дифференциальной сканирующей колориметрии была определена температура плавления исследуемых веществ со структурой апатита. Результаты сканирования приведены в таблице 1. Таблица 1 – Температуры плавления, полученные в результате ДСК-сканирования
Для расчетов по методу Неймана – Коппа необходима стандартная мольная теплоемкость составляющих соединение Pb9Bi(GeO4)3(VO4)3. Данные представлены в таблице 2: Таблица 2 – Значение мольной теплоемкости соединений
Используя литературные значения [20], с учетом стехиометрии получаем: 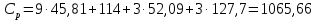 Дж/моль·К. Дж/моль·К.Для расчета теплоемкости по методу Л. И. Ивановой подставляем необходимое значение температуры в формулу (9): 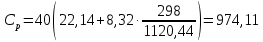 Дж/моль·К. Дж/моль·К.Используя литературные данные [21] экспериментально была найдена температурная зависимость теплоемкости, используя уравнение прямой, полученной в ходе эксперимента, определяем значение теплоемкости при стандартных условиях: 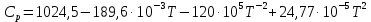 , ,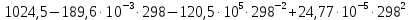  854,3 Дж/моль·К. 854,3 Дж/моль·К. Расчет теплоемкостей остальных соединений был проведен аналогичным способом. Результаты представлены в таблице 3. Таблица 3 – Стандартная теплоемкость изучаемых соединений
2.2.3 Стандартная теплота образования Отношение малого количества теплоты, TdS = dH, переданного системе в изобарном процессе, к изменению температуры dT, является теплоемкостью при постоянном давлении, зная это можно рассчитать энтальпию. Стандартная теплота образования исследуемых веществ была рассчитана с использованием теплоемкости, полученной по методу Неймана-Коппа, методу Л. И. Ивановой и экспериментальным данным, представленным выше. 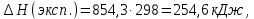 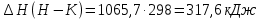 , ,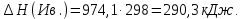 Расчет стандартной теплоты образования оставшихся соединений был проведен аналогичным способом. Результаты представлены в таблице 4. Таблица 4 – Стандартная теплота образования изучаемых соединений
2.2.2 Стандартная энтропия Энтропия соединения при стандартных условиях была рассчитана методом Герца по формуле (6). Для нахождения энтропии необходимо значение теплоемкости и молярная масса. Подставляем в формулу необходимые значения. 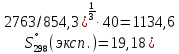 Дж/моль·К, Дж/моль·К,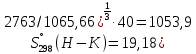 Дж/моль·К, Дж/моль·К,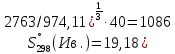 Дж/моль·К. Дж/моль·К.Расчет энтропии оставшихся соединений был проведен аналогичным способом. Результаты представлены в таблице 5. Таблица 5 – Стандартная энтропия изучаемых соединений
В ходе исследований были произведены измерения температур плавления и рассчитаны термодинамические свойства соединений со структурой апатита. ЗАКЛЮЧЕНИЕ Определены термодинамические характеристики фазовых переходов соединений со структурой апатита методом дифференциальной сканирующей калориметрией и расчетными методами. Как показали расчеты, метод Л. И. Ивановой более точный среди имеющихся, для данного класса соединений, погрешность составила 10-14% %, что можно считать вполне удовлетворительной. Точность метода Неймана-Коппа составила 21-25%, что неудовлетворительно для данного метода, но его можно использовать для приблизительной оценки термодинамических параметров, в случае невозможности использования метода Л. И. Ивановой из-за отсутствия соответствующих исходных данных. С помощью приближенных методов расчета можно достаточно точно определить необходимые термодинамические характеристики веществ без проведения экспериментальных исследований, что особенно важно для предварительной оценки возможности протекания процесса, либо в тех условиях, когда проведение эксперимента неосуществимо или требует больших трудо- и энергозатрат. СПИСОК ЛИТЕРАТУРЫ Альмяшев, В. И. Термические методы анализа: Учеб. пособие / В. И. Альмяшев, В. В. Гусаров. – СПб.: СПбГЭТУ (ЛЭТИ), 1999. – 40 с. Морачевский, А. Г. Термодинамические расчеты в химии и металлургии: Учебное пособие / А. Г. Морачевский, И. Б. Сладков, Е. Г.Фирсова. – СПб.: Лань, 2018. – 208 с. Игнатов А.В., Изоморфное замещение в системе Pb(8 – x)Gdx-Na2(VO4)6O(x/2) / А. В. Игнатов, Т. М. Саванкова, Е. Г. Дидоренко Е.Г // Вестн. Дон. нац. ун-та. Сер. А. Естеств. науки. – 2019. – No. 1. – С. 152–154. Savankova, T.M. Synthesis, Crystal Structure Refinement, and Electrical Conductivity of Pb(8 – x)Na2Smx(VO4)6O(x/2) / T. M. Savankova, L. G. Akselrud, L. I. Ardanova //. J. Chem. Eng. Data. – 2019. –Vol. 6, No. 2. – P. 1–7. Pasero, M. Nomenclature of the Apatite Supergroup Minerals / M. Pasero, A. R. Kampf, C. Ferraris // Eur. J. Mineral. – 2020. – V. 22, No. 3. – P. 163–179. Chakroun-Ouadhour, E. Synthesis, Characterization and Electrical Properties of a Lead Sodium Vanadate Apatite / E. Chakroun-Ouadhour, R. Ternane, B. Hassen-Chehimi // Mater. Res. Bull. – 2019. – Vol. 43, No. 5. – P. 2451–2456. Страшко, А. Н. Термический анализ: методические указания к выполнению лабораторных работ по курсу «Физико-химические методы анализа» / А. Н. Страшко. – Томск: Изд-во Томского политехнического университета, 2014. – 16 с. Емелина, А. Л. Дифференциальная сканирующая калориметрия / А. Л. Емелина. – Москва: МГУ, 2009. – 42 с. Спектроскопические системы: Режим доступа: http://www.spectrosystems.ru/methods/sinc_tga_tda.shtml (дата обращения: 05.05.2021). Zirtl, E. Graphische Methoden fur Abschatzung von enthalpie und entropiewerten gasformiger anorganischer Verbindungen /E. Zirtl // Z. Naturforsch. – 1996. – Vol. 21a, No. 11. – P. 201–207. Веннер, P. Термодинамические расчеты : пер. с англ. / Р. Веннер, под ред. А. В. Фроста // М. : ИЛ. – 1990. – 364 с. Hisham, M. W. Estimation of the enthalpy of formation of solid oxides / M. W. Hisham, S. W. Benson // J. Phys. Chem. – 1995. – Vol. 89, No. 10. – P. 1905–1915. Hisham, M. W. Estimation of the enthalpy of formation of binary compounds / M. W. Hisham, S. W. Benson // J. Phys. Chem. – 1995. – Vol. 89, No. 15. – P. 3417–3427. Schwitzgebel, K. Estimination of heats of formation of binary oxides / K. Schwitzgebel, P. S. Lowell, T. B. Parsons // J. Chem. Eng. Data. – 1971. – Vol. 16, No. 4. – P. 419-423. Turkdogan, Е. Т. Estimation of entropy of fusion / Е. Т. Turkdogan, J. Pearson // J. Appl. Chem. – 1953. – V. 3, No. 5. – P. 495–501. Цагарейшвили, Д. Ш. Методы расчета термодинамических и упругих свойств кристаллических неорганических веществ / Д. Ш. Цагарейшвили. – Тбилиси: Мецниереба, 1977. – 262 с. Kubaschewski, О. Empirical estimation of specific heat of solid inorganic compounds / О. Kubaschewski, Н. Unal // High Temperatures – High Pressures. – 1977. – Vol. 9, No. 3. – P. 361–365. Worrel, W. L. Estimation of the entropy of formation for some refractory metal carbides / W. L. Worrel // J. Phys. Chem. – 1964. – Vol. 68, No. 4. – P. 954– 955. Иванова, Л. И. О приближенном расчете энтропии испарения некоторых неорганических соединений / Л. И. Иванова // Изв. вузов. Цветная металлургия. – 1968. – No. 4. – С. 11 – 15. Рабинович В. А. Краткий химический справочник / В. А. Рабинович, Хавин З. Я. – 4-е изд., стереотипное. – СПб.: Химия, 1994. – 432 с. Denisova L. T. Synthesis, Structure, and Thermophysical Properties of Pb10 – xBix(GeO4)2 + x(VO4)4 – x(x = 0 – 3) in the Temperature Range of 350–950 K / L. T. Denisova, M. S. Molokeev, V. M. Denisov E. O. Golubeva, N. A. Galiakhmetova // Physics of the Solid State. – 2020. – Vol. 62, No. 11. – P. 2045 – 2051. Денисова Л. Т. Синтез, структура и термодинамические свойства апатитов Pb10 – xPrx(GeO4)2 + x(VO4)4 – x (x = 0, 1, 2, 3) в области 380 – 1050 К / Л. Т. Денисова, Ю. Ф. Каргин, Е. О. Голубева, Г. М. Зеер, А. К. Абкарян, В. М. Денисов // Неорганические материалы. – 2020. – Том 56, № 10. – С. 1081 – 1087. Denisova L. T. High-Temperature Heat Capacity of Pb10 – xNdx(GeO4)2 + x(VO4)4 – x(x = 0–3) Apatites / L. T. Denisova, E. O. Golubeva, N. V. Belousova, V. M. Denisov, and N. A. Galiakhmetova // Physics of the Solid State. – 2019. – Vol. 61, No. 7. – Р. 1343 – 1346. |
