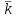Отчет По дисциплине Химия, часть ii (наименование учебной дисциплины согласно учебному плану) Тема работы Определение константы скорости реакции окисления иодида калия персульфатом аммония (натрия)
 Скачать 147.18 Kb. Скачать 147.18 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра физической химии Отчет По дисциплине Химия, часть II (наименование учебной дисциплины согласно учебному плану) Тема работы: Определение константы скорости реакции окисления иодида калия персульфатом аммония (натрия) Выполнил: студент гр. ТНГ-21 Максаров Д.В. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил: доцент (должность) (подпись) (Ф.И.О) Санкт-Петербург 2022 1. ЦЕЛЬ РАБОТЫОпределить константу скорости реакции окисления иодида персульфатом аммония (натрия) при заданных начальных концентрациях реагентов. 2. ХОД ЭКСПЕРИМЕНТАОборудование и реактивы: бюретка объемом 25 мл – 4 шт.; мерная пипетка объемом 5 мл (для крахмала) – 1 шт.; секундомер; колба круглая объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 5 шт; химический стакан объемом 25 мл (для персульфата) – 1 шт.; иодид калия – 0,2 М раствор; тиосульфат натрия – 0,02 М раствор; крахмал – 1 % раствор; персульфат натрия – 0,2 М раствор. Описание методики: Результатом реакции окисления иодида калия персульфатом натрия является выделение йода. Об этом свидетельствует синий окрас, появляющийся в результате взаимодействия йода и крахмала, чувствительного на молекулярный йод. Процесс приостанавливает тиосульфат натрия, задерживающий выделение йода. Значит появление синего окраса после добавления персульфата в реакционную смесь будет означать, что тиосульфат в смеси закончился. Измеряя время, за которое этот процесс произошел, можно найти константу скорости реакции. Выполнение: Наполняем четыре бюретки KI, Na2S2O3, Na2S2O8 и дистиллированной водой. В пять круглых колб шприцом отбираем из химического стакана по 5 мл крахмала. С помощью маркированных бюреток в первую колбу в соответствии с указанными в варианте данными отбираем необходимое количество каждого компонента: KI, Na2S2O3, дистиллированная вода. В химический стакан для персульфата натрия с помощью мерной бюретки отбираем необходимое в соответствии с вариантом количество вещества. Одновременно с добавлением персульфата натрия из химического стакана в первую колбу со смесью засекаем время, помешивая ее пару секунд. При появлении синего окраса, фиксируем время и заполняем таблицы. Повторяем те же действия с количествами тиосульфата натрия и дистиллированной воды в соответствии с данными вариант для остальных четырех колб, продолжая заполнять таблицу со временем появления окраса. 3. ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕКонцентрация раствора иодида калия, Сисх(KI)- 0,2 моль/л Концентрация раствора тиосульфата натрия, Cисх(Na2S2O3)- 0,02 моль/л Концентрация раствора персульфата натрия, Cисх(Na2S2O8)- 0,2 моль/л. Таблица 1 – Исходные данные (установленное время)
4. ОБРАБОТКА ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХОсновные расчетные формулы: Концентрация иодида калия, израсходованная на реакцию с тиосульфатом натрия, моль/л: 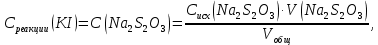 Где, Cисх(Na2S2O3) – концентрация тиосульфата натрия, указанная на емкости с реактивом, моль/л; V(Na2S2O3) – объем тиосульфата натрия, взятый на приготовление реакционной смеси, мл; Vобщ – общий объем реакционной смеси, мл. Концентрация иодида калия в данный момент времени, моль/л: 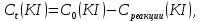 Где, C0(KI) – концентрация иодида калия в реакционной смеси в начальный момент времени (t=0 c.), моль/л. Концентрация иодида калия в начальный момент времени, моль/л: 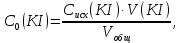 Где, Cисх(KI) – концентрация иодида калия, указанная на емкости с реактивом, моль/л; V(KI) – объем иодида калия, взятый на приготовление реакционной смеси, мл; Vобщ – общий объем реакционной смеси, мл. Константа скорости реакции, моль-1·л·с-1: 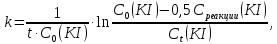 Где, t - скорость протекания реакции, с. Среднее значение константы скорости реакции, моль-1·л·с-1: 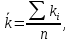 Где, n – количество опытов, n = 5. Формулы для расчета погрешностей: Вероятная ошибка определения средней константы скорости процесса (при τ = 95%): 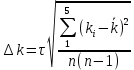 Относительная погрешность: 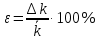 Расчетная часть: Таблица 2 – Расчетные данные
Пример вычислений для опыта №1:
Концентрация иодида калия в начальный момент времени, моль/л: 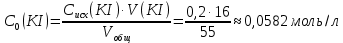 Концентрация иодида калия, израсходованная на реакцию с тиосульфатом натрия, моль/л: 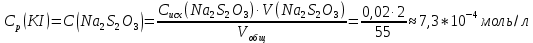 Концентрация иодида калия в данный момент времени, моль/л: 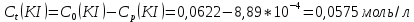 Константа скорости реакции, моль-1·л·с-1: 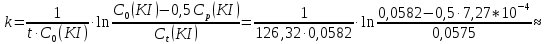 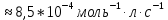 Среднее значение константы скорости реакции, моль-1·л·с-1 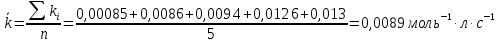 Вероятная ошибка определения средней константы скорости процесса (при τ = 95%): 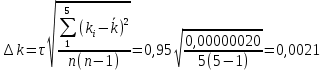 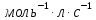 Относительная погрешность: 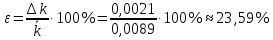 Итоговый результат: Константа скорости реакции k = ( 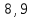 ± 2,1) ·10-3 моль-1·л·с-1: ± 2,1) ·10-3 моль-1·л·с-1:5. ВЫВОДРезультатом данной работы является найденная нами константа скорости реакции окисления иодида калия персульфатом натрия. Экспериментальным методом было установлено время протекания реакции с разным содержанием персульфата натрия и дистиллированной воды. Было также доказано, что большее содержание тиосульфата натрия, останавливающего реакцию йода и крахмала, продлевает процесс протекания реакции. При изменении количества компонентов константа почти не изменялось, значит, она независима от концентрации реагирующих веществ и зависит от температуры. Относительная погрешность 23,59% говорит о достаточно высокой, но не эталонной точности работы. Погрешность обусловлена человеческим фактором и могла возникнуть из-за неточности определения момента появления синего окраса и небольшой разницы теоретического и фактического объёма компонентов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||