Действие групповых реагентов. Качественные реакции. ХИМИЯ ОТЧЕТ 1-2. Отчет по дисциплине Химия Тема работы Действие групповых реагентов. Качественные реакции студент гр. (шифр группы) (подпись) (Ф. И. О.)
 Скачать 134.69 Kb. Скачать 134.69 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО науки и высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра общей химии ОТЧЕТ По дисциплине: Химия Тема работы: Действие групповых реагентов. Качественные реакции Выполнил: студент гр. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил руководитель работы: (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2023 Действие групповых реагентов Цель работы: изучить действие и аналитические реакции групповых реагентов качественного анализа по кислотно-основному методу. Опыт 1. 1)AgNO3 + HCl = AgCl↓ + HNO3 Ag+ + NO3- + H+ + Cl- = AgCl↓ + H+ + NO3- Ag+ + Cl- = AgCl↓ Образовался белый творожистый осадок. 2)Pb(NO3)2 + 2HCl = PbCl2↓ + 2HNO3 Pb2+ + 2NO3- + 2H+ + 2C l- = PbCl2↓ + 2H+ +2 NO3- Pb2+ +2Cl- = PbCl2↓ Образовался жёлтый осадок. 3)Hg 2 (NO3)2 + 2HCl = 2HgCl↓ + 2HNO3 Hg 2 2++ 2 NO3-+2H++2Cl-=2HgCl↓+2H++2 NO3- Hg 2 2++2Cl-=2HgCl↓ Образовался белый осадок. Опыт 2 1) CaCl2+ H2SO4 = CaSO4↓+ 2HCl Ca2++2Cl-+2H++ SO4 2- = CaSO4↓+2H++2Cl- Ca2++ SO4 2-= CaSO4↓ После добавления ацетона выпал белый осадок. 2)BaCl2+ H2SO4 =BaSO4 ↓+ 2HCl Ba2++2Cl-+ 2H++ SO42-= BaSO4 ↓+ 2H++2Cl- Ba2++ SO42--= BaSO4 ↓ Выпал белый осадок. Опыт 3. 1) Al2 (SO4)3 +6NaOH = 2Al (OH)3 ↓+ 3Na2SO4 2Al 3+ + 3 SO42- + 6 NaOH= 2Al (OH) 3 ↓+6 Na++ 3 SO42 2Al 3+ + 6 NaOH= 2Al (OH) 3 ↓+6 Na+ Выпал белый осадок, при добавлении щёлочи он растворился. 2) ZnSO4 + 2NaOH = Zn (OH) 2↓ +Na2SO4 Zn2++ SO42-+ 2 NaOH= Zn (OH) 2↓+2 Na -+ SO42- Zn2++ 2 NaOH= Zn (OH) 2↓+2 Na - Выпал белый осадок, при добавлении щёлочи он растворился. 3 )Cr2 (SO4)3 + 6NaOH =2 Cr (OH)3 ↓ +3Na2SO4 2 Cr3++3 SO42-+6 NaOH-=2Cr(OH)3 ↓+6Na-+ 3 SO42- 2 Cr3+6NaOH-=2Cr(OH)3 ↓+6Na Выпал серо-зелёный осадок, при добавлении щёлочи он растворился. 4) Al (OH)3+3NaOHконц = Na3[Al(OH)6] Al (OH)3+3Na++3OH- = 3Na++[Al(OH)6]3- Al (OH)3+3OH- = Al(OH)6]3- 5) Zn (OH) 2+2NaOHконц = Na2[Zn(OH)4] Zn (OH) 2+2Na++OH- = 2Na++[Zn(OH)4]2- Zn (OH) 2+OH- = [Zn(OH)4]2- 6)Cr(OH)3+3NaOHконц = Na3[Cr(OH)6] Cr(OH)3+3Na++3OH- = 3Na++[Cr(OH)6]3- Cr(OH)3+3OH- = [Cr(OH)6]3- Осадки во всех трёх случаях растворились. Опыт 4. 1) FeCl3 + 3NH4OH = Fe(OH)3↓ + 3NH4Cl Fe3++ 3Cl-+ 3NH4OH - = Fe(OH)3↓ +3NH4++3Cl- Fe3+-+ 3NH4OH - = Fe(OH)3↓ +3NH4+ Образовался бурый осадок. 2) MnSO4 + 2 NH4OH = Mn(OH)2 ↓+(NH4)2SO4 Mn2++ SO4 2-+ 2NH4OH = Mn(OH)2 ↓+2 NH4-+ SO4 2- Mn2++ 2NH4OH = Mn(OH)2 ↓+2 NH4- Образовался светло-желтый осадок. 3) MgSO4 + 2NH4OH = Mg (OH)2↓+(NH4)2SO4 (тут ещё добавляем щелочь, так как гидроксид магния осаждается в сильнощелочной среде) Mg2+ + SO42- +2 NH4OH = Mg (OH)2↓+2 NH4++ SO42- Mg2+ +2 NH4OH = Mg (OH)2↓+2 NH4+ Образовалсябелыйосадок. Опыт 5. FeCl3 + Cr2 (SO4)3 +15NaOH = Fe(OH)3 ↓+2 Na3 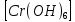 + 3NaCl + 3Na2SO4 + 3NaCl + 3Na2SO4Fe3+ + 3Cl- + 2 Cr3+ + 3 SO42- + 15 Na+ + 15OH- = Fe(OH) ↓3 + 6 Na++2 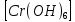 3++3Na++ 3Cl-+ 6Na+ + 3SO42- 3++3Na++ 3Cl-+ 6Na+ + 3SO42-Fe3+ +15OH-+ 2 Cr3+= Fe(OH) ↓3+ 2 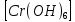 3+ 3+Железо (III) осталось на фильтрате как бурый осадок, хром (III) отфильтровался как зелёный раствор. Опыт 6. 1) 2CuSO4 + 2NH4OH = (CuOH)2 SO4 + (NH4)2SO4 2Cu2+ + 2 SO42- +2NH4OH= 2(CuOH) + SO42- + NH4++ SO42- 2Cu2+ +2NH4OH= 2(CuOH) + NH4+ (CuOH)2 SO4 +6NH4OHк + (NH4)2SO4= 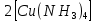 SO4+8H2O SO4+8H2O2CuOH++ SO42-+6NH4OH+2NH4++SO42-=2 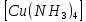 2++ 2SO42-+8H2O 2++ 2SO42-+8H2O2CuOH++6NH4OH+2NH4+=2 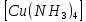 2++8H2O 2++8H2OОбразовался синий осадок, после он растворился. Цвет раствора приобрёл ярко-синюю окраску. 2) Cd (NO3)2 + NH4OH = (CdOH)NO3↓ + NH4NO3 Cd 2++ 2NO3 + NH4OH-= CdOH+ + NO3- + NH4+ + NO3 Cd 2++ NH4OH-= CdOH+ + NH4+ (CdOH)NO3 + NH4NO3+ 3NH4OH = 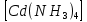 (NO3)2 +4 H2O (NO3)2 +4 H2OCdOH++ NO3-+ NH4++NO3 - +3NH4OH-= 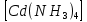 2++2NO3-+4 H2O 2++2NO3-+4 H2OCdOH+ -+ NH4+ +3NH4OH-= 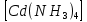 2++4 H2O 2++4 H2O Наблюдаем образование белого осадка, а затем его растворение. Цвет образующегося раствора бесцветный. 3) HgCl2 + NH4OH = HgOHCl↓ + NH4Cl Hg2++2Сl- + NH4OH-= HgOH++ Cl- + NH4++ Сl- Hg2+ + NH4OH-= HgOH++ NH4+ HgOHCl + NH4Cl+ 3NH4OH= 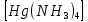 Cl2 +4 H2O Cl2 +4 H2OHgOH++Cl-+ NH4++ Cl-+3NH4OH-= 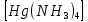 2-+ 2Cl-+4H2O 2-+ 2Cl-+4H2OHgOH++ NH4++3NH4OH-= 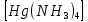 2- + 4H2O 2- + 4H2OНаблюдаем образование черного осадка, а затем его растворение. Образующийся раствор бесцветный. 4)2NiSO4+ 2NH4OH = (NiOH)2SO4↓+ (NH4)2SO4 2Ni 2++2 SO42-+2NH4OH-= 2 NiOH++ SO42- +2 NH4++ SO42- Ni 2++NH4OH-= NiOH++NH4+ (NiOH)2SO4+ (NH4)2SO4+ 10NH4OH= 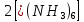 SO4+ 12H2O SO4+ 12H2O2NiOH++SO42-+2NH4-+SO42-+10NH4OH-=2 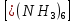 2++2 SO42-+12H2O 2++2 SO42-+12H2O2NiOH++2NH4-+ 10NH4OH=2 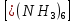 2++ 12H2O 2++ 12H2OНаблюдаем образование синего осадка, а затем его растворение. Цвет образующегося раствора сине-красный. 5)2CoSO4 + 2NH4OH= ( CoOH)2SO4↓+ (NH4)2SO4 2Co2++2 SO42-+2NH4OH = 2CoOH++ SO42-+2 NH4++ SO42- Co2+ -+ NH4OH = CoOH+ -+NH4+ ( CoOH)2SO4+ (NH4)2SO4+10NH4OH= 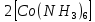 SO4+12Н2O SO4+12Н2O2CoOH++ SO42-+2NH4-+ SO42-+10NH4OH= 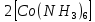 2++2SO42-+12Н2O 2++2SO42-+12Н2O2CoOH++2NH4-+ 10NH4OH= 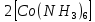 2++12Н2O 2++12Н2OНаблюдаем образование синего осадка, а затем его растворение. Цвет образующегося раствора желтый. Опыт 7. FeCl3 +CuSO4 +7NH4OH = Fe (OH)3↓+ 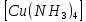 SO4 + 3NH4Cl +4 H2O SO4 + 3NH4Cl +4 H2OFe 3++ 3Cl-+Cu2++SO42-+ 7NH4OH-= Fe(OH)3↓+ 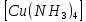 2++ SO42- +3NH4-+3Cl-+4H2O 2++ SO42- +3NH4-+3Cl-+4H2OFe 3++ Cu2++ 7NH4OH-= Fe(OH)3↓+ 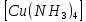 2++ 3NH4- + 4H2O 2++ 3NH4- + 4H2OНаблюдаем разделение железа (III) в осадке бурого цвета и меди (II) – в фильтрате в окрашенном в синий цвет растворе. Качественные аналитические реакции катионов Цель работы: изучить качественные аналитические реакции катионов. Катион__Zn'>Катион__Ca'>Катион__Ba'>Катион__Hg'>Катион__K'>Катион Na+ NaCl + KH2SbO4 = NaH2SbO4 + KCl Na+ + Cl- + K+ + H2Sb  = NaH2SbO4 + K+ + Cl- = NaH2SbO4 + K+ + Cl-Na+ + H2Sb  = NaH2SbO4 = NaH2SbO4 Выпал кристаллический белый осадок. Катион K+ 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6] + 2NaCl 2K+ + 2Cl- + N 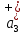 + [Co(NO2)6]3- = K2Na[Co(NO2)6] + 2Na+ + 2Cl- + [Co(NO2)6]3- = K2Na[Co(NO2)6] + 2Na+ + 2Cl-2K+ + Na+ + [Co(NO2)6]3- = K2Na[Co(NO2)6] Выпал оранжевый осадок. Катион NH4+ NН4Cl+ 2К2[HgI4] + 4КОН = [Hg2N]I∙H2O + 7K + I + KCl + 3H2O N 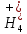 + Cl-+ 2К2[HgI4] + 4КОН = [Hg2N]I∙H2O + 7K+ + 7I- + K+ + Cl- + 3H2O + Cl-+ 2К2[HgI4] + 4КОН = [Hg2N]I∙H2O + 7K+ + 7I- + K+ + Cl- + 3H2ON 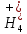 + 2К2[HgI4] + 4КОН = [Hg2N]I∙H2O + 8K+ + 7I- + 3H2O + 2К2[HgI4] + 4КОН = [Hg2N]I∙H2O + 8K+ + 7I- + 3H2OВыпал бурый осадок. Катион Ag+ AgNO3 + KCl = AgCl + KNO3 Ag+ + N  + K+ + Cl- = AgCl + K+ + N + K+ + Cl- = AgCl + K+ + N Ag+ + Cl- = AgCl AgCl + NH4OH = [Ag(NH3)2]Cl + 2H2O AgCl + NH4OH = [Ag(NH3)2]+ + Cl- + 2H2O [Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3 [Ag(NH3)2]+ + Cl- + 2H+ + 2N  = AgCl + 2N = AgCl + 2N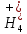 + 2N + 2N [Ag(NH3)2]+ + Cl- + 2H+ = AgCl + 2N 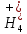 Выпал белый осадок. Катион_Co'>Катион Pb2+ А) Pb(NO3)2 + 2KI = PbI2 + 2KNO3 Pb2+ + 2N  + 2K+ + 2I- = PbI2 + 2K+ + 2N + 2K+ + 2I- = PbI2 + 2K+ + 2N Pb2+ + 2I- = PbI2 Б) Pb(NO3)2 + K2CrO4 = PbCrO4 + 2KNO3 Pb2+ + 2N  + 2K+ + Cr + 2K+ + Cr = PbCrO4 + 2K + 2N = PbCrO4 + 2K + 2N Pb2+ + Cr  = PbCrO4 = PbCrO4 В обеих реакциях выпал желтый осадок. Катион Hg22+ А) Hg2(NO3)2 + 2KCl = Hg2Cl2 + 2KNO3 H 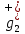 + 2N + 2N + 2K+ + 2Cl- = Hg2Cl2 + 2K+ + 2N + 2K+ + 2Cl- = Hg2Cl2 + 2K+ + 2N H 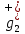 + 2Cl- = Hg2Cl2 + 2Cl- = Hg2Cl2 Hg2Cl2 + 2NH4OH = [HgNH2Cl + Hg] +NH4Cl- + 2H2O Hg2Cl2 + 2NH4OH = [HgNH2Cl + Hg0] +N 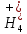 + Cl- + 2H2O + Cl- + 2H2O Белый осадок остался на фильтре, после добавления гидроксида аммония цвет изменился на чёрный. Б) 2HgNO3 + Cu = Cu(NO3)2 + 2Hg 2Hg2+ + 2N  + Cu0 = Cu2+ + 2N + Cu0 = Cu2+ + 2N + 2Hg0 + 2Hg02Hg2+ + Cu0 = Cu2+ + 2Hg0 Образовалось светлое металлическое пятно. Катион Ba2+ BaCl2 + H2SO4 = BaSO4↓ + 2HCl Ba2+ + 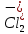 + + 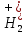 + S + S = BaSO4 + 2H+ + 2Cl- = BaSO4 + 2H+ + 2Cl-Ba2+ + S  = BaSO4 = BaSO4 Выпал белый осадок. Катион Ca2+ CaCl2 + H2SO4 = CaSO4 + 2HCl Ca2+ + 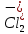 + + 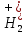 + S + S = CaSO4 + 2H+ + 2Cl- = CaSO4 + 2H+ + 2Cl-Ca2+ + S  = CaSO4 = CaSO4 Выпал белый осадок. Катион Zn2+ А) ZnSO4 + Na2S = ZnS + Na2SO4 Zn2+ + S  + N + N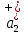 + S2- = ZnS + N + S2- = ZnS + N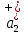 + S + S Zn2+ + S2- = ZnS Б) 3ZnSO4 + 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2 + 3K2SO4 3Zn2+ + 3S  + 2 + 2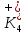 + 2[Fe(CN)6]4- = K2Zn3[Fe(CN)6]2 + 3 + 2[Fe(CN)6]4- = K2Zn3[Fe(CN)6]2 + 3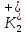 + 3S + 3S 3Zn2+ + 2K+ + 2[Fe(CN)6]4- = K2Zn3[Fe(CN)6]2 В) ZnSO4 + (NH4)2[Hg(CNS)4] = Zn[Hg(CNS)4] + (NH4)2SO4 Zn2+ + S  + 2N + 2N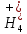 + [Hg(CNS)4]2- = Zn[Hg(CNS)4] + 2N + [Hg(CNS)4]2- = Zn[Hg(CNS)4] + 2N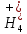 + S + S Zn2+ + [Hg(CNS)4]2- = Zn[Hg(CNS)4] Во всех реакциях выпал белый осадок. Катион Cr3+ А) 2Cr(SO4)3 + 4NaOHизб + 3H2O2 = 2Na2CrO4 + 8H2O 2Cr2+ + 2C 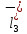 + 4Na+ + 4OH- + 3H2O2 = 2 + 4Na+ + 4OH- + 3H2O2 = 2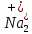 + Cr + Cr + 8H2O + 8H2O2Cr2+ + 4OH- + 3H2O2 = Cr  + 8H2O + 8H2ONa2CrO4 + BaSO4 = BaCrO4 + Na2SO4 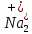 + Cr + Cr + BaSO4 = BaCrO4 + + BaSO4 = BaCrO4 + 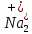 + S + S Cr  + BaSO4 = BaCrO4 + S + BaSO4 = BaCrO4 + S Выпалжелтыйосадок. Б) 2Cr(SO4)3 + 10NaOH + 3H2O2 = 2Na2CrO4 + 3Na2SO4 + 8H2O 2Cr2+ + 6 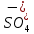 + 10Na+ + 10OH- + 3H2O2 = 2 + 10Na+ + 10OH- + 3H2O2 = 2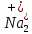 + Cr + Cr + 6Na+ + 6SO4- + 8H2O + 6Na+ + 6SO4- + 8H2O2Cr2+ + 10OH- + 3H2O2 = Cr  + 8H2O + 8H2O2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O 2 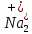 + 2Cr + 2Cr + + 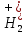 + S + S → → 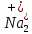 + Cr2 + Cr2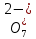 + + 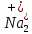 + S + S + H2O + H2O 2Cr  + + 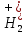 → Cr2 → Cr2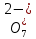 + H2O + H2O Выпал оранжевый осадок, после добавления серной кислоты цвет изменился на оранжевый. Катион Mg2+ MgSO4 + Na₂HPO₄ + NH4OH = NH₄MgPO₄ + Na2SO4 + H2O Mg2+ + S  + N + N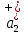 + HP + HP + NH4OH = NH₄MgPO₄ + N + NH4OH = NH₄MgPO₄ + N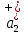 + S + S + H2O + H2OMg2+ + HP  + NH4OH = NH₄MgPO₄ + H2O + NH4OH = NH₄MgPO₄ + H2OВыпал белый кристаллический осадок. Катион Mn2+ 2MnSO4 + 16HNO3 + 5NaBiO₃ = 2HMnO₄ +NaNO3 + 5Bi(NO3)3 + 2Na2SO4 + 7H2O 2Mn2+ + 2S  + 16H+ + 16N + 16H+ + 16N + 5Na+ + 5Bi + 5Na+ + 5Bi = 2H+ + 2Mn = 2H+ + 2Mn +Na+ + N +Na+ + N + 5Bi+ + 15N + 5Bi+ + 15N + 4Na+ + 2S + 4Na+ + 2S + 7H2O + 7H2O2Mn2+ + 14H+ + 5Bi  = 2Mn = 2Mn + 5Bi+ + 7H2O + 5Bi+ + 7H2OВыпал осадок розового цвета. Катион Fe3+ А) FeCl3 + 3NH₄SCN = Fe(SCN)3 + 3NH4Cl Fe3+ + C 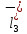 + 3N + 3N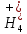 + 3SCN- = Fe(SCN)3 + 3N + 3SCN- = Fe(SCN)3 + 3N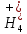 + 3Cl- + 3Cl-Fe3+ + 3SCN- = Fe(SCN)3 Цвет раствора изменился на красный. Б) 4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl 4Fe3+ + 4C 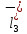 + 3 + 3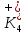 + 3[Fe(CN)6]4- = Fe3[Fe(CN)6]2+ 12K+ + 12Cl- + 3[Fe(CN)6]4- = Fe3[Fe(CN)6]2+ 12K+ + 12Cl-4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3 Выпал тёмно-синий осадок. Катион Cu2+ 2CuSO4 + 2NH4OH = (CuOH)2SO4 + (NH4)2SO4 2Cu2+ + 2S  + 2NH4OH = (CuOH)2SO4 + 2N + 2NH4OH = (CuOH)2SO4 + 2N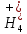 + S + S 2Cu2+ + S  + 2NH4OH = (CuOH)2SO4 + 2N + 2NH4OH = (CuOH)2SO4 + 2N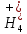 Выпал зелёный осадок, в избытке гидроксида аммония осадок растворился, а раствор приобрёл синюю окраску. Катион Ni2+ NiSO4 + C₄H₈N₂O₂ + 2NH4OH= Ni(C4H7N2O2)2 + (NH4)2SO4 + 2H2O Ni2+ + S  + C₄H₈N₂O₂ + 2NH4OH = Ni(C4H6N2O2)2 + 2N + C₄H₈N₂O₂ + 2NH4OH = Ni(C4H6N2O2)2 + 2N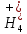 + S + S + 2H2O + 2H2ONi2+ + C₄H₈N₂O₂ + 2NH4OH = Ni(C4H7N2O2)2 + 2N 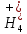 + 2H2O + 2H2OВыпал розовый осадок. Катион Co2+ CoSO4 + (NH4)2[Hg(SCN)4] = Co[Hg(CNS)4] + (NH4)2SO4 Co2+ + S  + 2N + 2N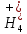 + [Hg(SCN)4]2- = Co[Hg(CNS)4] + 2N + [Hg(SCN)4]2- = Co[Hg(CNS)4] + 2N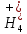 + S + S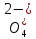 Co2+ + [Hg(SCN)4]2- = Co[Hg(CNS)4] Выпал синий осадок. Раствор приобрёл розовый окрас. Катион Cd2+ CdCl2 + Na2S = CdS + 2NaCl Cd2+ + C 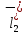 + N + N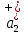 + S2- = CdS + 2Na+ + 2Cl- + S2- = CdS + 2Na+ + 2Cl-Cd2+ + S2- = CdS Выпал желтый осадок. Катион Hg2+ Hg(NO3)2 + Cu = Cu(NO3)2 + Hg Hg2+ + 2N  + Cu0 = Cu2+ + 2N + Cu0 = Cu2+ + 2N + Hg0 + Hg0Hg2+ + Cu0 = Cu2+ + Hg0 Образовалось светлое металлическое пятно. Вывод: в ходе данной лабораторной работы я изучила качественные реакции на определенные катионы. |
