Отчет по лабораторной работе 1 по дисциплине Строительные материалы
 Скачать 118.12 Kb. Скачать 118.12 Kb.
|
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ЖЕЛЕЗНОДОРОЖНОГО ТРАНСПОРТА Федеральное государственное бюджетное образовательное учреждение высшего образования «Иркутский государственный университет путей сообщения» Красноярский институт железнодорожного транспорта - филиал Федерального государственного бюджетного образовательного учреждения высшего образования «Иркутский государственный университет путей сообщения» (КрИЖТ ИрГУПС) Факультет «Заочное обучение и дополнительное профессиональное образование» Кафедра «Общепрофессиональные дисциплины» Отчет по лабораторной работе №1 по дисциплине «Строительные материалы» К.532240.23.05.06
КРАСНОЯРСК 2021 ИЗУЧЕНИЕ ДИАГРАММЫ СОСТОЯНИЯ СПЛАВОВ ЖЕЛЕЗА С УГЛЕРОДОМ Цель работы: дать студентам запас знаний по данной диаграмме, необходимый для понимания сути процессов, происходящих при кристаллизации и последующем охлаждении железо углеродистых сплавов, а в дальнейшем - при их термообработке. Теоретические сведения Основные свойства железа ЖЕЛЕЗО- переходный ферромагнитный металл. Порядковый номер-26, атомная масса-55, 85, плотность-7784 кг/м3, (7,784 г/см3), температура плавления - 1539°С. Чистое железо (99,9917%) имеет твердость по Бринеллю 490МПа (49 НВ). Технически чистое железо (99,9 - 99,8%) имеет твердость около 90 НВ, σВ = 300 - 350 МПа (30-35 кгс/мм2), δ = 35 - 40%. Особо важным свойством железа является его аллотропия, т. е. наличие нескольких кристаллических модификаций. Низкотемпературное αжелезо (ниже 910о С) и высокотемпературное δ - железо (выше 1392оС и до температуры плавления) имеют одинаковую объемно центрированную кубическую решетку (ОЦК). В интервале температур 910 – 1392оС стабильным является γ - железо с гранецентрированной кубической решеткой (ГЦК). Feβ является немагнитной разновидностью Feα (при превращении α↔β в точке Кюри А2 при температуре 768о пространственная решетка не меняется). С металлами железо образует твердые растворы замещения, а с углеродом, азотом, бором, водородом (имеющими малый радиус атомов) - твердые растворы внедрения. Наиболее широкое применение в различных отраслях промышленности получили железоуглеродистые сплавы - стали и чугуны. УГЛЕРОД- порядковый номер 6, атомная масса 12,011, имеет плотность 2300 кг/м3, температуру возгонки около 3500 °С, может находиться в двух аллотропических модификациях: графит и алмаз. Углерод в сплавах с железом может существовать в виде цементита (карбида железа Fe3C) и в виде графита (свободный углерод). Цементит (800 НВ) является неустойчивым химическим соединением, имеет сложную орторомбическую кристаллическую решетку. При высокой температуре и продолжительной выдержке цементит распадается с образованием графита и аустенита. Этот процесс имеет важное практическое значение для высокоуглеродистых сплавов - чугунов. В сталях, где концентрация углерода сравнительно невысока, цементит имеет большую устойчивость. Графит- углерод, выделяющийся в железоуглеродистых сплавах в свободном состоянии. Имеет гексагональную кристаллическую решетку. Графит электропроводен, химически стоек, малопрочен, мягок. Диаграмма фазового равновесия «железо - углерод» Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы Fe-С. Это объясняется тем, чтог в технике наиболее широко применяются железоуглеродистые сплавы. Современный вариант диаграммы состояния «железо - углерод» приведен на рис. 6.1. Характерной особенностью этой диаграммы является то, что на ней нанесены две системы одновременно:система Fe – Fe3C (железо - цементит)-метастабильная - и (железо - графит)-стабильная. Большое практическое значение имеет метастабильная диаграмма, т.к. с помощью этой диаграммы объясняют превращения, происходящие в сталях и белых чугунах. Диаграмма является основой для рационального выбора оптимальных режимов термической обработки железоуглеродистых сплавов. 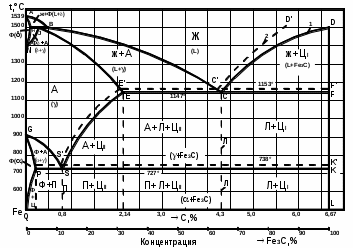 Рис 6.1. Диаграмма состояния «железо-углерод»: I - метастабильная; 2 - стабильная Рис 6.1. Диаграмма состояния «железо-углерод»: I - метастабильная; 2 - стабильнаяОсновные фазы, области, линии и точки диаграммы В сплавах системы «железо - углерод» встречаются следующие фазы: 1. Жидкий раствор. 2. Твердые растворы на основе различных кристаллических модификаций железа. 3. Химическое соединение Fe3C (цементит). 4. Структурно - свободный углерод (графит). Жидкая фаза Ж (L) представляет собой неориентированный раствор Fe и С, распространяющийся выше линии ликвидус АВСД от 0 до 6,67% С (рис. 6.1). ФЕРРИТОМ (Ф) называется твердый раствор углерода в α- железе. У него сохраняется решетка Feα (ОЦК). Феррит занимает на диаграмме узкую область, примыкающую к железу, - GPQ. Максимальная растворимость углерода в нем не более 0,02% (точка Р), при комнатной температуре она равна 0,006%. Твердость феррита 65 - 130 НВ, δ =40%. Раствор углерода в высокотемпературном δ - железе называется дельта - ферритом. Область устойчивости дельта-феррита AHN, концентрация углерода достигает 0,1% (точка Н, рис. 6. 2) АУСТЕНИТ (А) - твердый раствор внедрения углерода в γ - железе (с решеткой ГЦК). Однофазная область аустенита на диаграмме ограничена линией NJESG. Максимальная растворимость углерода в аустените составляет 2,14 % (1147°С, точка Е). С понижением температуры до 727°С растворимость углерода в аустените понижается до 0,02%. Линия ЕS называется линией предельной растворимости. ЦЕМЕНТИТ (Ц) - химическое соединение железа с углеродом, соответствующее формуле Fe3C с концентрацией углерода 6,67% (вертикальная линия DFK). Температура плавления цементита точно не определена, т.к. при нагревании он легко распадается на аустенит и графит. Все остальные области диаграммы, за исключением перечисленных, являются двухфазными. В двухфазных областях в равновесии находятся: в области АВН - жидкий раствор и кристаллы феррита; HJN - кристаллы феррита и аустенита; JBCE - жидкий раствор и кристаллы аустенита; SECFK - кристаллы аустенита и цементита; QPSKL- - кристаллы феррита и цементита. Горизонтальные линии на диаграмме отвечают равновесным трехфазным состояниям сплавов. В сплавах с концентрацией углерода от 0,I до 0,51% при температуре 1499°С (линия HJB) происходит перитектическое превращение .В результате взаимодействия кристаллов феррита с окружающим жидким раствором образуется аустенит: Ж(B) + Ф(Р) → A(J) Перитектическое превращение в сплавах, расположенных левее точки J (С=0,1 - 0,16%), идет до исчезновения жидкой фазы, а в сплавах, расположенных правее точки J (С = 0,16 - О, 51%), -до исчезновения феррита. При температуре 11470 С (линия ЕСF) в сплавах с концентрацией углерода от 2,14 до 6,67% происходит эвтектическое превращение: Ж(С) ↔ A(E) + Ц(F) В процессе превращения жидкий раствор затвердевает в виде механической смеси кристаллов аустенита и цементита, которая называется ледебуритом (Л). Во всех сплавах системы с концентрацией углерода более 0,02% при температуре 727°С (линия РSК) происходит эвтектоидное превращение, заключающееся в распаде аустенита на дисперсную механическую смесь чередующихся пластинок феррита и цементита, которая называется перлитом (П): A(S) ↔ Ф(Р) + Ц(К) Перлит чаще всего имеет пластинчатое строение и является прочной структурной составляющей: σВ = 800…900 МПа; δ ≤ 16%; твердость – 180-220 НВ. Причиной эвтектоидной реакции является следующее: 1. В сплавах при температуре 727о происходит полиморфное превращение- железо с решеткой ГЦК превращается в железо с решеткой ОЦК; 2. В связи с этим уменьшается растворимость углерода с 0,8% до 0,02% (в 40 раз); 3.Углерод становится лишним и выделяется в виде цементита. Цементит может образовываться из жидкой и твердой фаз при различных температурах. Цементит, выделяющийся из жидкой фазы, называется первичным (ЦI), из аустенита - вторичным (ЦII) а из феррита - третичным (ЦIII).Соответственно на диаграмме состояния СD- линия первичного цементита, ЕS- линия вторичного цементита, РQ- линия третичного цементита. Железоуглеродистые сплавы при температурах, соответствующих перитектическому, эвтектическому или эвтектоидному превращению, находятся в трехфазном равновесном состоянии. Согласно правилу фаз (С = К - Ф + I) равновесие является нонвариантным (С =2-3+1=0). Все эти превращения происходят при определенных температурах и характеризуются остановкой (горизонтальным участком) на кривой охлаждения сплавов. Построение кривых охлаждения сплавов заданной концентрации с использованием диаграммы состояния Формирование фаз или структур в сплавах можно изучить, рассматривая по диаграмме процессы, происходящие в них при охлаждении или нагреве. Для этого необходимо на оси концентраций найти процентное содержание углерода, соответствующее заданию и провести вертикальную линию сплава (ординату). Точки пересечения линии сплава с точками диаграммы являются критическими точками, которые необходимо обозначить индексами: 1, 2, 3 и т.д. Точка 1 всегда должна находиться на линии ликвидус. Рядом с диаграммой начертить график охлаждения данного сплава в координатах «время-температура», показав связь критических точек на диаграмме и графике ( время при этом откладывается произвольно), и описать сущность превращений, происходящих в сплаве при медленном охлаждении. В качестве примера проследим за формированием структур сплава с содержанием углерода 1,5 % при медленном охлаждении с 16000 С с описанием фазовых превращений, происходящих в сплаве. Сплав до температуры 14500 С (точка 1) находится в жидком состоянии. Кристаллизация его начинается при 14500 С с выделением из жидкого раствора кристаллов аустенита. Кристаллизация сплава заканчивается в точке 2 (12500 С). В интервале температур 1250 – 9500 С (точки 2, 3) сплав охлаждается, не претерпевая никаких изменений. При охлаждении сплава ниже 9500 С (точка 3) аустенит с концентрацией углерода 1,5 % становится пересыщенным. Избыточный углерод из зерен аустенита диффундирует к их границам и выделяется в виде цементита вторичного. Концентрация углерода в аустените при охлаждении сплава от 950 до 7270 изменяется согласно линии ES от точки 3 к точке S: А(3-S) ® ЦII При температуре 7270 С (точка 4) в сплаве происходит эвтектоидное превращение. Аустенит (0,8 % С) распадается на феррито-цементитную смесь – перлит: АS 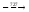 Фр + Цк Фр + Цк С понижением температуры сплава ниже 7270 С растворимость углерода в феррите уменьшается (линия PQ). В связи с этим избыточный углерод из феррита выделяется в виде цементита третичного: Ф(р-Q) 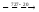 ЦIII ЦIIIОднако выделяющийся цементит третичный в структуре стали металлографически не различается, т.к. сливается с цементитом эвтектоида. В структуре сплава с концентрацией углерода 1,5 % при комнатной температуре наблюдаются зерна перлита, окаймленные тонкой сеткой цементита вторичного. При построении кривой охлаждения необходимо учитывать следующие закономерности: если охлаждается одна фаза- кривая охлаждения имеет вогнутый вид; если одновременно существуют две фазы –выпуклый вид; если одновременно существуют три фазы –на кривой охлаждения появляется горизонтальная площадка. 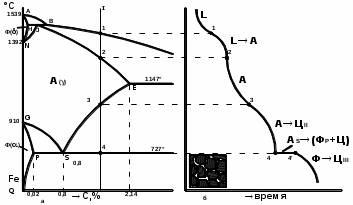 Рис.6.2.. Схема для изучения превращений, происходящих в сплаве 1 при охлаждении: а – диаграмма состояния; б – кривая охлаждения (кристаллизации) сплава и конечная структура  Таблица 1.1. Характерные точки диаграммы состояния Fe-Fe3C
Таблица 1.2. Линии трехфазного равновесия
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
