Отчет по лабораторной работе Приготовление раствора и определение его концентрации. Отчет по лабораторной работе 4 По дисциплине Химия
 Скачать 69.2 Kb. Скачать 69.2 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей химии ОТЧЕТ по лабораторной работе №4 По дисциплине Химия (наименование учебной дисциплины согласно учебному плану) Тема работы: Приготовление раствора и определение его концентрации Работу выполнил:  студент гр. САМ-22 Беляшова М.А.  (должность) (подпись) (Ф.И.О.) ОЦЕНКА: Дата выполнения: Санкт-Петербург 2022 Цель работы: Ознакомиться с методами приготовления раствора заданной концентрации и анализом раствора при помощи титрования. Общие сведения: Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных пределах. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми. В растворах выделяют растворитель и растворенное вещество. Растворителем называют компонент, который образует непрерывную среду. остальные компоненты, которые распределены в среде растворителя в виде дискретных частиц, называются растворенными веществами. Состав раствора (концентрация) чаще всего выражается следующими способами. Массовая доля или процентное содержание – соотношение масс растворенного mв вещества и раствора mр-р, выраженное в долях или процентах. 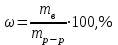 . .Концентрация, выраженная в граммах на литр, Сг/л – показывает, какая масса растворенного вещества mв, выраженная в граммах, содержится в единице объема раствора Vр-р: 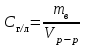 , г/л. , г/л.Молярная концентрация или молярность, СМ – число молей растворенного вещества nв в одном дм3 (л) раствора: 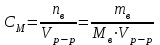 , моль/л. , моль/л.Моляльная концентрация или молярность, Сm – число молей растворенного вещества, приходящееся на один килограмм растворителя: 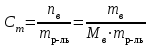 моль/кг. моль/кг.Мольная доля или мольные проценты xi– число молей компонента (растворителя или же растворенного вещества) содержащееся в одном моле раствора: 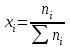 . .Нормальная концентрация или нормальность, CN – количество эквивалентов растворенного вещества nэв, содержащееся в одном литре раствора: 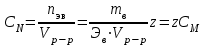 экв/л, экв/л,где z– количество обменных эквивалентов растворенного вещества, содержащееся в одном его моле. Для кислот z соответствует основности кислоты, т. е. числу атомов водорода в составе кислоты, обмениваемых в данной реакции на металл или нейтрализуемых основанием. Для оснований z соответствует кислотности основания, т.е. числу гидроксильных групп в составе основания, обмениваемых на кислотный остаток или нейтрализуемых кислотой. Для солей z рассчитывают как произведение числа атомов и степени окисления металла в составе соли. Для окислителей и восстановителей в окислительно-восстановительных реакциях z – изменение их степени окисления в ходе реакции. Прием количественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации, называют титрованием. Состояние системы, в котором аналитическая реакция прошла полностью в соответствии со стехиометрическим уравнением при отсутствии избытка реагента, называют точкой эквивалентности. Задача титрования – определить эквивалентный объем добавляемого реагента – титранта, необходимый для установления точки эквивалентности, так как в ней числа эквивалентов определяемого вещества и титранта равны между собой. Из определения нормальной концентрации следует, что число эквивалентов вещества в растворе равно произведению нормальности на объем раствора. Следовательно: 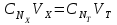 . .Отобрав для титрования мерной пипеткой точный объем пробы Vx, зная нормальность титранта 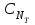 и определив эквивалентный объем VT, можно вычислить концентрацию пробы и определив эквивалентный объем VT, можно вычислить концентрацию пробы 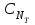 . . До эквивалентной точки в ходе титрования в растворе присутствует избыток определяемого вещества, а после – избыток титранта. Поэтому в эквивалентной точке свойства раствора резко изменяются, в частности, изменяется окраска специально подобранных цветных индикаторов, что позволяет определить эквивалентный объем титранта. Содержание протокола лабораторной работы. Заданная преподавателем концентрация соляной кислоты – С𝐻𝐶𝑙 = 0,2 экв/л Расчет объема соляной кислоты, необходимого для приготовления 200 мл раствора кислоты заданной концентрации – V=10,86 мл Объем аликвоты соляной кислоты, взятый для титрования – 𝑉а = 5 мл Концентрация раствора щелочи СNaOH= 0,2 экв/л Объем щелочи, пошедший на титрование пробы соляной кислоты: VNaOH,1= 2,4 мл VNaOH,2= 2,8 мл VNaOH,ср= 2,6 мл Ход работы: 1. В 2 конические колбы пипеткой Мора отобрали аликвотные объемы приготовленного раствора 5 мл, добавили немного дистиллированной воды (до толщины слоя жидкости около 5 мм) и 2−3 капли индикатора – фенолфталеина. 2. Бюретку на 25 мл наполнили титрованным раствором едкого натра. Затем медленно, по каплям, добавляли раствор щелочи из бюретки к аликвоте кислоты (5 мл), непрерывно перемешивая раствор в конической колбе. 3. Мы провели титрование дважды и определили эквивалентную точку по переходу окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с. При этом в первый и второй разы потребовалось 3,15 мл щелочи. Рассчитаем концентрацию соляной кислоты по результатам титрования: 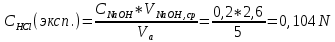 Найдем относительную погрешность эксперимента: 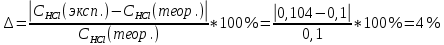 Вывод: Мы ознакомились с методами приготовления раствора заданной концентрации и анализом раствора при помощи титрования. |
