Отчет по лабораторной работе 5 По дисциплине
 Скачать 152.41 Kb. Скачать 152.41 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО науки и высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра физической химии ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №5 По дисциплине Химия. Часть 2 (наименование учебной дисциплины согласно учебному плану) Тема работы: «Исследование кинетики молекулярной адсорбции» Выполнил: студент гр. НГС-19-1 Натейкин Д.А. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Выполнил: студент гр. НГС-19-1 Свитонько В.А. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил руководитель работы: доцент Берлинский И.В. (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2020 Название работы: Исследование кинетики молекулярной адсорбции. Цель работы Установить продолжительность контакта фаз, достаточную для получения изотермы сорбции. Определение концентрации раствора слабой кислоты. В три конические колбы была отобрана аликвота 5 мл раствора слабой кислоты, добавили по 3-4 капли фенолфталеина; Добавили дистиллированную воду, смывая капли фенолфталеина со стенок колбы, до толщины слоя жидкости от 5 до 15 мм Пробы анализируем на содержание кислоты методом индикаторного титрования с фенолфталеином, объем щелочи, добавленный из бюретки во время опыта, записываем в таблицу 2. Методика анализа: Отобран раствор щелочи в химический стакан объемом 50 мл. Из стакана раствор щелочи бал налит в бюретку. Выпустили воздух из носика бюретки Объем щелочи в бюретке доведен до отметки «0». Оттитровали раствором гидроксидом натрия до перехода окраски фенолфталеина от бесцветной к малиновой, сохраняющейся при перемешивании в течение 30 с. II 1. В круглую колбу объемом 500 мл при помощи мерного цилиндра отмеряют 250 мл раствора кислоты, заданного преподавателем. 2. В коническую колбу № 1 вместимостью 100 мл мерной пипеткой на 5 мл отбирают пробу раствора кислоты, взятого на эксперимент, и отставляют в сторону. 3. В полиэтиленовом стакане взвесили 15,0 г активированного угля. 4. Колбу с раствором поместили на шейкер, высыпали навеску угля в кислоту, включили перемешивание. 5. Каждые 3 минуты из колбы на шейкере мерной пипеткой объемом 5 мл отбирают пробы кислоты в конические колбы на 100 мл с № 2 по № 10. 6. После того, как все пробы были отобраны, остановили перемешивание. 7. Все пробы и исходный раствор кислоты, взятый для проведения серии экспериментов, были проанализированы на содержание кислоты по методу, описанному выше, объем щелочи, добавленный из бюретки во время опыта, записываем в таблицу 1. Содержание протокола лабораторной работы. Масса навески угля g=15 г. Концентрация раствора щелочи 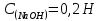 экв/л. экв/л.Название слабой кислоты: уксусная кислота; химическая формула: СH3COOH. Ориентировочная концентрация кислоты 0,3 Н Объем раствора кислоты ,взятой для проведения опыта 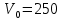 мл. мл.Объем аликвоты  мл, взятой для анализа. мл, взятой для анализа.Таблица экспериментальных данных: зависимость содержания кислоты от времени
Таблица 1. Изменение концентрации уксусной кислоты в зависимости от продолжительности перемешивания.
Таблица 2. Определение концентрации уксусной кислоты. Обработка экспериментальных данных. 1. Вычислим точное значение концентрации уксусной кислоты по результатам анализа проб с кислотой без угля, взяв среднее значение объема щелочи из таблицы 2 по формуле:  Где Сi – концентрация уксусной кислоты экв/л СNaOH – концентрация щелочи, экв/л Vi – объем щелочи 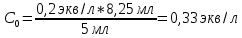 2. Значения концентрации уксусной кислоты для проб с углем:
Таблица 3. Изменение концентрации уксусной кислоты в зависимости от продолжительности перемешивания.  График 1. Зависимость концентрации уксусной кислоты в зависимости от продолжительности перемешивания. 3. Вычислим величину статической обменной емкости сорбента:  , ,где mC – масса угля,г; n∞ − количество молей кислоты, оставшихся в растворе на момент равновесия,  . .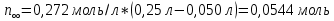 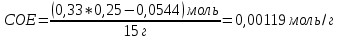 4. Лимитирующая стадия сорбции. 4.1 Данные для интервала времени от начала процесса до момента, когда исчезает зависимость концентрации от времени – 30 минут. 4.2 Таблица 4, где Z – номер пробы, t – время в минутах; Сz – текущая концентрация кислоты в растворе, моль/л; С0 – исходная концентрация кислоты в растворе, моль/л. Концентрации С0 и Сz вычисляют по формуле: 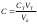 , ,Сt − текущая концентрация, приведенная к исходному объему, моль/л, которую вычисляют по формуле: 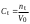 , ,где nt – количество вещества, оставшееся в растворе на текущий момент времени, nt рассчитывается по формуле: 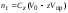 , ,где Vпр – объем пробы, отобранный для последующего определения концентрации, Vпр = 5 мл; z – номер пробы. C∞ - величина равновесной концентрации кислоты в растворе, которую вычисляют по формуле 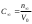 ; ;где  Пример расчета величин:  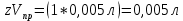  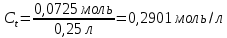 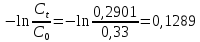 
Таблица 4. 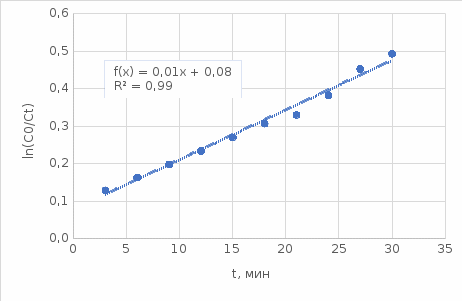 График 2. Зависимость отношения исходной концентрации к текущей от времени.  График 3. Зависимость отношения разности исходной и текущей концентрации к исходной и равновесной. 4.5 Сопоставим величину достоверность R2 для предыдущих зависимостей: R2ln(C0/C) = 0,9864; R2 (C0 - Ct)/(C0 - C ꚙ)= 0,9645, наиболее близкое к 1 R2ln(C0/C). Стадией, определяющей скорость процесса, является диффузия в тонком слое раствора в непосредственной близости от зерна сорбента («пленочная кинетика» или внешнедиффузионная кинетика). 4.6 По значению углового коэффициента определим константу скорости процесса : k=0,0132. Вывод: Для исследования адсорбции был использован статистический метод, при котором определяется точное значение концентрации исходного раствора и встряхивается раствор с адсорбентом в пока не установится адсорбированное равновесие. В ходе эксперимента определена продолжительность контакта фаз и стадия сорбции. Изотерма сорбции имеет линейный характер, по углу наклона была определена константа скорости реакции. |

 , мл
, мл
