Получение апиксабана. Апиксабан. Отчет по практике научноисследовательская работа 1 учебный период Место прохождения практики
 Скачать 145.57 Kb. Скачать 145.57 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Пермский государственный национальный исследовательский университет Химический факультет Отчет по практике НАУЧНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА 1 учебный период Место прохождения практики: химический факультет ПГНИУ, г. Пермь Выполнил: студент 2 курса группы ХИМ-3,4-20 НБ Шумяцкая Ксения Юрьевна Руководитель: ассистент кафедры органической химии, Третьяков Н.А. Пермь, 2022 Индивидуальный план На основании литературных данных выбрать наиболее оптимальный метод синтеза Апиксабана. Введение По данным ВОЗ, тромбоз-ассоциированные заболевания занимают одну из лидирующих позиций в структуре заболеваемости и смертности населения всего мира. Среди средств предотвращения тромбозов лидирующее место занимают антикоагулянты. Их широко используют в хирургической и терапевтической практике. До недавнего времени длительная антикоагулянтная терапия осуществлялась за счет приема непрямых антикоагулянтов, недостатками действия которых является медленное развитие эффекта, длительный процесс восстановления свертывания. [1] В настоящее время наиболее перспективными для длительного приема препаратами являются прямые антикоагулянты ингибиторы Xа фактора, так как их применение не требует постоянного контроля степени коагуляции. Одним из таких препаратов является Апиксабан. Препарат применяется только в таблетированной форме, зарубежного производства и является дорогостоящим, что зачастую ограничивает его применение. [2] Поэтому актуальным является поиск наиболее оптимального метода синтеза такого прямого антикоагулянта, как Апиксабан. Цель научно-исследовательской работы – поиск наиболее оптимального метода синтеза апиксабана среди множества химической информации. Задачи научно-исследовательской работы: Развить и усовершенствовать навыки поиска и отбора информации; Сравнить синтезы апиксабана и определить наиболее оптимальный; Сформировать умения написания научно-исследовательской работы. Литературный обзор Химическим названием Апиксабана является 4,5,6,7-тетрагидро-1-(4-метоксифенил) -7-оксо-6-[4-(2-оксо-1-пиперидинил) фенил]-1Н-пиразоло[3,4-с] пиридин-3-карбоксамида (Апиксабана). Ниже представлена структурная формула: 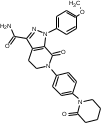 В литературе описаны различные варианты синтеза Апиксабана, например, CN113121577A; WO2015162551A1; WO2014072884A1; EP3228619A; JPS562247A. Наиболее простой метод синтеза Апиксабана описан в патенте JPS562247A. Он содержит наименьшее количество стадий с доступным описанием. Ниже приведена последовательность химических реакций и конкретные методы синтеза, описанные в соответствующем патенте. Способ получения включает следующие стадии: Обработка 4-нитроанилина 5-хлорпентаноилхлоридом с получением 1-(4-нитрофенил)пиперидин-2-она; Превращение 1-(4-нитрофенил)пиперидин-2-она в 3-Морфолино-1-(4-нитрофенил)-5,6-дигидропиридин-2(1H)-он; Обработка 3-Морфолино-1-(4-нитрофенил)-5,6-дигидропиридин-2(1H)-она раствором безводного сульфида натрия с получением 1-(4-Аминофенил)-3-морфолино-5,6-дигидропиридин-2(1H)-она; Добавление 5-хлорпентаноилхлорида к 1-(4-Аминофенил)-3-морфолино-5,6-дигидропиридин-2(1H)-ону, получение 3-Морфолино-1-(4-(2-оксопиперидин-1-ил)фенил)-5,6-дигидропиридин2(1H)-она; Получение (Z)-Этил 2-Хлор-2-(2-(4-метоксифенил)гидразоно)ацетата из 3-Морфолино-1-(4-(2-оксопиперидин-1-ил)фенил)-5,6-дигидропиридин2(1H)-она; Превращение 3-Морфолино-1-(4-(2-оксопиперидин-1-ил)фенил)-5,6-дигидропиридин2(1H)-она в этил 1-(4-Метоксифенил)-7-оксо-6-(4-(2-оксопиперидин-1-ил)фенил)-4,5,6,7-тетрагидро-1H-пиразоло[3,4-c]пиридин-3-карбоксилат; Получение апиксабана (4,5,6,7-тетрагидро-1-(4-метоксифенил) -7-оксо-6-[4-(2-оксо-1-пиперидинил) фенил]-1Н-пиразоло[3,4-с] пиридин-3-карбоксамида). 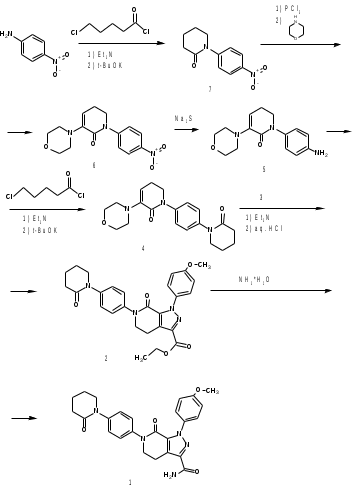 Схема 1. Общая схема получения 1 стадия: 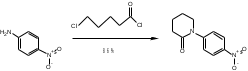 Раствор 5-хлорпентаноилхлорида (12,9 мл, 15,50 г, 0,10 моль) в тетрагидрофуране (THF, 20 мл) добавляют при температуре ниже 5 С к раствору 4-нитроанилина (11,05 г, 0,08 моль) и триэтиламина (22,5 мл, 0,16 моль) в THF (50 мл). Смесь перемешивают при комнатной температуре под N2 в течение 5 ч. Калий трет-бутоксид (24,70 г, 0,22 моль) добавляют в реакционный раствор партиями при температуре ниже 5 C в течение 30 мин и затем перемешивают при комнатной температуре в течение 2 ч. Суспензию сушат и повторно растворяют в этилацетате (100 мл) и воде (100 мл) для отделения органической фазы. Водную фазу экстрагируют этилацетатом (2*80 мл) и промывают водой (2*80 мл. Органическую фазу высушивают над безводным сульфатом натрия и полностью сушат для получения желтого твердого вещества. Перекристаллизация неочищенного продукта из этилацетата позволяет получить 1-(4-Нитрофенил)пиперидин-2-он (7) в виде бледно-желтого твердого вещества. Выход: 15,13 г, 86%; Tпл 97-99 С [3] 2 стадия: 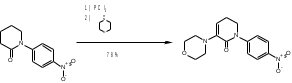 Пентахлорид фосфора (18,7 г, 0,09 моль) медленно добавляют к раствору 1-(4-Нитрофенил)пиперидин-2-она (6,6 г, 0,03 моль) в хлороформе (40 мл) при комнатной температуре. Полученную смесь нагревают до кипения в течение 3 ч, выливают в ледяную воду и экстрагируют хлороформом (3*30 мл). Объединенную органическую фазу сушат над безводным сульфатом натрия и сушат в вакууме. Остаток растворяют в морфолине (30 мл) и нагревают в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме до сухости. Полученное твердое вещество повторно растворяют в воде, а выпавший осадок отфильтровывают. Перекристаллизация фильтрата из этилацетата позволяет получить 3-Морфолино-1-(4-нитрофенил)-5,6-дигидропиридин-2(1H)-он (6) в виде желтого твердого вещества. Выход: 7,08 г, 78%; Tпл 158-160 C [3] 3 стадия: 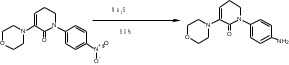 Раствор безводного сульфида натрия (9,60 г, 0,04 моль) в воде (20 мл) добавляют к раствору 3-Морфолино-1-(4-нитрофенил)-5,6-дигидропиридин-2(1H)-она (6,07 г, 0,02 моль) в этаноле (60 мл). Смесь нагревают до 50 C, перемешивают в течение 4 ч, охлаждают до комнатной температуры и сушат в вакууме. Остаток добавляют к этилацетату (60 мл), нагревают до кипения и отфильтровывают. Полученный фильтрат сушат в вакууме с получением 1-(4-Аминофенил)-3-морфолино-5,6-дигидропиридин-2(1H)-она (5) в виде бледно-желтого твердого вещества. Выход: 4,92 г, 90%; Tпл 180-182 C [3] 4 стадия: 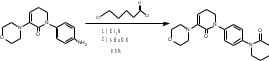 Раствор 5-хлорпентаноилхлорида (1,6 мл, 1,94 г, 12,5 ммоль) добавляют к раствору 1-(4-Аминофенил)-3-морфолино-5,6-дигидропиридин-2(1H)-она (2,73 г, 10 ммоль) и триэтиламина (2,8 мл, 20 ммоль) при температуре ниже 5 С. Смесь перемешивают при 50 С под N2 в течение 2 ч. К реакционному раствору добавляют трет-бутоксид калия (3,37 г, 30 ммоль) порциями при температуре ниже 5 С в течение 30 мин и затем перемешивают при 50 С в течение 8 ч. Суспензию охлаждают до комнатной температуры и сушат в вакууме. Остаток растворяют в воде, перемешивают и затем фильтруют, затем промывают водой и сушат, чтобы получить 3-Морфолино-1-(4-(2-оксопиперидин-1-ил)фенил)-5,6-дигидропиридин2(1H)-он (4) в виде белого твердого вещества. Выход: 3,02 г, 85%; Tпл 204-206 C [3] 5 стадия: Соляная кислота (35-36%, 6 мл, 60 ммоль) добавляют к раствору 4-метоксианилина (2,46 г, 20 ммоль) в воде (12 мл) при температуре от 5 до 0C. Раствор нитрита натрия (1,66 г, 24 ммоль) в воде (8 мл) добавляют к смеси по каплям при температуре ниже 0 С. Затем реакционный раствор перемешивают в течение 30 мин при 0 С, после чего добавляют ацетат натрия (3,28 г, 40 ммоль) до достижения pH 5-6. После этого добавляют раствор этил 2-хлорацетоацетата (2,8 мл, 3,28 г, 20 моль) в метаноле (30 мл) по каплям при температуре от 0 до 5 С. Полученный раствор перемешивают при комнатной температуре в течение 4 ч. Раствор удаляют из смеси, остаток растворяют в воде (10 мл) и этилацетате (20 мл). Полученный органический слой отделяют, и водную фазу экстрагируют этилацетатом (2*10 мл). Органическую фазу промывают водой (2*10 мл) и сушат безводным сульфатом натрия, фильтруют и тщательно сушат под вакуумом. Перекристаллизация неочищенного продукта из этилацетата позволяет получить (Z)-Этил 2-Хлор-2-(2-(4-метоксифенил)гидразоно)ацетат (3) в виде бледно-желтого твердого вещества. Выход: 3,94 г, 77%; Tпл 106-109 C [3] 6 стадия: 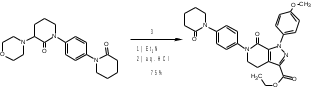 Соединение 3-Морфолино-1-(4-(2-оксопиперидин-1-ил)фенил)-5,6-дигидропиридин2(1H)-он (4) (1,42 г, 4,0 ммоль), триэтиламин (1,7 мл, 12 ммоль) добавляют к раствору соединения (Z)-Этил 2-Хлор-2-(2-(4-метоксифенил)гидразоно)ацетата (3) (1,13 г, 4,4 ммоль) в этилацетате (40 мл). При комнатной температуре добавляют йодид калия (0,064 г, 0,4 ммоль). Смесь перемешивают в течение 6 ч под избыточным давлением и затем охлаждают до 0 С. К полученной смеси по каплям добавляют 4,0 N соляную кислоту (5 мл, 20 ммоль) и перемешивают при комнатной температуре в течение 2 ч. После этого к смеси добавляют воду (10 мл), чтобы отделить органические вещества. Водный слой экстрагируют с этилацетатом (3*10 мл), а затем органический слой сушат над безводным сульфатом натрия и сушат в вакууме. Перекристаллизация остатка из этилацетата и сушка в вакууме позволяют получить этил 1-(4-Метоксифенил)-7-оксо-6-(4-(2-оксопиперидин-1-ил)фенил)-4,5,6,7-тетрагидро-1H-пиразоло[3,4-c]пиридин-3-карбоксилат (2) в виде бледно-желтое твердое вещество. Выход: 1,46 г, 75%; Tпл 120-124 C [3] 7 стадия: 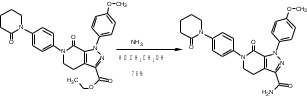 К полученному промежуточному продукту этил 1-(4-Метоксифенил)-7-оксо-6-(4-(2-оксопиперидин-1-ил)фенил)-4,5,6,7-тетрагидро-1H-пиразоло[3,4-c]пиридин-3-карбоксилату (2) (2,44 г, 5,0 ммоль) добавляют 25% аммиака (1,5 мл, 20 ммоль) в метаноле (20 мл), и смесь нагревают до 65 C в течение 5 ч. Полученную смесь охлаждают до комнатной температуры, выливают в воду (30 мл) и кристаллизируют при температуре ниже 0C. Выпавший осадок отфильтровывают и сушат в вакууме при 50C, чтобы получить желаемый продукт 4,5,6,7-тетрагидро-1-(4-метоксифенил) -7-оксо-6-[4-(2-оксо-1-пиперидинил) фенил]-1Н-пиразоло[3,4-с] пиридин-3-карбоксамида (апиксабан) в виде бледно-белого вещества. Выход: 2,09 г, 91%; Tпл 171-173 C [3] Заключение В ходе научно-исследовательской работы была достигнута цель, состоявшая в поиске наиболее оптимального синтеза апиксабана, путем решения следующих задач: Проведен поиск и выполнена оптимизация методик получения апиксабана; Усовершенствованы навыки поиска и отбора информации; Повышены умения работы с базами данных, графическими редакторами. Библиографический список Баркаган, З.С. Основы пролонгированной профилактики и терапии тромбоэмболий антикоагулянтами непрямого действия (показания, подбор доз, лабораторный мониторинг): методические указания / З.С. Баркаган – Москва: Ньюамед, 2003. -48 с. Пэрадайн, Н.А. Новые пероральные антикоагулянты [Электронный ресурс] / Н.А. Пэрадайн, 4 Н.В. Шувалова // Здравоохранение Чувашии. -2013, -№4. Jiang, Jian'an; Ji, Yafei (2013). Alternate Synthesis of Apixaban (BMS-562247), an Inhibitor of Blood Coagulation Factor Xa. Synthetic Communications, 43(1), 72–79. doi:10.1080/00397911.2011.591956 |
