Отчет. Отчет по практике вид (тип) практики Преддипломная практика Курс (группа)
 Скачать 109.82 Kb. Скачать 109.82 Kb.
|
|
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Тульский государственный университет»  Подразделение Кафедра «Химии» (наименование подразделения) Подразделение Кафедра «Химии» (наименование подразделения)ОТЧЕТ ПО ПРАКТИКЕ
Руководитель практики от профильной организации к.х.н., доцент Зайцев М.Г.   (Ф.И.О., должность) ( подпись) (Ф.И.О., должность) ( подпись)Руководитель практики от подразделения Горячева А.А., доцент кафедры химии   (Ф.И.О., должность) ( подпись) (Ф.И.О., должность) ( подпись)г. Тула, 2023 г. РЕФЕРАТ Отчёт 25 с., 4 рис., 8 табл., 15 источ. ВЫДЕЛЕНИЕ ПЕРОКСИДАЗЫ ХРЕНА ИЗ КОРНЕЙ Armoraciarusticana, КОНЦЕНТРИРОВАНИЕ ФЕРМЕНТА И КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ Объектом исследования являются корни Armoraciarusticana. Целью данной работы является выделение пероксидазы хрена из корней Armoraciarusticana, её количественное определение с последующим концентрированием. Для достижения цели были поставлены следующие задачи: Выделение пероксидазы хрена из корней Armoraciarusticana; Концентрирование фермента на концентрирующих фильтрах 10 кДа; Количественное определение методом Лоури. ОглавлениеВведение 5 1. Литературный обзор 6 1.1. Классификация пероксидаз 6 1.2. Пероксидаза хрена 7 1.3. Свойства пероксидазы хрена 9 1.4. Инактивация пероксидазы хрена 10 1.5. Методы выделения пероксидазы хрена 12 1.6. Применение пероксидазы хрена 13 1.6.1. Биосенсоры на основе пероксидазы хрена 13 1.6.2. Иммунобиосенсоры с пероксидазой хрена в качестве метки 15 1.6.3. ДНК-сенсоры с пероксидазой хрена в качестве метки 15 2. Экспериментальная часть 17 2.1. Выделение пероксидазы хрена 17 2.2. Определение концентрации фермента 17 3. Результаты и их обсуждения 18 3.1. Выделение и концентрирование пероксидазы хрена 18 3.2. Количественное определение белка 19 3.2.1. Количественное определение белка в растворенном осадке после высаливания 35% от насыщения сульфата аммония 22 3.2.2. Количественное определение белка в растворенном осадке после высаливания 70% от насыщения сульфата аммония 22 3.2.3. Количественное определение белка после концентрирования в растворенном осадке после высаливания 35% отнасыщения 23 3.2.4. Количественное определение белка после концентрирования в растворенном осадке после высаливания 70% отнасыщения 24 3.3. Концентрирование фермента 24 Выводы 25 Список литературы 26 ВведениеПероксидаза из корней хрена один из наиболее изученных и доступных ферментов класса оксидоредуктаз, обладающих групповой субстратной специфичностью и высокой каталитической активностью. Вследствие этого пероксидазу хрена широко используют для разработки ферментативных методик определения большого числа органических и неорганических веществ, являющихся ее субстратами и эффекторами, для аналитической биохимии и биотехнологии в качестве маркера антител, ДНК и низкомолекулярных соединений, а также в качестве фермента-маркера для иммуноферментного и иммуногистохимического анализа. 1. Литературный обзор1.1. Классификация пероксидазПероксидазы (КФ 1.11.1.Х) относятся к ферментам класса оксидоредуктаз. Они катализируют окисление широкого спектра субстратов под действием пероксида водорода. Молекулярная масса ферментов этого типа колеблется от 17 до 84 кДа, а длина полипептидной цепи – от 153 до 753 аминокислотных остатков. Белковая глобула обычно образована 10–11 α-спиралями, β-складки либо отсутствуют, либо представлены слабо [1]. Согласно общепринятой классификации, предложенной в 1992 г., пероксидазы подразделяются на два больших суперсемейства: животные пероксидазы и растительные. Суперсемейство растительных пероксидаз в свою очередь включает в себя 3 класса. I класс растительных пероксидаз включает внутриклеточные ферменты, такие как аскорбатпероксидаза, дрожжевая цитохром C пероксидаза и бактериальная каталаза-пероксидаза. Эти белки не гликозилированы и не содержат ни дисульфидных связей, ни ионов кальция. Ко II классу относятся секретируемые грибные пероксидазы. Наиболее хорошо изученные представители этого класса – лигнинпероксидаза и марганецпероксидаза, принимающие участие в окислении лигнина, а также пероксидаза из Coprinus cine reus (навозник обыкновенный, предыдущее название Arthromyces ramosus). Эти ферменты являются мономерными гликопротеидами, для которых характерно наличие четырёх дисульфидных связей и двух консервативных кальций-связывающих доменов. III класс представлен секретируемыми пероксидазами растений. Эти ферменты также являются мономерными гликопротеидами, имеют четыре дисульфидные связи и два кальций-связывающих центра, однако расположение дисульфидных связей и «укладка» полипептидной цепи в пероксидазах второго и третьего классов несколько различаются [2]. 1.2. Пероксидаза хренаИзофермент С пероксидазы из корней хрена хрена (HRP – horse radish peroxidase) является безусловным лидером по популярности среди растительных пероксидаз. В настоящее время он рассматривается как модельный для третьего класса растительных пероксидаз. Несмотря на то, что по многим параметрам HRP уступает другим известным пероксидазам, этот фермент наиболее широко используется на практике. В корнях хрена (Armoracia rusticana) содержится множество различных пероксидаз, но основная доля приходится на изофермент С, характеризующийся изоэлектрической точкой pI = 9 и проявляющий максимальную активность при рН = 6–8. Молекулярная масса HRP составляет около 44 кДа, 18–22% приходится на углеводную часть. Из девяти остатков Asn, по которым возможно присоединение углеводных цепей, как правило, гликозилированы восемь остатков (Asn 13, 57, 158, 186, 198, 214, 255 и 268) [3]. Состав углеводной части молекулы гетерогенен и зависит от многих факторов, например, от стадии и условий роста. Олигосахариды оказывают стабилизирующее воздействие на фермент. Они защищают фермент от протеолиза и модификации полипептидной цепи под действием свободных радикалов, образующихся в ходе реакции [2]. HRP C содержит два структурных домена, простетическая группа-гем (комплекс трехвалентногожелеза с протопорфирином IX). Группа-гема присоединена к ферменту в His170 (проксимальный остаток гистидина) посредство координационной связи между атомом N боковой цепи гистидина и атомом железа гема. Второй участок аксиальной координации (так называемой дистальной стороной плоскости гема) не занят в состоянии покоя фермента, но доступен для присоединения перекиси водорода во время реакций восстановления-окисления [4]. В структуре белковой глобулы имеются два домена – дистальный и проксимальный. Каждый из них содержит сайт связывания кальция, в которых катионы кальция удерживаются семью координационными связями. Важная структурная роль Ca2+ подтверждена многочисленными экспериментальными данными и результатами компьютерного моделирования. Так как центры связывания катионов кальция соединены системой водородных связей с активным центром фермента, удаление Ca2+ влечёт за собой серьёзные изменения в свойствах фермента. Дистальный катион связан менее прочно, чем проксимальный. Его удаление приводит к падению каталитической активности приблизительно в 2 раза и снижению термостабильности фермента, а также стабильности при экстремальных значениях рН и при хранении. Третичная структура молекулы при удалении дистального Ca2+ претерпевает малые изменения. Полная потеря катионов кальция приводит к инактивация фермента вследствие серьезных конформационных изменений в активном центре [2]. Ион Fe3+ имеет 4 координационные связи внутри гема, пятое координационное положение занимает атом азота имидазольного кольца проксимального остатка His170. Шестое координационное положение в релаксированном состоянии фермента свободно, но в процессе катализа происходит присоединение пероксида водорода к атому железа, и комплекс становится шестикоординационным [2]. 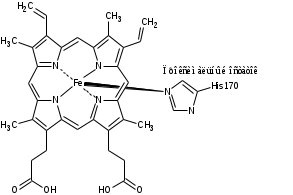 Рисунок1. Структура пероксидазы хрена 1.3. Свойства пероксидазы хренаОсобенностью процессов пероксидазного катализа является образование ряда спектрофотометрически различимых комплексов. Реакция пероксидазы представляет собой двухэлектронное окисление-восстановление с тремя различными стадиями. Упрощенная схема пероксидазного цикла выглядит следующим образом [5]: HRP + H2O2 Соединение I + H2O (1) Соединение I + AH2 Соединение II + AH• (2) Соединение II + AH2 HRP + AH• (3) Где AH2 – электрон-донорный субстрат, AH• – радикальный продукт реакции. 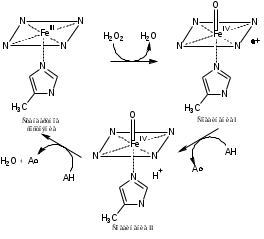 Рисунок 2. Цикл превращения пероксидазы хрена Каталитический цикл гем-пероксидазы, специфичной для растений, начинается с координации пероксида с трехвалентным гемом (рис. 2). На первой стадии координированный пероксид подвергается быстрому гетеролитическому расщеплению с образованием молекулы воды и полустабильного промежуточного продукта, называемого соединением I (π-катион-радикалом, оксиферрилпорфирина). Реакция включает перенос протона с последующим разрывом связи О-О. Один кислород уходит в виде молекулы воды, а другой уже координирован с гемом. Он завершает свой октат, извлекая два наиболее легкодоступных электрона из фермента. Один электрон удаляется из железа, создавая оксиферрильный центр (Fe=O). Как правило, в случае большинства пероксидаз второй электрон удаляется из порфиринового кольца, образуя π-катионный радикал порфирина. Этот радикал порфирина принимает один электрон от электронодонорного субстрата, образуя свободный радикал субстрата и соединение II (называемое оксиферрилгемовым промежуточным продуктом). В следующем стадия одноэлектронного восстановления вторая молекулы субстрата восстанавливает соединение II до пероксидазы железа в стандартное состояние [5]. 1.4. Инактивация пероксидазы хренаИнактивация пероксидазы в ходе катализа может произойти из-за избытка H2O2. Этот процесс в значительной степени подавляется в присутствии восстановительных донорных субстратов (например, фенолов), поскольку они конкурируют с H2O2 за активные ферментативные промежуточные звенья [6]. Пероксидаза, реагирующая с большим избытком перекиси водорода дает полосу поглощения при λ=940 нм, которая со временем затухает. Затем появляется максимум поглощения при λ=670 нм, обусловлено это неактивной формой пероксидазы, названной Р-670. Причем образованию продукта с максимумом поглощения при λ=670 нм предшествует образование нескольких промежуточных форм [7]. В отсутствие обычных доноров электронов в системе HRP/H2O2 происходит разложение перекиси водорода (каталазное направление реакции). Сначала в результате реакции нативного фермента с перекисью водорода образуется соединение I. Затем соединение I, будучи сильным окислителем, вынуждает перекись водорода реагировать в качестве донора электронов. Восстановление соединения I перекисью водорода может пройти через: Двух-электронный перенос с образованием O2; Одноэлектронный перенос, с образованием соединения II и супе-роксидного аниона. В результате реакции соединения II с перекисью водорода образуется соединение III. Соединение III является промежуточной формой, в которой фермент защищен от окислительного воздействия избытка перекиси водорода. Прямые кинетические исследования инактивации фермента с использованием в качестве окислителя 30 различных органических перекисей, а в качестве восстановителя АБТС показали, что инактивирующим агентом является субстрат-окислитель. В этом случае вместо перекиси водорода на соединениях I и II окисляется субстрат - восстановитель, а соединение III не образуется [8]. Общая схема пероксидазного катализа с учетом возможности необратимой инактивации, окисляющим и восстанавливающим субстратами, выглядит следующим образом: конкуренция между гидропероксидом и восстановителем за соединение I и соединение II. Этим объясняется влияние отношения начальных концентраций субстратов на инактивацию фермента. Центральную роль в инактивации фермента гидроперекисью играет комплекс соединение I - ROOH. От этого соединения ведут два пути: каталитический путь к нативному ферменту через соединение II и инактивационный путь к неактивному ферменту. Если в качестве окислителя выступает перекись водорода, возможен другой каталитический путь, включающий генерацию кислорода (каталазный путь). Конкуренция между ROOH и восстановителем на уровне соединения II определяет образование соединения III. Превращение пероксидазы в соединение III происходит при 500-кратном мольном избытке перекиси водорода [9]. Так же существуют и другие способы инактивации пероксидазы: Cорбция/окклюзия полимерными продуктами (т.е. HRP адсорбируется на осажденных продуктах соединения, и его активные центры закупориваются); Разрушение гема (т.е. сильные реагенты, образующиеся в ходе ферментативной реакции, такие как свободные радикалы, вступают в реакцию с гемовым центром в HRP и инактивируют его) [6]. 1.5. Методы выделения пероксидазы хренаИзвестен способ выделения пероксидазы из корней хрена, включающий гомогенизацию корней хрена, экстракцию фермента солевым раствором, осаждение фермента солями сульфата аммония, гельфильтрацию, спиртовое осаждение, электрофорез, переосаждение хлоридом аммония, фильтрацию через сефадекс G-50 и ДЭАЭ-целлюлозу, и диализ. Основными недостатками данного способа являются невысокая активность и чистота полученного продукта, а также сложность его получения и большое количество стадий технологического процесса [10]. Известен метод, по которому корни хрена проращивают в течение 2-3 суток, затем гомогенизируют и экстрагируют водой в течение суток. Водный экстракт центрифугируют с последующим фракционированием белков солями сульфата аммония, после чего сульфатаммонийный осадок фермента растворяют в дистиллированной воде и подвергают ультрафильтрации на фильтрах "Милипор". К полученному фильтрату прибавляют 0,5 М фосфатный буфер (рН 8) в соотношении 100 частей буфера на 1 часть фильтрата и пропускают через колонку с ионообменником ДЭАЭ-Сефадекс А-50, затем последовательно ультрафильтруют на "Милипор" и подвергают лиофильной сушке. Недостатком данного метода является недостаточно высокий выход пероксидазы, высокая трудоемкость и длительность процесса [10]. Известен метод выделения пероксидазы из корней хрена, по которому корни хрена гомогенизируют, затем экстрагируют фермент водой и осаждают пероксидазу солями сульфата аммония с последующей гельфильтрацией. Недостатком данного способа является низкий выход и низкая чистота фермента [10]. Известен также метод получения пероксидазы, включающий гомогенизацию растительной ткани хрена, экстракцию фермента, отделение экстракта с проведением осаждения фермента сульфатом аммония, очистку фермента концентрированием ультрафильтрацией и гельфильтрацией, последующую лиофилизацию целевого продукта, причем в качестве растительной ткани хрена используют отходы от зачистки корней при производстве пищевой продукции, перед ультрафильтрацией в экстракт вносят сульфит натрия в эффективном количестве, осаждают фермент сульфатом аммония из ультрафильтрата, а после гель-фильтрации фермент дополнительно очищают ионообменной хроматографией [10]. 1.6. Применение пероксидазы хрена1.6.1. Биосенсоры на основе пероксидазы хренаБиосенсоры с иммобилизованной пероксидазой хрена могут быть использованы в первую очередь для определения субстрата пероксидазы – пероксида водорода. Эта задача весьма актуальна: существует потребность в анализах биологических жидкостей и других растворов для определения пероксида водорода вследствие его ключевой роли в различных процессах, протекающих в человеческом организме и в окружающей среде [11]. Самый простой электрод для обнаружения H2O2 представляет собой монослой молекул HRP, адсорбированных на поверхности электрода. При подаче правильного потенциала на модифицированный HRP электрод, зарегистрированный ток восстановления будет пропорционален концентрации перекиси или других пероксидов. В комбинации с оксидазами, катализирующими реакции получения Н2О2, они детектируют субстраты оксидаз [12]. Пероксидаза катализирует окисление различных электродонорных субстратов по следующей схеме: HRP + H2O2 Соединение I + H2O (1) Соединение I + AH2 Соединение II + AH• (2) Соединение II + AH2 HRP + AH• (3) Где Соединение I и Соединение II являются окисленными промежуточными соединениями пероксидазы, АН2 и АН• являются электронодонорным субстратом и радикальным продуктом одноэлектронного окисления соответственно. Если фермент иммобилизован на электроде, то последний может выступать в качестве электронодонорного субстрата (АН2) в общем цикле пероксидазной реакции. Этот процесс рассматривается как прямой электронный перенос. Пероксидаза хрена окисляется пероксидом водорода в соответствии с реакцией (1), и затем последовательно восстанавливается электронами, которые обеспечивает электрод: Соединение I +2e̅ +2H+ → HRP + H2O (4) Пероксидазные биосенсоры, основанные на прямом электронном переносе, могут быть использованы для обнаружения пероксида водорода и небольших органических гидропероксидов. В соединении с оксидазами, производящими пероксид водорода, они также могут быть использованы для определения концентрации субстратов оксидаз, таких как глюкоза, спирты, глютамин, холин [13]. Первая реакция включает двухэлектронное окисление простетической группы пероксидазы перекисью. Эта биоэлектрокаталитическая реакция восстановления Н2О2 в отсутствие медиатора наблюдалась для ПХ, адсорбированной на угле и графите, золоте и платине. При этом константа скорости для (4) реакции, как правило, не превышала 1с-1 [12]. Это обуславливается тем, что активный центр пероксидазы расположен достаточно глубоко в гидрофобном кармане ее глобулы и расстояние для переноса электрона слишком велико и, гликозилированные остатки на поверхности пероксидазы могут действовать как изолятор и затруднять электронный перенос между активным центром этого фермента и электродом [11]. 1.6.2. Иммунобиосенсоры с пероксидазой хрена в качестве меткиПероксидаза применяется в качестве метки одного из биокомпонентов в биосенсорах, основанных на принципах иммунохимического распознавания. В этих биосенсорах осуществляется реакция антиген–антитело, что существенно улучшает специфичность распознавания определяемого вещества в образцах сложного состава, а использование фермента значительно повышает чувствительность метода. Благодаря относительно невысокой стоимости пероксидазы в сравнении с флуоресцентными или радиоактивными метками, биосенсоры с пероксидазой в качестве метки получили широкое распространение. Иммуносенсоры имеют преимущество при выполнении анализов, когда требуется высокая чувствительность определения. Это необходимо в медицинской практике для диагностики различных биологически активных соединений, для контроля качества продуктов питания, экологического контроля объектов окружающей среды на наличие остаточных количеств загрязнителей и токсикантов. Иммуносенсоры особенно перспективны для проведения медицинских исследований, так как они обеспечивают необходимую чувствительность и специфичность при анализе сложных по составу биологических жидкостей. Недостаточно широкое внедрение био- и иммуносенсоров в медицинскую практику связано с тем, что они не позволяют, как правило, определять несколько соединений одновременно [14]. 1.6.3. ДНК-сенсоры с пероксидазой хрена в качестве меткиРазработаны биосенсоры, основанные на использовании ДНК или олигонуклеотидов в качестве биораспознающих реагентов и пероксидазы хрена в качестве метки. В большинстве подобных систем применяются ДНК-зонды, содержащие биотинилированные нуклеотиды. При этом зонд, меченный биотином, гибридизуют с ДНК-мишенью, затем последовательно добавляют авидин или стрептавидин и биотинилированный фермент, в качестве которого может быть использована пероксидаза хрена. Альтернативой может служить конъюгат пероксидазы со стрептавидином, имеющим сайт связывания с биотином. Так же есть весьма перспективный ДНК-сенсорный метод, чувствительность которого к ДНК может быть повышена путем введения в процесс анализа дополнительных молекул метки – биотина. Как и в предыдущем методе, проводится гибридизация ДНК, меченной биотином, затем связывание биотина на поверхности с конъюгатом стрептавидин-пероксидаза. Метод усиления аналитического сигнала основан на способности пероксидазы окислять производные тирамина с образованием промежуточных высокоактивных радикальных частиц, которые затем могут ковалентно связываться с поверхностью белковой глобулы фермента в непосредственной близости от активного центра фермента – источника их образования. Радикальные частицы, иммобилизованные на поверхности вблизи фермента, могут быть также выявлены конъюгатом стрептавидин-пероксидаза. Таким образом, на поверхность вводятся дополнительные молекулы пероксидазы, что обеспечивает расширение диапазона аналитического сигнала [11]. 2. Экспериментальная часть2.1. Выделение пероксидазы хрена162 г. промытых корней хрена гомогенизируют при помощи блендера, терки или мясорубки, с сохранением соков и заливают 162 см3 фосфатного буферного раствора pH=7,6. Экстракцию ведут в течение часа. Экстракт отделают декантацией и выдерживают сутки в холодильнике. Потом фильтруют через марлю и затем через бумажный фильтр красная лента. Проводят высаливание при помощи (NH4)2SO4, 0-35% от объема, затем 35-70%. После каждого высаливание проводят центрифугирование 10000 об/10 мин, надосадочную жидкость сливают в колбу, а осадок растворяют буферным раствором в объеме 10 см3 и переносят в пробирку с пробкой. Для анализа используют осадок после 70% и 35% высаливания. Для концентрирования использовали концентрирующие фильтры 10 кДа. 2.2. Определение концентрации ферментаКоличественное определение содержания фермента проводили по методу Лоури. Перед определением смешивают 50 мл реактива А и 1 мл реактива В (раствор С), реактив Фолина разбавляют в 2 раза. Перед определением строят градуровочный график. Для построения градуировочного графика применяют стандартный раствор белка БСА с концентрацией 200 мкг/мл, готовят растворы белка с разной концентрацией, как показано в таблице. Таблица 1. Данные для приготовления градуировочных растворов
Одновременно ставят пробирку с пробой неизвестной концентрации. В каждую пробирку добавляют 5 мл реактива С, перемешивают. Через 10 минут добавляют 0,5 мл разведенного в 2 раза реактива Фолина тщательно перемешивают и помещают в термостат при 37ºС на 30 минут для развития окраски. Фотометрируют на фотометре при длине волны 700 нм. По результатам измерений строят градуировочный график с использованием компьютерных программ (Microsoft Exel или SigmaPlot) и определяют содержание белка в неизвестной пробе. 3. Результаты и их обсуждения3.1. Выделение и концентрирование пероксидазы хрена162 грамма промытых водой корней хрена гомогенизируют при помощи блендера, терки или мясорубки, с сохранением соков и заливают 162 см3 фосфатного буферного раствора pH=7,6. Экстракцию ведут в течение часа. Экстракт отделают декантацией и выдерживают сутки в холодильнике. Потом фильтруют через марлю и затем через бумажный фильтр. В результате декантации и фильтрации общий объем раствора получился 100 см3. Для осаждения выделенных белков полученный раствор подвергают ступенчатому высаливание при помощи (NH4)2SO4, 0-35% от объема, затем 35-70%. После каждого высаливание проводят центрифугирование 10000 об/10 мин, надосадочную жидкость сливают в колбу, а осадок растворяют буферным раствором в объеме 10 см3 и переносят в пробирку с пробкой. После 35% высаливания объем надосадочной жидкости составил 102 см3. После 70% высаливания объем надосадочной жидкости составил 98 см3. Для анализа используют осадок после 35% и 70% высаливания. Концентрирование фермента проводят на концентрирующих фильтрах 10 кДа, в фильтры заливают исследуемые образцы (растворенные осадки после 35% и 70% высаливания разбавленные в 2 раза) и центрифугируют при 5000 об/10 мин, после каждого центрифугирования раствор прошедшею через фильтр выливают, а к раствору, оставшемуся на фильтре приливают новую партию фермента до тех пор, пока раствор не перестанет проходить через фильтр. 3.2. Количественное определение белкаМетод Лоури основан на измерении интенсивности окраски раствора, в котором одновременно осуществляются, по меньшей мере, две цветные реакции на белок: биуретовая реакция и реакция Фолина с тирозиновыми и цистеиновыми радикалами белковой молекулы. Последняя состоит в восстановлении смеси фосфорно-вольфрамовой и фосфорно-молибденовой кислот с образованием комплексного соединения синего цвета. Полагают, что в реакциях восстановления принимают участие комплексные соединения меди, возникшие при взаимодействии белка с щелочным раствором медного купороса. Вторая реакция не очень специфична, но весьма чувствительна. Поэтому метод Лоури позволяет вести определения белков в сильно разбавленных растворах. Таблица 2. Данные для построения градуировочного графика
 y = 0,0039x+0,06 R2 = 0,9923 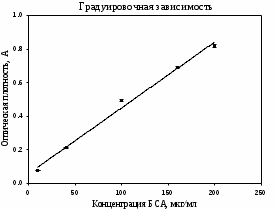 Рисунок 3. Градуировочный график по методу Лоури Полученная зависимость была обработана в координатах линейного уравнения: y = a∙x + y0 Таблица 3. Параметры уравнения для градуировочного графика
3.2.1. Количественное определение белка в растворенном осадке после высаливания 35% от насыщения сульфата аммонияТаблица 4. Данные измерения оптической плотности в растворенном осадке после высаливания 35% и его концентрация
0,186 = 0,0039x + 0,06; x = 32,31 мкг/мл 0,185 = 0,0039x + 0,06; x = 32,05 мкг/мл 0,184 = 0,0039x + 0,06; x = 31,79 мкг/мл Разбавление в 200 раз x = 32,1∙200 = 6420 мкг/мл; x = 6,42 мг/мл 3.2.2. Количественное определение белка в растворенном осадке после высаливания 70% от насыщения сульфата аммонияТаблица 5. Данные измерения оптической плотности в растворенном осадке после высаливания 70% и его концентрация
0,455 = 0,0039x + 0,06; x = 101,28мкг/мл 0,456 = 0,0039x + 0,06; x = 101,54 мкг/мл 0,463 = 0,0039x + 0,06; x = 103,3 мкг/мл Разбавление в 200 раз x = 102∙200 = 20400 мкг/мл; x = 20,04 мг/мл 3.2.3. Количественное определение белка после концентрирования в растворенном осадке после высаливания 35% отнасыщения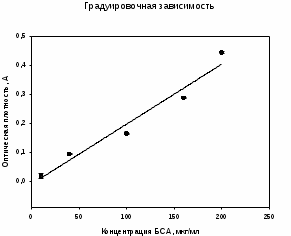 Таблица 6. Данные измерения оптической плотности в растворенном осадке после высаливания 35% и его концентрация Таблица 6. Параметры уравнения для градуировочного графика
Таблица 7. Данные измерения оптической плотности в растворенном осадке после высаливания 35% и его концентрация
0,138 = 0,002x - 0,01; x = 70,48 мкг/мл 0,140 = 0,002x - 0,01; x = 71,43 мкг/мл 0,137 = 0,002x - 0,01; x = 70,00 мкг/мл Разбавление в 200 раз x = 71∙200 = 14200 мкг/мл; x = 14,2 мг/мл 3.2.4. Количественное определение белка после концентрирования в растворенном осадке после высаливания 70% отнасыщенияТаблица 8. Данные измерения оптической плотности в растворенном осадке после высаливания 70% и его концентрация
0,470 = 0,0020x - 0,01; x = 228,57 мкг/мл 0,500 = 0,0020x - 0,01; x = 242,86 мкг/мл 0,500 = 0,0020x - 0,01; x = 242,86 мкг/мл Разбавление в 200 раз x = 238∙200 = 47600 мкг/мл; x = 47,6 мг/мл 3.3. Концентрирование ферментаКонцентрирование проводили на концентрирующих фильтрах 10 кДа, центрифугировали при 5000 об/мин. Концентрация фермента после концентрирования в фракции после 35% высаливания увеличилась примерно в 2,2 раза, а концентрация в фракции после 70% высаливания увеличилась примерно в 2,4 раза. ВыводыПровели ступенчатое разделение белков из гомогенизированных тканей корней Armoracia Rusticana. Получено 2 осажденых белковых фракции с суммарным содержанием 32,1±0,7 мкг/мл в высаливание 35% от насыщения сульфата аммония и 102±3 мкг/мл в высаливание 70% от насыщения сульфата аммония; Концентрирование проводили на фильтрах 10 кДа. Провели концентрирование фермента в 2 осажденных белковых фракциях с суммарным содержанием 71±2 мкг/мл в высаливание 35% от насыщения сульфата аммония и 238±21 мкг/мл в высаливание 70% от насыщения сульфата аммония; Список литературыBanci L. Structural properties of peroxidases //Journal of biotechnology. – 1997. – Т. 53. – №. 2-3. – С. 253-263. Захарова Г. С., Упоров И. В., Тишков В. И. Пероксидаза из корней хрена: модулирование свойств химической модификацией белковой глобулы и гемма //Успехи биологической химии. – 2011. – Т. 51. – С. 37-64. Wuhrer M. et al. New features of site-specific horseradish peroxidase (HRP) glycosylation uncovered by nano-LC-MS with repeated ion-isolation/fragmentation cycles //Biochimica et Biophysica Acta (BBA)-General Subjects. – 2005. – Т. 1723. – №. 1-3. – С. 229-239. Veitch N. C. Horseradish peroxidase: a modern view of a classic enzyme //Phytochemistry. – 2004. – Т. 65. – №. 3. – С. 249-259. Pandey V. P. et al. A comprehensive review on function and application of plant peroxidases //Biochem Anal Biochem. – 2017. – Т. 6. – №. 1. – С. 308. Mao L. et al. Horseradish peroxidase inactivation: heme destruction and influence of polyethylene glycol //Scientific Reports. – 2013. – Т. 3. – №. 1. – С. 1-7. Arnao M. B. et al. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent //Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology. – 1990. – Т. 1038. – №. 1. – С. 85-89. Amao, M. В.; Acosta, M.; Del Rio, J. A.; Garcia-Canovas, F. //Inactivation of Peroxidase by Hydrogen Peroxide and Its Protection by a Reductant Agent. Biochim. Biophys. Acta 1990,1038, pp: 85-89. Amao, M. В.; Acosta, M.; Del Rio, J. A.; Varon, R.; Garcia-Canovas, F. //A Kinetic Study on the Suicide Inactivation of Peroxidase by Peroxide. Biochim. Biophys. Acta 1990,1041, pp: 43-47. Полозников А. А. и др. Способ получения пероксидазы из корней хрена. – 2013. Преснова Г. В., Рубцова М. Ю., Егоров А. М. Электрохимические биосенсоры на основе пероксидазы хрена //Российский химический журнал. – 2008. – Т. 52. – №. 2. – С. 60-65. Ferapontova E. E. et al. Mediatorless biosensor for H2O2 based on recombinant forms of horseradish peroxidase directly adsorbed on polycrystalline gold //Biosensors and Bioelectronics. – 2001. – Т. 16. – №. 3. – С. 147-157. Ferri T., Poscia A., Santucci R. Direct electrochemistry of membrane-entrapped horseradish peroxidase.: Part II: Amperometric detection of hydrogen peroxide //Bioelectrochemistry and bioenergetics. – 1998. – Т. 45. – №. 2. – С. 221-226. Malhotra B. D., Chaubey A. Biosensors for clinical diagnostics industry //Sensors and Actuators B: Chemical. – 2003. – Т. 91. – №. 1-3. – С. 117-127. Полыгалина Г. В., Чередниченко В. С., Римарева Л. В. Определение активности ферментов. – 2003. |

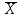
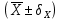 , мкг/мл
, мкг/мл