Неорганическая химия Улахович. P и температуре t где оэто нормальные условия параметры, характеризующие параметры газа при нормальных условиях. Объединённый газовый закон
 Скачать 1.12 Mb. Скачать 1.12 Mb.
|
|
1. (Объединённый газовый закон Бойля-Мариотта, Гей-Люссака и Шарля). Уравнение состояния идеальных газов (Клайперона-Менделеева) :pv=m(вещ.)RT/M(вещ.), R=8314 Дж/моль*К., р=101 кПа. 2. Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное спиновое число электронов данного подслоя должно быть максимальным.. 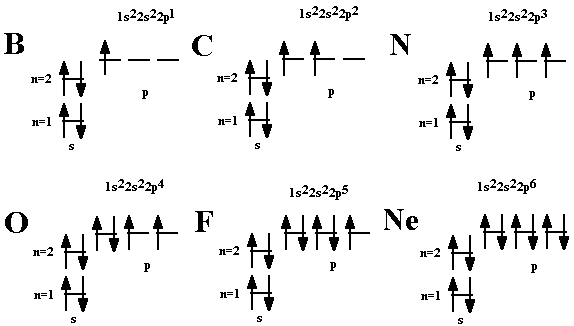 Пример: Р(15) 3s2 3p3, B 1s2 2s2 2p1,Ne 1s2 2s2 2p6 3.H—O—H ··· OH2, H—O—H ··· NH3, H—O—H ··· F—H, H—F ··· H—F. Пример внутримолекулярной водородной связи  Ортонитрифенол, паранитрофенол Межмолеклярной связи : этиловый спирт( С2Н5ОН) 4 .
Параметры системы: внутренняя энергия (U), энтальпия (Н), энтропия (S), энергия Гиббса (G). Энтальпия – тепло-содержащие системы Энтропия – меры беспорядка в системе, изм.внутр.энергии Дельта Н=Q(кол-во поглащ.теплоты)-А(соверш.работа) Дельта G=дельтаТ-Т дельта S 5. Регламентирует растворимость газов в различных растворителях. Усл.его выполнения : 1)справедлив для невысоких давлений; 2)отсутствуют химические взаимодействие между газом и растворителем. Масса г. раствор.при постоян.температуре в данном V жидкости, прямо пропорциональна парциональному давлению газа w В(массовая доля газа в насыщен.р-ре)=к умножить на р(парциональное давление) Генри закон, положение, согласно которому при постоянной температуре растворимость газа в данной жидкости (выраженная весовой концентрацией его) прямо пропорциональна давлению этого газа над раствором. Г. з. описан У. Генри в 1803; он хорошо соблюдается только для идеальных растворов, и применим лишь в области невысоких давлений, приобретая при этом характер предельного закона 6. Стандартный окислительно-восстановительный потенциалЕ равен потенциалу системы, в которой активность окисленной и восстановленной форм данного вещества равны единице. Они позволяют определить возможность или невозможность сосуществования тех или других веществ в данной среде.Он вычисляется по формуле Нернста: Пример : В зависимости от формы записи они относятся к значению рН = 0 (кислая среда), например: для pH = 0 HClO + H+ + 2 Чем выше положительное значение стандартного потенциала, тем более сильным окислителем является окисленная форма вещества, и чем меньше значение будет иметь стандартный потенциал, тем более сильным будет восстановленная сила вещества. 7. Распространённый вид координации лигандов — октаэдрическая, при которой шесть лигандов образуют октаэдр вокруг иона металла. При октаэдрическом окружении d-орбитали разделяются на две группы с разностью энергетических уровней Δокт (энергия расщепления), при этом энергия у орбиталей dxy, dxz и dyz будет ниже, чем у dz2 и dx2-y2, так как орбитали первой группы находится дальше от лигандов и испытывают меньшее отталкивание. Три орбитали с низкой энергией обозначаются как t2g, а две с высокой — как eg. Расщепление в кристаллическом октаэдрическом поле. -На расщепление влияют следующие факторы: -Природа иона металла. -Степень окисления металла. Чем выше степень окисления, тем выше энергия расщепления. -Расположение лигандов вокруг иона металла. -Природа лигандов, окружающих ион металла. Чем сильнее эффект от лигандов, тем больше разность между высоким и низким уровнем энергии. 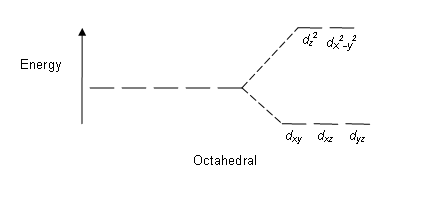 Спектрохимический ряд — полученный опытным путём список лигандов, упорядоченных в порядке возрастания Δ: I-< Br- < Cl- < F-< OH-< H2O < Py Лиганды располагают в порядке возрастания энергии перехода в ЭСП комплексов [CoX(NH3)5]2+: X = I, красно-фиолетовый цвет X = Cl, розовый цвет X = NH3, желтый цвет 8. Фо́сфор химический элемент 15-й группы 3-го периода периодической системы; имеет атомный номер 15.. Второй в 5 группе является неметаллом. Соединения в высшей степени наиболее устойчивые, связано с уменьшением потенциала ионизации. Наивысшая СО= +5. Соединения, содержащие фосфор в СО меньшей, чем +5 проявляют себя как восстановители. В то же время соединения фосфора +5 в растворах окислителями не являются. Кислородные соединения фосфора более устойчивы. Водородные менее стабильны. СО -3, +3 и +5 Фосфор легко окисляется кислородом: 4P + 5O2 → 2P2O5 (с избытком кислорода), 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода). Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства: с металлами — окислитель, образует фосфиды: 2P + 3Ca → Ca3P2, 2P + 3Mg → Mg3P2. фосфиды разлагаются водой и кислотами с образованием фосфина с неметаллами — восстановитель: 2P + 3S → P2S3, 2P + 3Cl2 → 2PCl3. Не взаимодействует с водородом. Взаимодействует с водой, при этом диспропорционирует: 8Р + 12Н2О = 5РН3 + 3Н3РО4 (фосфорная кислота). В растворах щелочей диспропорционирование происходит в большей степени: 4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2. Восстановительные свойства Сильные окислители превращают фосфор в фосфорную кислоту: 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO; 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O. Фосфи́ды — бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления..Они неустойчивые, разлагаются водой и разбавленными кислотами. При этом получается фосфин и, в случае гидролиза, — гидроксид металла, в случае взаимодействия с кислотами — соли. Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3 Ca3P2 + 6HCl → 3CaCl2 + 2PH3 При умеренном нагревании большинство фосфидов разлагаются. Плавятся под избыточным давлением паров фосфора. ОКСИДЫ. В качестве индивидуальных B-B установлены: P4O, P4O2 (P2O), P4O6 (P2O3), P4O8, P4O10 (P2O5), PO3; молекулы изображенных в скобках фосфора оксидов существуют в виде димеров. Фо́сфорные кисло́ты — соединения фосфора в степени окисления +5, имеющие общую формулу P2O5•nH2O. При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3. При разбавлении её водой образуется ортофосфорная кислота H3PO4: При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота. Кислоты фосфора: ортофосфорная кислота H3PO4, метафосфорная кислота HPO3, пирофосфорная кислота H4P2O7. 9.Марганец – серебристо-белый металл 7 побочной подгруппы. Состаяние окисления – Mn 0 MnO +2 MnO2 +4 K2MnO4 +6 KMnO4 +7 Оксиды MnO, MnO2, Mn2O3, Mn2O7 Гидроксиды Мn(OH)2, Мn(OH)3, Мn(OH)4, (H2MnO4) MnSO4 + KClO3 + KOH K2MnO4 + KCl + K2SO4 + H2O ( получение из Мn +2 Мn +6) MnSO4 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + PbSO4 + H2O ( получение из Мn +2 Мn +7) Влияние рН на восстановление: Mn +2 +4Н2ОMnO4 - + 8Н + +5е--- рН<7 кислая среда. MnO2, + 2Н2ОMnO4 + + 4Н ----+3е--- рН=7 нейтральная MnO4 - 2MnO4 - +1е--- рН>7 щелочная среда Марганец. Характерные степени окисления марганца: +2, +3, +4, +6, +7 (+1, +5 мало характерны). Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер, MnO(OH)2 — амфотерный. Перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца (II), в нейтральной — до соединений марганца (IV), в сильно щелочной — до соединений марганца (VI). Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3. 10. Соединения Fe (II) Fe (OH)2 гидроксид железа(П) FeS сульфид железа FeCl2 хлорид железа FeSO3 сульфит железа FeSO4 сульфат железа 1) FeSO4 + (NH4)2S = FeS↓ + (NH4)2SO4 2) (NH4)2S + Fe(NO3)2 = NH4NO3 + FeS => 3) (NH4)2S + Fe(NO3)2 = 2 NH4NO3 + FeS 11. Се́ра — элемент 16-й группы, 3 периода ПС химических элементов, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S . Степени окисления: +6, +4, +2, 0, -1, −2 Оксиды серы 1. При обычных условиях SO2 - газ, SO3 - твёрдое вещество. 2. Проявляют свойства кислотных оксидов, взаимодействуя с водой: SO2 + H2OH2SO3 SO3 + H2O = H2SO4 щелочами: SO2 + 2NaOH = Na2SO4 + H2O SO3 + 2NaOH = Na2SO4 + H2O основными оксидами: SO3 + CaO = CaSO4 Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). Окси́дсе́ры (VI) (се́рныйангидри́д, трео́кисьсе́ры, се́рныйга́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. При нагревании сера взаимодействует со многими металлами, часто — весьма бурно. Иногда смесь металла с серой загорается при поджигании. При этом взаимодействии образуются сульфиды: 2Na + S = Na2S Ca + S = CaS При нагревании сера также реагирует с фосфором, образуя смесь сульфидов фосфора[7], среди которых — высший сульфид P2S5: 5S + 2P = P2S5 Сульфид аммония. Он образован слабой кислотой и слабым основанием, значит, гидролиз будет протекать и по катиону и по аниону. Уравнение гидролиза сульфида аммония в молекулярной форме: (NH4)2S + HOH→ Разложим на ионы: 2NH4+ + S2- + HOH → А теперь протон водорода будет соединяться с сульфид – анионом, а гидроксид ион – с катионом аммония: 2NH4+ + S2- + HOH → NH4OH + HS- Полная реакция гидролиза сульфидов в молекулярной форме: (NH4)2S + HOH→NH4OH + NH4HS Так как сероводород – многоосновная кислота, поэтому гидролиз сульфидов будет протекать по второй ступени: HS- + HOH → H2S + OH- NH4HS + HOH → H2S + NH4OH В среднем считается реакция среды данного гидролиза нейтральной. 12. Окраска комплексных соединений зависит от типа лигандов и комплексообразователя. Из-за расщепления энергии d-орбиталей появляется возможность перехода электронов с подуровней dxy, dzy, dxz на вакантные подуровни с более высокой энергией dz2,dz2-y2 под действием поглощаемых квантов света. Эти явления можно наблюдать с помощью электронной спектроскопии. В зависимости от разности расщепленных уровней комплексы поглощают кванты света определенных диапазонов длин волн, поэтому имеют соответствующую окраску. 13. .2KMnO4+2FeSO4+3H2SO4 2MnSO4 +Fe2(SO4)3+K2SO4+3H2O 14. Изотонический раствор–концентрация осмотического давления внутриклеточной среды. Он является плазмой крови. Как правило, по своему составу и концентрации изотонические растворы близки к морской воде. В кровезамещающие изотонические растворы для создания коллоидно-осмотического давления вводят высокомолекулярные соединения (декстран, поливинол и др.). гипотонический раствор-раствор, осмотическое давление которого ниже нормального осмотического давления плазмы крови. Гипертонический раствор – концентрация и осмотическое давление выше, чем у содержимого клетки. Тургор или внутриклетное давление — вызывается осмотическими процессами между омывающим растительную клетку почвенным раствором или водой и клеточным соком, заключающим разнообразные осмотически сильные вещества, как напр. соли органических и неорганических кислот и различные сахара Физиологи́ческий раство́р, физраствор — раствор, осмотическое давление которого равно осмотическому давлению крови. Существует несколько типов физиологических растворов, состав которых зависит от целей, для которых они применяются. Наиболее часто применяемыми физиологическими растворами являются раствор Рингера — Локка, раствор Рингера — Тироде, раствор Кребса — Рингера. Простейший физиологический раствор — 0,9 % водный раствор хлорида натрия. Гемолиз – возможный разрыв мембраны клетки. 15. О направлении ОВР можно судить по изменению энергии Гиббса ∆G. Если ∆G < 0 – реакция возможна, если ∆G > 0 - невозможна. Из термодинамики известно, что ∆G = -n•F•E; E = φок-ля -φв-ля или φок-ля > φв-ля, что возможно при Е > 0 и ∆G < 0. О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных. |
