|
|
Неорганическая химия Улахович. P и температуре t где оэто нормальные условия параметры, характеризующие параметры газа при нормальных условиях. Объединённый газовый закон
62•
Дентатность. Число занимаемых лигандом координационных мест центрального атома (или атомов), называется дентатностью. Лиганды, занимающие одно координационное место, называются монодентатными (например, NH3), два — бидентатными (оксалат-анион [O-C(=O)-C(=O)-O]2−). Лиганды, способные занять большее количество мест, обычно обозначают как полидентатные. Например, этилендиаминтетрауксусная кислота (EDTA), способная занять шесть координационных мест. Кроме дентатности, существует характеристика, отражающая количество атомов лиганда, связанных с одним координационным местом центрального атома.
имеет номенклатурное обозначение η (греческая буква эта) (то есть, являющийся монодентатным) и связанный через все пять атомов углерода: η5-[C5H5]−.
63• Получение SiO2 + 2Mg=2MgO + Si
Кремний с галогенами образует обширную группу соединений. Га-логениды кремния можно рассматривать как производные силанов с полным или частичным замещением на галоген атомов водорода. Они отличаются значительно большей термической и окислительно-восстановительной устойчивостью, чем соответствующие силаны. Наибольший практический интерес представляют галогениды с общей формулой SiF4 — производные моносилана. В газообразном состоянии галогенид SiF4 состоит из мономерных тетраэдрических молекул. Общим способом получения тетрагалогенидов является взаимодействие кремния с галогенами: Si-f2r2=Sir4.
Фтор реагирует с кремнием при обычной температуре, хлор, бром н йод — при нагревании.
C кислородом Si + O2 = SiO2 (реакция горения)
Кремний взаимодействует только со смесью плавиковой и азотной кислот: 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O.
Взаимодействие со щелочами. Si + 2NaOH + H2O = Na2SiO3 + H2
66. Главное квантовое число характеризует энергию электрона в атоме. Оно принимает положительные целочисленные значения от 1 до бесконечно больших чисел:
n = 1, 2, 3, … ,∞.
Наименьшей энергией электрон обладает при n= 1; с увеличением n энергия электрона возрастает. Поэтому состояние электрона, характеризующееся определенным значением главного квантового числа, принято называть энергетическим уровнем электрона в атоме: при n=1 электрон находится на первом энергетическом уровне, при n=2 – на втором и т.д. Увеличение значения n ведет к повышению энергии электрона, достигая в пределе нулевого значения. При этом электрон оказывается бесконечно далеко удаленным от ядра и не испытывает к нему какого либо притяжения. Поэтому, чем меньше значение n, тем отрицательнее энергия электрона, тем более он связан, т.е. испытывает притяжение к ядру, находится в устойчивом состоянии связи с ядром.
67. Комплексному соединению состава ML4 отвечает тип гибридизации sp3, sd3 (пространственное строение тетраэдр) и dsp2 (пространственное строение плоскийквадрат).


68. Внутренняя энергия системы – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как её полную энергию за вычетом кинетической и потенциальной энергии системы как целого. Внутренняя энергия U как функция состояния вводится первым началом термодинамики, согласно которому разность между теплотой Q, переданной системе, и работой W, совершаемой системой, зависит только от начального и конечного состояний системы и не зависит от пути перехода, т.е. представляет изменение фуникции состояния ΔU
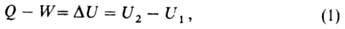 где U1 и U2 - внутренняя энергия системы в начальном и конечном состояниях соответственно где U1 и U2 - внутренняя энергия системы в начальном и конечном состояниях соответственно
Кинетическая энергия - это энергия движения частиц скалярная и всегда положительная величина. Называется скалярная величина Т, равная арифметической сумме кинетических энергий всех точек системы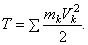
Потенциальная - энергия взаимодействия частиц., можно определить силу по известной потенциальной энергии взаимодействия:
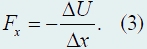
69 зависимость скорости химической реакции от температуры выражается правилом вант-гоффа. Большинство практически важных реакций ускоряются при нагревании. правило Вант-Гоффа : скорость многих реакций при повышении температуры на 10 о,скорость большинства хим.реакц увеличивается в 2-4 раза. формулой Вант-Гоффа:
V2=V1 Y (T2-T1)/10
V1-скорость реакции при Т1
V2-скорость реакц при Т2
γ – коэффициент Вант-Гоффа (= 2-4), Т – температура в градусах по шкале Цельсия или Кельвина
Катализ-это ве-ва,которые увеличивают скорост реакции(за счет участия),но сами не входят в состав продуктов:1)гомогенный катализ(катализатор и и участвующие в реакции ве-ва, т.е реагенты находяться в одной фазе)2)гетерогенный катализ(катализаторы и реагенты, в разных фазах) 3)ферментативные катализаторы-биокатализаторы белковых структур.
70. Истинные растворы охватывают две категории дисперсных систем: молекулярно-дисперсные и ионно-дисперсные системы. В первых размер частиц меньше 1 нм.
Сюда относятся растворы электролитов (например, натрия хлорида, магния сульфата). Растворенное вещество находится в виде отдельных гидратированных ионов и молекул в некоторых равновесных количествах. Истинные растворы гомогенны даже при рассматривании их в ультрамикроскопе и их компоненты не могут быть разделены ни фильтрованием, ни каким-либо другим способом. Истинные растворы хорошо диффундируют.
Энергетика растворения
Процесс растворения твердого вещества в воде сопровождается разрушением кристаллической решетки (затрата энергии в форме теплоты, -Qкр) и гидратацией - образованием гидратов B · nH2O, то есть соединений переменного состава между частицами растворенного вещества и молекулами воды (выделение теплоты, +Qгидр).
В результате общий тепловой эффект растворения равен
Q(р) = -Qкр + Qгидр
Если тепловой эффект растворения положительный (Q(р) больше 0), то после растворения вещества раствор становится теплее (например, это происходит в случае приготовления раствора AlCl3), если же тепловой эффект отрицательный (Q(р) меньше 0), то раствор становится холоднее (иногда температура может опуститься ниже 0 °С, например для NaNO3 или NH4NO3).
В тех редких случаях, когда Q(р) = 0, температура раствора остается постоянной (например, для NaCl).
Переход в раствор жидких и газообразных веществ также сопровождается гидратацией их молекул и положительным тепловым эффектом. Поэтому в соответствии с принципом Ле-Шателье повышение температуры ведет к уменьшению растворимости газов в воде.
71. Стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту
В стандартных условиях вышеприведенное уравнение выглядит следующим образом:
- ΔG* = nFφ*,
Где ΔG* - стандартная энергия Гиббса, φ* - стандартный электрондый потенциал.
Значения стандартного электродного потенциала растворенных веществ относят к растворам с концентрацией 1 моль/л, а для газообразных веществ — к 101325 Па. В качестве стандартной принимают температуру 25° С. Стандартной считается система из положительного иона водорода и электрона, которая также называется водородным электродом. У этой системы стандартная энергия Гиббса нулевая и стандартный электродный потенциал тоже нулевой.
Водородный электрод представляет собой платиновую пластинку, покрытую, тонким слоем рыхлой пористой платины (для увеличения поверхности электрода) и опущенную в водный раствор серной кислоты (с активностью ионов Н+ равной единице). Через раствор серной кислоты пропускают водород под атмосферным давлением. Часть поглощенного платиной водорода переходит в атомное состояние, в поверхностном слое пластины и на границе платины и раствора устанавливается равновесие ионов водорода и электронов.
72. Энергия стабилизации кристаллическим полем (ЭСКП) — энергия электронной конфигурации иона переходного металла относительно средней энергии орбиталей. Стабилизация возникает вследствие того, что в поле лигандов энергетический уровень некоторых орбиталей ниже, чем в гипотетическом сферическом поле, в котором на все пять d-орбиталей действует одинаковая сила отталкивания, и все d-орбитали вырождены. Например, в октаэдрическом случае уровень t2g ниже, чем средний уровень в сферическом поле. Следовательно, если в данных орбиталях находятся электроны, то ион металла более стабилен в поле лигандов относительно сферического поля. Наоборот, энергетический уровень орбиталей eg выше среднего, и электроны, находящиеся в них, уменьшают стабилизацию. продолжение. Лиганды, вызывающее большое расщепление d-уровней, например CN− и CO, называются лигандами сильного поля. В комплексах с такими лигандами электронам невыгодно занимать орбитали с высокой энергией. Следовательно, орбитали с низкой энергией полностью заполняются до того, как начинается заполнение орбиталей с высокой энергией. Такие комплексы называются низкоспиновыми. Например, NO2− — лиганд сильного поля, создающий большое расщепление. Все 5 d-электронов октаэдрического иона [Fe(NO2)6]3− будут располагаться на нижнем уровне t2g.
Распределение d-электронов высокоспинового комплекса [FeBr6]3−
Напротив, лиганды, вызывающие малое расщепление, например I− и Br−, называются лигандами слабого поля. В этом случае легче поместить электроны в орбитали с высокой энергией, чем расположить два электрона в одной орбитали с низкой энергией, потому что два электрона в одной орбитали отталкивают друг друга, и затраты энергии на размещение второго электрона в орбитали выше, чем Δ. Таким образом, прежде чем появятся парные электроны, в каждую из пяти d-орбиталей должно быть помещёно по одному электрону в соответствии с правилом Хунда. Такие комплексы называются высокоспиновыми. Например, Br− — лиганд слабого поля, вызывающий малое расщепление. Все 5 d-орбиталей иона [FeBr6]3−, у которого тоже 5 d-электронов, будут заняты одним электроном.
73 Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны
можно получить:


Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
Степени окисления азота в соединениях −3, −2, −1, +1, +2, +3, +4, +5.
−3 нитридами,
−2 пернитридами,
−1 NH2OH (гидроксиламин)
+1оксид азота(I) N2O
+2оксид азота(II) NO
+3оксид азота(III) N2O3
+4оксид азота(IV) NO2
+5 оксид азота(V) N2O5,
Азотистая кислота — ангидрид N2О3, гидрат NOOH. N2O5 — ангидрид азотной кислоты.
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония ; известны соли фосфония ; известны соли фосфония или гидроксония или гидроксония ) и анионов кислотного остатка. ) и анионов кислотного остатка.
Средние (нормальные) соли :  , , 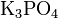 . .
Кислые соли : 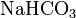 , ,  . .
Осно́вные соли —: 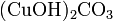 . .
Двойные соли — . .
Смешанные соли — . .
Гидратные соли (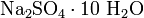 . .
Комплексные соли —: 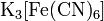 , ,  . .
74. Одним из основных понятий в химии было и остается понятие степени окисления (степень окисления, состояние окисления, окислительное состояние)..
Многие элементы способны проявлять не одну, а несколько различных степеней окисления. Например, для хлора известны все степени окисления от −1 до +7, хотя четные очень неустойчивы, а для марганца — от +2 до +7. Высшие значения степени окисления изменяются в зависимости от порядкового номера элемента периодически, но эта периодичность имеет сложный характер. В простейшем случае в ряду элементов от щелочного металла до благородного газа высшая степень окисления возрастает от +1 (RbF) до +8 (XeО4). В других случаях высшая степень окисления благородного газа оказывается меньше (Kr+4F4), чем для предшествующего галогена (Br+7О4−). Поэтому на кривой периодической зависимости высшей, степени окисления от порядкового номера элемента максимумы приходятся или на благородный газ, или на предшествующий ему галоген (минимумы — всегда на щелочной металл). Исключение составляет ряд Li—Ne, в котором ни для галогена (F), ни для благородного газа (Ne) вообще неизвестны высокие степени окисления, а наибольшим значением высшей степени окисления обладает средний член ряда — азот; поэтому в ряду Li—Ne изменение высшей степени окисления оказывается проходящим через максимум. В общем случае возрастание высшей степени окисления в ряду элементов от щелочного металла до галогена или до благородного газа происходит отнюдь не монотонно, главным образом по причине проявления высоких степеней окисления переходными металлами. Например, возрастание высшей степени окисления в ряду Rb—Xe от +1 до +8 «осложняется» тем, что для молибдена, технеция и рутения известны такие высокие степени окисления, как +6 (MoО3), +7 (Tc2О7), +8 (RuO4).
75. Выведено французским физиком Клапейроном и носящим его имя:
PV или PV = PоVо
----- = const ----- -----
T T Tо
Из последнего уравнения можно рассчитать значение Vо(объем газа при н.у.), если измерен объем газа некоторых других условиях:
V0 = pVT0
p0T
Соотношение между параметрами идеального газа (давлением P, объемом V, количеством вещества n, термодинамической температурой T) описывает уравнение Клапейрона-Менделеева:
PV = nRT
Уравнение Клапейрона-Менделеева устанавливает связь между давлением, объемом и температурой любой порции газа со свойствами идеальной модели, поэтому называется уравнение состояния идеального газа.
Уравнение состояния идеального газа, позволяет проводить расчеты параметров реальных газов при физических условиях, приближающихся к нормальным условиям.
76 . Для 3 и последующих периодов (S, Cl) характерны «необычные» электронные конфигурации. Для элементов третьего и последующих периодов возможные ковалентности могут быть выше, чем для элементов 2 периода. Для внешних электронных оболочек атомов 3-го и последующих периодов, существуют внешние d- подоболочки.
Например, для атома серы, возможны следующие электронные конфигурации.
Основное состояние атома серы
3d -----
3p^4 ---
3s^2 -
Первое возбужденное состояние
3d^1 -----
3p^3 ---
3s^2 -
Второе возбужденное состояние
3d^2 -----
3p^3 ---
3s^1 -
Из данных электронных конфигураций следует, что ковалентности серы могут находиться в пределах от 2-х до 6 и более.
Наличие вакантных d-АО на валентной электронной оболочке атома серы увеличивается число возможных валентных состояний и расширяет набор возможных ковалентностей. Этим можно объяснить существование соединений, в которых сера проявляет ковалентность, равную четырем(SO2, SCl 4) или шести(SF6).
Рассмотренный пример показывает, что атомы обладают разнообразными возможностями для образования ковалентных связей.
77. σ-Связь ,это такая связь, которая образуеться при перекрывании (валентных)орбиталей вдоль линии соединяющие центры взаимодействующих атомов.
π- связь такая связь,которая образуется ри боковм перекрывании р и d орбитали.
пример,в молекуле азота между атомами реализуется тройная связь: одна сигма, и 2п связи.

78. Энтальпия системы – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением:
H = U + PV где V – объем системы.
В химии чаще всего рассматривают изобарические процессы, и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса: ΔH = ΔU + PΔV
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Тепловой эффект химического процесса – это изменение энтальпии, произошедшее при осуществлении этого процесса, отнесенное к одному молю вещества или одному молю эквивалента вещества.
Тепловые эффекты химических реакций указывают в виде изменения энтальпии системы.
Первый закон термохимии утверждает:
Если при образовании, какого либо соединения выделяется (или поглощается) некоторое количество теплоты, то при разложении этого соединения в тех же условиях такое же количество теплоты поглощается (или выделяется).
Изменение энтальпии при образовании одного моля сложного вещества из простых называется энтальпией (теплотой) образования данного соединения.
Важное следствие закона Гесса:
Тепловой эффект хим.реакции равен сумме энтальпии образования получающихся веществ за вычетом суммы энтальпии образования получающихся веществ за вычетом суммы энтальпии образования исходных веществ.
|
|
|
 Скачать 1.12 Mb.
Скачать 1.12 Mb.


