Дневник Сылап 1.. Педагогическая практика дневник учебный год 2022 2023, курс 4 Ширгелдиев Сылап
 Скачать 98.87 Kb. Скачать 98.87 Kb.
|
|
Часть 1. Предельные и непредельные углеводороды: этилен, ацетилен Опыт № 1. Получение этилена и его химические свойства Реактивы: песок; этанол; серная кислота (конц) Оборудование и посуда: пробирки; пипетки; газоотводная трубка; спиртовка; пробиркодержатели; спички. Методика: в сухую пробирку помещают две стеклянные лопатки сухого песка, наливают 1 мл этанола и осторожно 2 мл концентрированной серной кислоты, закрывают пробкой с газоотводной трубкой. Так же, как в опыте 1, изучают взаимодействие этилена с растворами бромной воды и перманганата калия (реакция Вагнера). Выделяющийся этилен моментально обесцвечивает бромную воду, а фиолетовый раствор перманганата калия почти мгновенно исчезает и появляется бурый осадок оксида марганца (IV). 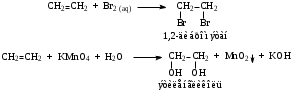 После всех реакций газоотводную трубку переворачивают вверх и поджигают этилен. Он горит светящимся желтоватым пламенем. При внесении в пламя фарфоровой чашки на ней образуется черное пятно. Это объясняется неполным окислением этилена при горении на воздухе, вследствие бóльшего процентного содержания углерода в молекуле: 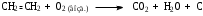 Опыт № 2. Получение ацетилена и изучение его свойств Реактивы: CaC2; вода Оборудование и посуда: пробирка; газоотводная трубка; бромная вода; перманганат калия. Методика: в пробирку помещают небольшой кусочек карбида кальция CaC2 и приливают 1 мл воды. Пробирку закрывают пробкой с газоотводной трубкой и выделяющийся ацетилен пропускают через заранее приготовленные растворы: бромной воды, перманганата калия. 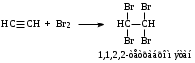 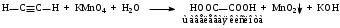 Терминальные ацетиленовые углеводороды способны обменивать свои кислые протоны на металлы с образованием солей – желтовато-серого осадка ацетиленида серебра и окрашивание в красный цвет раствора с дальнейшим выпадением красно-бурого осадка ацетиленида меди (I). HC≡CH + [Ag(NH3)2]OH  Ag–C≡C–Ag↓ + NH3 + H2O Ag–C≡C–Ag↓ + NH3 + H2OHC≡CH + [Cu(NH3)2]Cl  Cu–C≡C–Cu↓ + NH4Cl+ NH3 Cu–C≡C–Cu↓ + NH4Cl+ NH3Остатки ацетеленида серебра утилизируют в 10 %-ной соляной кислоте. Ag–C≡C–Ag + HCl  HC≡CH↑ + AgCl↓ HC≡CH↑ + AgCl↓Так же, как и в предыдущих опытах, изучают горение ацетилена на воздухе. Он горит коптящим пламенем: 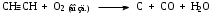 Опыт № 3. Горение алканов Реактивы: гептан; гексан Оборудование и реактивы: фарфоровые чашки, лучина, огнезащитная прокладка, спички, пипетки. Методика: в фарфоровую чашку наливают 1 мл гептана и поджигают его. Почему в отличие от метана гептан горит коптящим пламенем? Часть 2. Ароматические углеводороды Опыт № 4-5. Окисление гомологов бензола Реактивы: бензол; толуол, перманганат, серная кислота, щелочь, вода Оборудование и посуда: пробирки; пипетки Методика: в две пробирки наливают по 0,5 мл толуола и п-ксилола. В каждую пробирку добавляют равное количество раствора перманганата калия, подкисленного каплей раствора серной кислоты. Содержимое пробирок встряхивают в течение 1–2 мин. 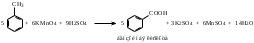 Подпись ___________ ______________ ФИО Схема конспекта урока № 3 (Школа Юного химика) Конспект урока, данного студентом Ширгелдиев Сылап Сахымырадович Студент 4-го курса ПОХБ Факультет химии, биологии и биотехнологии Школа: «Школа Юного химика» СОГУ Города Владикавказа По предмету химия Дата: 01.03.23 Тема урока: «Спирты и фенолы. Альдегиды и кетоны» Цель урока: освежить теоретические знания о кислородсодержащих соединениях и закрепить их: лабораторные опыты. а) образовательная: обеспечить усвоение учащимися понятий, связанных с химическими свойствами спиртов, фенолов, альдегидов и кетонов. Обобщить и систематизировать полученные знания; б) воспитательная: по средствам командной работы обеспечить условия для формирования чувства коллективизма и гуманизма. Выработать умение оперировать полученными знаниями на практике. в) развивающая: формирование интереса к предмету «химия», а также умения самостоятельной работы. Поддержание развития способности анализировать и высказывать суждения относительно тех или иных утверждений, сказанных на уроке преподавателем или иным учеником. Тип урока: комбинированный Методы обучения: словесные (лекция, объяснение); наглядные (демонстрация презентационного материала; проведение опытов); практические (наблюдение и эксперимент). Технология обучения: информационно-коммуникативная; технология критического мышления; педагогика сотрудничества Технические средства обучения: компьютер; проектор; учебные фильмы; оборудование для проведения опытов Распределение времени на уроке было рациональным и включает 2 академических часа. Ход урока (излагается в соответствии с типом, структурой, содержанием и т.д.) Организационный этап; актуализация знаний; постановка цели и задач урока; первичное усвоение новых знаний с первичной проверкой; первичное закрепление; контроль усвоения; обсуждение допущенных ошибок и их коррекция; информация о домашнем задании и рефлексия. Домашнее задание: рационально распределено и присылается в установленное время на электронную почту студента практиканта. ЛАБОРАТОРНАЯ РАБОТА № 3. СПИРТЫ Опыт № 1. Сравнение растворимости спиртов в воде Реактивы: краситель; дистиллированная вода; этиловый спирт (C2H5OH); пропиловый спирт (C3H7OH); бутиловый спирт (С4H9OH) и изоамиловый спирт (C5H11OH). Оборудование и посуда: пипетки; пробирки Методика: в четыре пробирки налейте по 3 мл воды, подкрашенной перманганатом калия, и добавьте в них по 1 мл этилового, пропилового, бутилового и изоамилового спиртов. Пробирки встряхните и дайте отстояться. Опыт № 2. Обнаружение воды в спирте и обезвоживание спирта Реактивы: безводный сульфат меди; этиловый спирт (C2H5OH). Оборудование и посуда: пипетки; пробирки; ложка Методика: в сухую пробирку поместите немного порошка безводного сульфата меди и добавьте 2 мл этилового спирта. Пробирку встряхните и слегка нагрейте над пламенем спиртовки. Почему изменяется цвет сульфата меди? Полученный абсолютный этиловый спирт перелейте в сухую пробирку и используйте для получения алкоголята натрия (опыт 3). Опыт № 3. Образование и гидролиз алкоголята натрия Реактивы: этиловый спирт (C2H5OH); металлический натрий; фенолфталеин Оборудование и посуда: пипетки; пробирки; стакан с холодной водой; лучина Методика: в обезвоженный этиловый спирт, полученный в предыдущем опыте, погрузите кусочек металлического натрия размером с горошину (очищенного от оксидного слоя и отжатого от керосина). Осторожно, берите натрий только пинцетом! Для предотвращения разогревания смеси и закипания спирта пробирку охладите в стакане с холодной водой. Когда начнет выделяться газ, к отверстию пробирки поднесите горящую спичку. Выделяющийся газ образует с воздухом смесь, вспыхивающую с характерным резким звуком. После полного растворения натрия концентрированный раствор алкоголята при охлаждении кристаллизуется. В ту же пробирку добавьте 2 мл воды и 1-2 капли фенолфталеина. Объясните, почему появляется окраска с фенолфталеином. Какие свойства спиртов (кислотные, основные) проявляются в реакции с металлическим натрием? Опыт № 4. Окисление спиртов Реактивы: этиловый спирт (C2H5OH); окись меди (CuO). Оборудование и посуда: пипетки; пробирки; спиртовка; медная проволока Методика: в сухую пробирку поместите 1-2 мл этилового спирта. Спираль из медной проволоки нагрейте в пламени горелки до появления черного налета окиси меди. Горячую спираль опустите в пробирку с этиловым спиртом. Спирт бурно вскипает, появляется характерный запах уксусного альдегида (запах зеленых яблок), а медная спираль становится розовой вследствие восстановления окиси меди. Опыт № 5. Окисление спиртов Реактивы: пропанол-2; дихромат калия; перманганат калия; дистиллированная вода; серная кислота концентрированная Оборудование и посуда: пипетки; пробирки Методика: в смесь, состоящую из 6 капель концентрированной серной кислоты и 3- х капель изоамилового спирта, внесите 0,5 г измельченного дихромата калия K2Cr2O7 (или перманганат калия). Встряхните смесь, поставьте пробирку в штатив и добавьте 0,5 мл воды (осторожно! Смесь сильно разогревается). Цвет раствора меняется из оранжевого в зеленый, одновременно ощущается сладковатый запах изовалерианового альдегида. Далее появляется неприятный запах изовалериановой кислоты (запах испорченного сыра). Объясните результаты опытов. Приведите уравнения реакций окисления этилового и изоамилового спирта. Опыт № 6. Взаимодействие глицерина c натрием (демонстрационный) Реактивы: натрий (металл); глицерин Оборудование и посуда: спиртовка; пробиркодержатель; спички; лучина Методика: в пробирку внести 5-10 мл глицерина и добавить небольшой кусочек натрия. Провести нагревание (осторожно). Наблюдать за изменениями. Выделяющийся газ поджечь. Опыт № 7. Окисление глицерина в присутствии перманганата калия (демонстрационный) Реактивы: перманганат калия (сух); глицерин Оборудование и посуда: фарфоровая чаша; пипетка Методика: внести в фарфоровую чашку несколько грамм перманганата калия и добавить несколько капель глицерина. Отойти и наблюдать за происходящим. Опыт № 8. Взаимодействие глицерина с гидроксидом меди Реактивы: гидроксид натрия; сульфат меди; глицерин Оборудование и посуда: пипетки; пробирки Методика: налейте в пробирку 2 мл 10%-ного раствора гидроксида натрия и 0,5 мл раствора сульфата меди. К образовавшемуся студенистому осадку голубого цвета добавьте 0,5 мл глицерина и встряхните. ФЕНОЛЫ Опыт № 1. Растворимость и кислотный характер фенолов Реактивы: фенол; лакмус Оборудование и посуда: спиртовка; пробиркодержатель; пробирки Методика: 0,5 г фенола внести в пробирку и добавить 5 мл воды, встряхнуть. Охладить и добавить несколько капель лакмуса. Опыт № 2. Бромирование фенолов Реактивы: бромная вода; фенол Оборудование и посуда: пробирка; пипетки Методика: к 1 мл фенола добавляют по палям бромную воду. Образуется осадок бело-желтого цвета. Опыт № 3. Взаимодействие фенолов с хлоридом железа (III) Реактивы: фенол; хлорид железа (III) Оборудование и посуда: пробирка; пипетки Методика: к 1 мл водного раствора фенола добавьте 1 мл растворахлорида железа (III). Раствор окрашивается в фиолетовый цвет. АЛЬДЕГИДЫ И КЕТОНЫ Опыт № 1. Реакция альдегидов и кетонов с гидроксидом диамминсеребра (I) Реактивы: нитрат серебра; аммиак; формалин; ацетон Оборудование и посуда: пробирки; пипетки; спиртовка; пробиркодержатель Методика: в две пробирки добавить аммиак и раствор нитрата серебра и внести несколько капель формальдегида (1) и ацетона (2). Нагреть содержимое и проследить за протеканием реакции. Опыт № 2. Окисление альдегида гидроксидом меди (II) Реактивы: гидроксид натрия; соль меди; формалин; ацетон Оборудование и посуда: пробирки; пипетки; спиртовка; пробиркодержатель Методика: в две пробирки добавить свежеприготовленный раствор Cu(OH)2 и внести несколько капель формальдегида (1) и ацетона (2). Нагреть содержимое и проследить за протеканием реакции. Схема конспекта урока № 4 (Школа Юного химика) Конспект урока, данного студентом Ширгелдиев Сылап Сахымырадович Студент 4-го курса ПОХБ Факультет химии, биологии и биотехнологии Школа: «Школа Юного химика» СОГУ Города Владикавказа По предмету химия Дата: 15.03.23 Тема урока: «Карбоновые кислоты, сложные эфиры, жира и мыла» Цель урока: разобрать химические свойства 2-ой части кислородсодержащих органических соединений и получить практические навыки работы в лаборатории с карбоновыми кислотами, эфирами, жирами и мылами. а) образовательная: обеспечить усвоение учащимися понятий, связанных с химическими свойствами карбоновых кислот, эфиров, жиров и мыла. Обобщить и систематизировать полученные знания; б) воспитательная: по средствам командной работы обеспечить условия для формирования чувства коллективизма и гуманизма. Выработать умение оперировать полученными знаниями на практике. в) развивающая: формирование интереса к предмету «химия», а также умения самостоятельной работы. Поддержание развития способности анализировать и высказывать суждения относительно тех или иных утверждений, сказанных на уроке преподавателем или иным учеником. Тип урока: комбинированный Методы обучения: словесные (лекция, объяснение); наглядные (демонстрация презентационного материала; проведение опытов); практические (наблюдение и эксперимент). Технология обучения: информационно-коммуникативная; технология критического мышления; педагогика сотрудничества Технические средства обучения: компьютер; проектор; учебные фильмы; оборудование для проведения опытов Распределение времени на уроке было рациональным и включает 2 академических часа. Ход урока (излагается в соответствии с типом, структурой, содержанием и т.д.) Организационный этап; актуализация знаний; постановка цели и задач урока; первичное усвоение новых знаний с первичной проверкой; первичное закрепление; контроль усвоения; обсуждение допущенных ошибок и их коррекция; информация о домашнем задании и рефлексия. Домашнее задание: не задано. ЛАБОРАТОРНАЯ РАБОТА № 4 Реактивы, посуда и оборудование
|
