|
|
Практическая работа. Урок по химии _Практическая работа _Получение этилена и изучение. Практическая работа 8 Получение этилена и изучение его свойств. Цели и задачи урока Образовательные
Тема урока: Практическая работа №8
«Получение этилена и изучение его свойств».
Цели и задачи урока:
Образовательные: экспериментально повторить получение и химические свойства алкенов на примере этилена;
Развивающие: развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности, умение предъявлять результаты групповой деятельности.
Воспитательные: способствовать воспитанию у учащихся активной жизненной позиции.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Оборудование: ИКТ
Ход урока:
Организационный момент.
Проверка знаний: Проверочная работа по темам «Получение и химические свойства Алкенов»
.
Основная часть.
Практическая работа №8 №Получение этилена и изучение его свойств»
Название опыта
|
Ход работы
|
наблюдения
|
Уравнения реакции и выводы
|
Получение этилена
|
В пробирку помещаем 2 мл конц. серной кислоты, 1 мл этилового спирта и несколько крупинок оксида алюминия (Аl2O3)
Закрываем пробирку пробкой с газоотводной трубкой и нагреваем пробирку в пламени горелки.

|
Выделяется газ
|
H2SO4 (конц)
C H3 – CH2 – OH CH2 = CH2 + H2O H3 – CH2 – OH CH2 = CH2 + H2O
этанол этен
Вывод: Концентрированная серная кислота забирает воду из молекулы спирта и в результате образуется этилен.
Этен в лаборатории можно получить
1) дегидратацией спиртов (см. выше),
2) дегидрогалогенированием галогенэтана спиртовым раствором щелочи
спирт
CH3–CH2Br + KOH CH2 = CH2 +H2O+KBr
3) дегидрогалогенированием дигалогенэтана
BrCH2–CH2Br + Mg CH2 = CH2 +MgBr2
Этен в промышленности получают:
крекингом бутана
крекинг
CH3–CH2–CH2–CH3 CH2=CH2 + CH3 - CH3
бутан этен этан
2) дегидрированием этана
CH3 – CH3 CH2 = CH2 + H2
этан этен
|
Изучение свойств этилена
|
Выделяющийся газ пропускаем в отдельные пробирки с бромной водой и раствором перманганата калия, подкисленным серной кислотой.
Подожгем газ у конца газоотводной трубки
|
бромная вода и раствор перманганата калия быстро обесцвечиваются
Этен горит светящимся пламенем
|
Обесцвечивание бромной воды и раствора перманганата калия доказывает наличие в этене двойной связи:
CH2 = CH2 +Br2 BrCH2–CH2Br
этен 1,2-дибромэтан
Происходит окисление этилена бромной водой по двойной связи.
5С2Н4 + 12KMnO4 + 18H2SO4 = 12MnSO4 + 6K2SO4 + 10CO2↑ + 28H2O
Раствор KMnO4 обесцвечивается.
Этен горит ярким светящимся пламенем, это отличает его от этана, который горит несветящимся пламенем
С2Н4 + 3О2 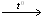 2СО2 + 2Н2О 2СО2 + 2Н2О
|
Д/з: § повторить, задачи 5,6 из карточки
Практическая работа №8 «Получение этилена и изучение его свойств»
Название опыта
|
Ход работы
|
наблюдения
|
Уравнения реакции и выводы
|
Получение этилена
|
В пробирку помещаем 2 мл конц. серной кислоты, 1 мл этилового спирта и несколько крупинок оксида алюминия (Аl2O3)
Закрываем пробирку пробкой с газоотводной трубкой и нагреваем пробирку в пламени горелки.

|
Выделяется газ
|
|
Изучение свойств этилена
|
Выделяющийся газ пропускаем в отдельные пробирки с бромной водой и раствором перманганата калия, подкисленным серной кислотой.
Подожгем газ у конца газоотводной трубки
|
бромная вода и раствор перманганата калия быстро обесцвечиваются
Этен горит светящимся пламенем
|
| |
|
|
 Скачать 50.82 Kb.
Скачать 50.82 Kb.

 H3 – CH2 – OH CH2 = CH2 + H2O
H3 – CH2 – OH CH2 = CH2 + H2O