Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
21 вопросПроцессы дегидрирования - первый этап тканевого дыхания, характеристика НАД- и ФАД-зависимых дегидрогеназ. Структурная организация дыхательной цепи. Особенности структуры компонентов ЦПЭ, редокс-потенциалы, последовательность реакций. Хемиосмотический механизм сопряжения окисления с фосфорилированием. Строение АТФ-синтазы и синтез АТФ. Дыхательный контроль. Стехиометрический коэффициент окислительного фосфорилирования Р/О и его изменения в норме и патологии. Ингибиторы и разобщители тканевого дыхания. Терморегуляторная функция тканевого дыхания. Особенности дыхания бурой жировой ткани и значение для детей младшего возраста. Гипоэнергетические состояния. Дыхательная цепь является частью процесса окислительного фосфорилирования . Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической. Большая часть выделяющейся при этом энергии используется для создания градиента протонов и, наконец, для образования АТФ с помощью АТФ-синтазы. Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с.Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу. Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переноситэлектроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и другихсубстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин , При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основнойанион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом. Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H+, т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза позволяет осуществить обратное движениепротонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ . АТФ-синтаза-группа ферментов, относящихся к классу гидролаз, синтезирующихаденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганических фосфатов. АТФ-синтаза состоит из двух частей: встроенного в мембрану протонного канала (F0) из по меньшей мере 13 субъединиц и каталитической субъединицы (F1), выступающей в матрикс. «Головка» каталитической части образована тремя α- и тремя β-субъединицами, между которыми расположены три активных центра. "Ствол" структуры образуют полипептиды F0-части и γ-, δ- и ε-субъединиц головки. Энергию для синтеза АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например из просвета хлоропласта в егострому, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова: АДФ + Фн → АТФ + H2O Дхат.контроль. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2 возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. ингибиторы. В результате прекращается движение электронов, выкачивание ионов Н+ и работа АТФ-синтазы. Синтез АТФ отсутствует и клетка погибает. Выделяют три основных группы ингибиторов: действующие на I комплекс, амитал, на III комплекс антимицин А, на IV комплекс сероводород(H2S). На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. У новорождённых, существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. 22 вопрос Роль процессов свободно-радикального окисления в нормальной жизнедеятельности организма человека. Первичные и вторичные радикалы. Активные формы кислорода (супероксидный ион-радикал·О2-, Н2О2 , гидроксильный радикал OH·,синглетный кислород 1О2), гипогалоидный ион OCl-, оксид азота (II): пути образования, биологическая роль. Дыхательная цепь митохондрий - основной источник АФК. Активация процессов свободнорадикального окисления представляет собой важный фактор поражения мозгового вещества в условиях острой и хронической ишемии. Изучение процессов свободнорадикального окисления (СРО) в организме человека имеет важное значение для понимания их роли в нормальной жизнедеятельности и в развитии патологических состояний. В настоящее время не вызывает сомнений, что СРО участвует в развитии ряда заболеваний человека в качестве ключевого звена патогенеза, а в остальных случаях может существенно отягощать течение любой патологии. Не случайно усиление СРО биологически значимых молекул рассматривается как неспецифический патологический процесс, сопровождающий любое заболевание. Важно заметить, что вредным является не простое повышение уровня СРО, а нарушение некоего определенного (физиологического) баланса между интенсивностью СРО и функциональной активностью антиоксидантной системы (АОС) организма. Выяснение реальной взаимосвязи этого дисбаланса с развитием патологических изменений является достаточно трудным в силу сложности процессов СРО и многокомпонентности АОС. В ходе своих исследований мы пытаемся нащупать методологические подходы, которые позволили бы создать доступный комплекс анализов, достаточный для оценки указанной взаимосвязи. Природные радикалы делят на первичные и вторичные. К числу первичных радикалов относят супероксид (•ОО-), нитроксид (•NO), убихинон (•Q) - переносчик электронов в дыхательной цепи. Из первичного радикала - супероксида - в процессе его метаболических превращений могут образовываться активные молекулярные соединения: перекись водорода, гипохлорит, гидроперекиси липидов Взаимодействие первичных радикалов, а также различных веществ с металлами переменной валентности (прежде всего Fe2+) приводит к образованию вторичных радикалов - гидроксила (•ОН) и липидных радикалов (L•,LOO•), обладающих выраженным деструктивным действием на клеточные структуры. Молекула кислорода (О2) содержит два неспаренных электрона и. таким образом, является бирадикалом. Однако неспаренные электроны расположены так, что молекула О2 остается относительно стабильной. Тем не менее, еслимолекула присоединяет дополнительный электрон (стадия а), образуется высоко реакционноспособныйсупероксид-радикал (•О2-) Следующая стадия восстановления (стадия б) приводит к пероксид-аниону (•О22-), который легко связывает протоны и вследствие этого переходит в пероксид водорода (Н2О2). Присоединение третьего электрона (стадия в) ведет к расщеплению молекулы на ионы О2- и О- . В то время как О2- путем присоединения двух протонов образует воду, протонирование О- приводит к особо опасному гидроксил-радикалу(•ОН). Присоединение четвертого электрона и заключительное протонирование О- заканчивается образованиемводы. АФК повреждают белки и ДНК и, главное, вызывают перекисное окисление липидов - самоподдерживающийся процесс, ведущий к тяжелому повреждению мембран. Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток. Кофермент Q в ЦПЭ принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона. 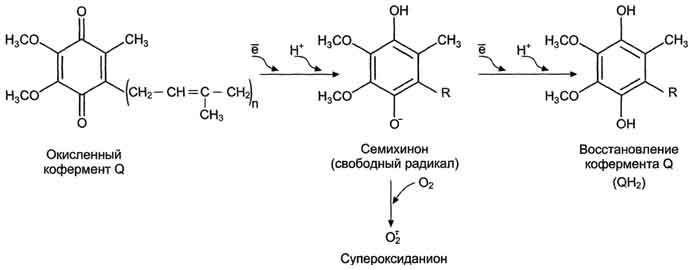 Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион 23 вопрос Перекисное окисление липидов (ПОЛ), механизм. Понятие о карбонилировании белков. Окислительный стресс, понятие. Антиоксидантные ферменты: каталаза, супероксиддисмутаза, глутатионпероксидаза, глутатионредуктаза, особенности строения, катализируемые реакции. Роль витаминов А, Е, С, β-каротина, убихинона, глутатиона, церулоплазмина, системы ферритин-трансферин в антиоксидантной защите. Особенности ПОЛ и антиоксидантной системы у новорожденных. ПОЛ играет огромную роль в клетки патологии. ПОЛ представляет собой радикальные цепные реакции, т.е каждый образовавшийся радикал инициирует образование других. Р-ция протекает в несколько стадий (инициирование цепи, развитие, разрушение, обрыв цепи). 1) Инициация-обр-ние свободного радикала. Он вступает в хим р-цию с полененасыщ жирными к-ми, входящими в состав биол мембран. При этом образуются липидные радикалы. 2) Развитие:радикалы вступаят в р-цию с растворенным в среде молекулярным О2, при этом образуется новый свободный радикал липоперекиси. Он атакует одну из соседних молекул фосфолипидов с образованием гидроперикиси липида и новым радикалом, чередование 2 последних реакций представляет собой цепную реакцию. ПОЛ ускоряется в присутствии небольшого кол-ва 2х валентного железа, в этом случае происходит разветвление цепей в рез-те взаймодействия железа с гидроперекисью липидов. В биол мембранах цепи могут состоять из 10 и больших звеньев.3) разрушение структуры липидов: конечные продукты окисления-малоновый диальдегид и гидропероксид полиеновой к-ты. 4)обрыв цепи – взаим-е радикалов между собой. Цепь обрывается в рез-те взаимодействии свобод.радикалов с антиоксидантами, ионами Ме с переменной валентностью или друг с др. Следствие ПОЛ: а) образуется белковые агрегаты хрусталика глаза = помутнение б) иноктивация Са-АТФ-синтетаза-> Замедлению Са из Кл и в Кл -> увел концентр Са -> повреждение Кл в) продукты ПОЛ непосредственно увелич проницаемость липидного слоя для Н и Са -> не синтезир АТФ-> уменьшение стабильности липидного слоя Антиоксиданты водной фазы: 1. СОД(защищает организм человека от постоянно образующихся высокотоксичных кислородных радикалов. СОД катализирует дисмутацию супероксида в кислород и пероксид водорода). 2. каталаза (фермент, который разлагает образующуюся в процессе биологического окисления перекись водорода на воду и молекулярный кислород (2H2O2 → 2H2O + O2) 3. глутатионпироксидаза ( катализируют восстановление перекисей липидов в соответствующие спирты и восстановление пероксида водорода до воды). 4. глутатионредуктраза (фермент класса оксидоредуктаз, катализирующий восстановление окисленного глутатиона) 5. витамин А,Е, С, РР, β-каротина-(вторичная антиоксидантная защита) называют "тушителями". Они "тушат" агрессивные радикалы, забирают избыток энергии, тормозят развитие цепной реакции образования новых радикалов. Глутатион переводит продукты перекисного окисления липидов в менее вредные и оберегает витамин Е. Коэнзим Q (убихинон)-Это вещество содержится в мембранах митохондрий — органелл, которые обеспечивают «поставки» энергии в клетках. Убихинон нейтрализует фенольные и перекисные радикалы, а также «страхует» витамин E в защите от перекисного окисления мембран: вначале реакции прерывает витамин E, а когда он заканчивается, его роль берет на себя убихинон. 6. Антиоксидантные белки (церулоплазмин, альбумин, ферритин, трансферрин, лактоферрин и др.), участвующие в хранении, транспорте или обезвреживании ионов металлов переменной валентности. 7. церуллоплазмин(Это медьсодержащий белок. Механизм его действия аналогичен механизму действия супероксиддисмутазы, однако он проявляет свою активность в межклеточной жидкости, а не в клетках. Церулоплазмин нейтрализует активные формы кислорода, которые вырабатываются иммунными клетками. Он окисляет Fe2+до Fe3+кислородом без образования свободных радикалов). 8. система ферритин-трансферин –участвует в защите (инактивации) свободных радикалов, катализируют продукцию супероксидов в клетках за счет железа, находящегося в составе этих соединений. Антиоксиданты липидной фазы. Цепные реакции липидной фазы ведут свбодные радикалы L* и LOO* разветвленных цепей, происходит при ваимодействии гидропироксидных липидов с Fe2+ ,следовательно все соединения, снижая концентрацию перечисленных вещ-в, выполняют функцию антиоксидантов: фосфолипаза, глутотионпироксидаза, ловушки радикалов-"липидными антиоксидантами», витамины Е и К, холестерин. Активация ПОЛ: · Повреждение липидного бислоя мембран, в результате чего в клетки проникает вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. · Преждевременное старение клеток и организма в целом. · Взаимодействие высокореактивных продуктов ПОЛ с аминогруппами белков с образованием Шиффовых оснований. · Изменение текучести (вязкости) мембран, в результате чего нарушается транспортная функция мембран (функционирование ионных каналов). · Нарушение активности мембраносвязанных ферментов, рецепторов. Особенности антиоксидантной системы у новорожденных. Повреждающий эффект процессов СРО проявляется лишь при интенсивном образовании активных форм кислорода и нарушении состояния антиоксидантной системы . В связи с этим считается, что новорожденные особенно предрасположены к токсическому воздействию активных форм кислорода вследствие того, что плод развивается в условиях относительной гипоксии. Билирубин -природный антиоксидант новорожденных. Карбонилирование белков представляет собой необратимое окислительное повреждение, часто приводящее к потере их функции. Аккумуляция КБ наблюдается при старении организма, а также играет роль в этиологии и/или прогрессировании некоторых заболеваний человека: сердечно-сосудистых, нейродегенеративных, диабета и др. Такие процессы в клетке как карбонилирование белков снижает их чувствительность к разрушению протеосомами, устраняющими поврежденные молекулы белков. Защита белков от карбонилирования делает метаболизм кожи более регулируемым, сохраняет ее эластичность, повышает способность к регенерации тканей, ускоряет заживление ран. Карнозин способен задерживать старение фибробластов, препятствовать карбонилированию белков и усиливать удаление поврежденных белков. Окислительный стресс — процесс повреждения клетки в результате окисления. 24 вопрос Строение пуриновых и пиримидиновых нуклеотидов. Структурная организация молекулы ДНК: первичная, вторичная, третичная, четвертичная структуры. Генетический код, его свойства. Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин (А), гуанин (G) и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). Строение ДНК. Первичная стр-ра ДНК – порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинуклеотидной цепи. Каждая фосфатная группа в полинукл-ой цепи за искл-ем фосфорного остатка на 5-конце мол участвует в обр-ии 2 эфирных связей с уч-ем 3- и 5- углеродных атомов 2 соседних дезоксирибоз, поэтму связь м-у мономерами обозначают 3,5-фосфодиэфирной. Вторичная стр-ра ДНК. 1953-Дж. Уотсон и Ф. Крик-модель пространств-ой стр-ры ДНК: мол ДНК имеет ф спирали, обр-ую 2 полинукл-ми цепями, закруч-ми относит-но др др и вокруг общей оси. Спираль правозакрюченная, полинукл-ые цепи в ней явл-ся антипаралл-ми => на каждом из концов мол ДНК расположена 5-конец одной цепи и 3-конец др цепи. Все основания цепей ДНК расп-ны внутри двойной спирали, а пентофосфатный остов-снаружи. Полинукл-ые цепи удерж-ся относит-но др др за счет водородных связей м-у комплимент-ми пуриновыми и пиримидиновыми азот-ми основаниями А и Т (2) и м-у Г и Ц (3). Правило Чаргаффа: число пуриновых оснований (А+Г)=числу пиримидиновых осн (Т+Ц). Комплемент-ые осн. уложены в стопку в сердцевине спирали. М-у осн-ми 2цепочной мол в стопке возникают гидрофобные взаи-ия, стабилизирующие двойную спираль. Третичная стр-ра ДНК. Каждая мол ДНК упакована в отд хромосому. В диплоидных Кл чел-ка содер-ся 46 хр. Все связ-ся с ДНК эукариотов можно раздел на 2 гр: гистоновые, негистоновые. Комплекс б с ядерной ДНК наз-ют хроматином. Гистоны - белки с молекулярной массой 11-21 кД, содержащие много остатков аргинина и лизина. Благодаря положительному заряду гистоны образуют ионные связи с отрицательно заряженными фосфатными группами, расположенными на внешней стороне двойной спирали ДНК. Существует 5 типов гистонов. Четыре гистона Н2А, Н2В, НЗ и Н4 образуют октамерный белковый комплекс (Н2А, Н2В, НЗ, Н4)2, который называют "нуклеосомный кор". Четвертичная структура — способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.(напр.гемоглобин) Генетический код и его свойства способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. Генетический код позволяет шифровать аминокислоты, входя щие в состав белков, с помощью определённой последовательности нуклеотидов в ДНК и мРНК. Для него характерны определённые свойства: Триплетность. значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон). Специфичность. Каждому кодону соответствует только одна аминокислота. Вырожденность. В мРНК и ДНК имеет смысл 61 триплет, каж дый из которых кодирует включение в белок одной из 20 аминокислот. Линейность. В ходе трансляции кодоны мРНК «читают ся» с фиксированной стартовой точки последо вательно и не перекрываются. В записи инфор мации отсутствуют сигналы, указывающие на конец одного кодона и начало следующего. Универсальность. код универсален, т.е. смысл кодовых слов одинаков для всех изученных организмов. 25 вопрос Структурная организация молекулы РНК: первичная, вторичная, третичная структуры. Типы РНК, их характеристика, биологическая роль, локализация в клетке. Рибонуклеиновые кислоты [PHK(RNA)] представляют собой полимеры из нуклеозидфосфатных звеньев, соединенных фосфодиэфирной связью (см. с. 86). В качестве азотистых оснований в РНК присутствуют урацил, цитозин, аденин итимин. В РНК можно также встретить множество необычных и модифицированных азотистых оснований. А. Рибонуклеиновые кислоты РНК принимают участие во всех стадиях процесса генной экспрессии и биосинтеза белка (см. с. 234). Свойства наиболее важных видов РНК приведены в таблице. Кроме того, здесь схематически показаны вторичные структурымолекул РНК. В отличие от ДНК, РНК не образуют двойных спиралей, но содержат короткие участки со спаренными основаниями(см. с. 90). Это приводит к образованию субструктур, которые при двумерном изображении напоминают «шпильки» и петли, образующие фигуру типа «кленового листа». В таких структурах двухцепочечные участки соединены петлями. Множество фрагментов, в которых чередуются структуры типа шпилька—петля, содержится в высокомолекулярныхРНК, таких, например, как рибосомная 16S-рРНК (16S-rRNA) (в центре). Кроме того, эти фрагменты образуют трехмерные структуры; следовательно, РНК подобно белкам имеют четвертичную структуру. До настоящего времени установлена четвертичная структура небольших PHK, прежде всего тРНК (tRNA). Из иллюстраций, приведенных на схеме Б и на с. 93 очевидно, что трехмерная укладка структуры типа «кленовый лист» окончательно не установлена. PHK клетки существенно различаются по размерам, строению и продолжительности существования. Преобладающую часть представляют рибосомные РНК [рРНК (rRNA)], которые в различных формах составляют структурный и функциональные части рибосом (см. с. 246). Рибосомные РНК синтезируются в ядре в процессетранскрипции на ДНК, там же подвергаются процессингу и ассоциируют с рибосомными белками, образуя рибосому (см. сс. 210, 240). Приведенная на схеме А бактериальная 16S-рРНК, включающая 1542 нуклеотида, является компонентом малой рибосомной субчастицы, в то время как небольшая 5S-рРНК (из 120 нуклеотидов) входит в состав большой субчастицы. Матричная РНК [мРНК (mRNA)] переносит генетическую информацию из клеточного ядра в цитоплазму. Ее транскрипты также сильно модифицируются в ядре (созревание мPHK, см. с. 242) Так как мРНК считывается нарибосоме кодон за кодоном она не должна складываться в стабильную третичную структуру. Спариванию основанийпрепятствуют белки, ассоциированные с мРНК. Из-за различного объема информации, которую могут нести мРНК,РНК этого типа сильно варьируют по размерам. Для мРНК характерно короткое время жизни, так как они быстро распадаются после трансляции. В сплайсинге предшественников мРНК (см. с. 242) принимают участие малые ядерные РНК [мяРНК (snRNA, от англ. small nuclear RNA)]. Они ассоциированы c рядом белков, образуя «сплайсомы». Б. Транспортные РНК ( tRNAPhe ) Транспортные РНК [тРНК (tRNA)] участвуют в процессе трансляции в качестве промежуточного связующего звена между нуклеиновыми кислотами и белками. Это небольшие молекулы РНК из 70-90 нуклеотидов, которые с помощью своих антикодонов "узнают" за счет спаривания оснований определенные кодоны на мРНК. На 3'-конце (ССА-3') они несут ту аминокислоту, которая согласно генетическому коду соответствует очередному кодону мРНК (см. c. 244). Последовательность оснований и третичная структура фенилаланинспецифичной тРНК (tRNAPhe) из дрожжей являются типичными для всех тРНК. В молекуле этой тРНК (см. также с. 93) содержится довольно много минорных и модифицированных оснований (1, выделены темно-зеленым цветом). К ним относятся псевдоуридин (ψ), дигидроуридин (D), тимидин (T), встречающийся обычно в ДНК, а также множество метилированных нуклеотидов, таких, например, как 7-метилгуанидин (m7G) и входящий в состав антикодона 2'-О-метилгуанидин (m2G).Конформацию молекулы стабилизируют многочисленные пары оснований, часть из которых не соответствуют общим принципам спаривания оснований (2) (неканонические пары). Под первичной структурой нуклеиновых кислот понимают порядок, последовательность расположения мононуклеотидов в полинуклеотидной цепи ДНК и РНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями. Поскольку молекулярная масса нуклеиновых кислот колеблется в широких пределах (от 2•104 до 1010–1011), установить первичную структуру всех известных РНК и особенно ДНК весьма сложно. Тем не менее во всехнуклеиновых кислотах (точнее, в одноцепочечной нуклеиновой кислоте) имеется один и тот же тип связи – 3',5'-фосфодиэфирная связь между соседними нуклеотидами. Эту общую основу структуры можно представить следующим образом:  Установлено, что в образовании межнуклеотидной связи участвуют гидроксильные группы в 3'- и 5'-положениях остатков углевода. К настоящему времени удалось определить первичную структуру почти всех тРНК, ряда молекул 5S рРНК, 16S рРНКE.coli, вирусных РНК, в состав которых входят сотни и тысячи нуклеотидных остатков. Ниже приводится примерная схема последовательности нуклеотидов в молекуле РНК. Все клеточные РНК в основном состоят из одноцепочечной по-линуклеотидной цепи: 5'-Г–У–Г–Ц–А–А–...–У–Ц–Г–Ц–Ц–А–3' Полинуклеотидная цепь молекулы РНК имеет на одном конце почти всегда свободный монофосфорный эфир, который принято обозначать как 5'-конец; на противоположном конце цепи такой фосфат отсутствует, а содержитсянуклеотид со свободными 2'- и 3'-гидроксильными группами. Если подвергнуть щелочному гидролизу молекулу РНК, то в качестве концевого нуклеотида будут обнаружены ЦМФ со свободным фосфатом у 5'-конца и свободныйаденозин в виде свободного нуклеозида у 3'-конца полинуклеотидной цепи. В выяснении первичной структуры РНК решающую роль сыграли методы ступенчатого гидролиза, осуществленного в основном экзонуклеа-зами и заключающегося в последовательном отщеплении по одному мононуклеотиду с одного конца молекулы нуклеиновой кислоты. первичная структура первой РНК, имеющей 77нуклеотидов, для которой была расшифрована нуклеотидная последовательность в 1965 г. Р. Холли и сотр., а именно аланиновой тРНК Следует особо указать на две существенные особенности первичной структуры всех тРНК. Первая из них заключается в том, что 5'-концом всегда является гуаниловая (редко цитидиловая) кислота, несущая свободный остаток фосфата у С-5'. Вторая особенность – наличие на противоположном конце молекулы остатков трех мононуклеотидов с одинаковой последовательностью – ЦЦА, причем остаток адениловой кислоты содержит свободную 3'-ОН-группу. Между этими структурами в строго определенной последовательности располагаются все остальные нуклеотидные остатки, среди которых на долю минорных нуклеотидов приходится до 10%. Полинуклеотидная цепь разных типовтРНК содержит около 75 нуклеотидов. Матричные (информационные) РНК относятся к наиболее гетерогенному классу нуклеиновых кислот, отличающихся по массе (см. табл. 3.1), структуре, размерам, стабильности и функциям. Основной функцией мРНК является перенос информации от ДНК (точнее, от гена) на белоксинте-зирующую систему клетки. мРНК выполняет рольматрицы и, следовательно, определяет первичную структуру синтезируемого белка (подробнее см. главу 14). мРНКнаделены рядом особенностей первичной структуры; в частности, на 5'-конце все они содержат определенную последовательность рибонуклеотидов, получившую название шапочки (кэп). Первым нуклеотидом является 7-метилгуанозинтрифосфат, который присоединяется к 5'-гидроксилу соседнего мононуклеотида, представленного 2'-О-метилпуриновым нуклеотидом. На другом 3'-конце большинства (но не всех) мРНК содержится полиадениловая последовательность (поли-А), насчитывающая от 150 до 200 нуклеотидов Менее охарактеризована вторичная структура матричных и рибосомных РНК. Относительно вторичной структурытРНК наиболее вероятной представляется модель, предложенная Р. Холли, плоское изображение которой напоминает клеверный лист (см. рис. 14.3). В настоящее время, когда известна первичная структура большинстватРНК, последовательность всех или почти всех природных тРНК как будто бы укладывается в эту схему «клеверного листа» (см. главу 14). При сравнении этих структур выявляется ряд закономерностей, несомненно, имеющих определенный биологический смысл. Во всех тРНК есть участки, взаимодействующие с рибосомами, места для связывания с аминокислотами и ферментами, а также специфическая последовательность трех нуклеотидов(триплет), называемая анти-кодоном, которая оказывается комплементарной тринуклеотидной последовательностимРНК (кодону), кодирующей включение в белковую молекулу определенной аминокислоты. Независимо от типа РНК синтезированный в клетке продукт транскрипции (см. главу 13) всегда представлен единственной цепью, упакованной во вторичную структуру не случайно, а в соответствии с программой ДНК. Поскольку в составе РНК имеются свободные 2'-оксигруппы рибозы, не связанные со стандартным крик-уотсоновским спариванием азотистых оснований, появляются дополнительные возможности образования вторичной и третичной структур, содержащих выпуклости, шпильки, или крестообразные структуры. Особенности структуры тРНК имеют прямое отношение к процессу трансляции, Данные о структуре тРНК свидетельствуют о том, что нативные молекулы тРНК имеют примерно одинаковую третичную структуру, которая отличается от плоской структуры «клеверного листа» большой компактностью за счет складывания различных частей молекулы. Следует указать на существование у ряда вирусов (реовирус, вирусраневых опухолей растений и др.) природных двухцепочечных РНК, обладающих однотипной с ДНК структурой. При физиологических значениях рН среды, ионной силы и температуры создаются условия для образования в одно-цепочечных матричных и рибосомных РНК множества участков с двойной спиралью («шпильки») и дальнейшего формирования комплементарных участков, определяющих в известной степени жесткость их третичной структуры Р-РНК - рибосомальная входит в состав рибосом (3000-5000 нуклеотидов) (80% от общей массы РНК клетки). Из неё построен каркас рибосом, участвует в инициации, окончании синтеза и отделения готовых молекул белка от рибосом. И-РНК - информационная (матричная) несет генетическую информацию, транскрибируемую с ДНК о структуре полипептидной цепи в виде кодонов (триплетов нуклеотидов). Молекула включает от 300 до 3000 нуклеотидов и составляет 3-5%. В ядре и цитоплазме. Т-РНК - транспортная – обеспечивает транспорт активированных аминокислот к рибосомам (тройной комплекс аминоацил т-РНК синтетаза, аминокислота, АТФ). Имеет вторичную структуру в виде листка клевера, на верхушке которого – антикодон. 26 вопрос Переваривание нуклеиновых кислот. Катаболизм пиримидиновых нуклеотидов: стадии процесса, ферменты. Нарушения обмена пиримидиновых нуклеотидов. Оротацидурия. Нуклеиновые кислоты разрушаются нуклеазами поджелудочной железы и тонкого кишечника. Образующиеся продукты расщепления — нуклеиновые основания (производные пурина и пиримидина), пентозы (рибоза идезоксирибоза), фосфат и нуклеозиды (нуклеиновое основание + пентоза) — всасываются слизистой тощей кишки. Пищевые нуклеопротеины, попадая в организм человека, в желудке отщепляют белковый компонент и денатурируют под действием HCl желудочного сока (рис. 10-1). Далее полинук-леотидная часть этих молекул гидролизуется в кишечнике до мононуклеотидов. В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы до олигонуклеоти-дов. Последние под действием фосфодиэстераз панкреатической железы расщепляются до смеси 3'- и 5'-мононуклеотидов. Нуклеотидазы и неспецифические фосфатазы гидролитически отщепляют фосфатный остаток нуклеотидов и превращают их в нуклеозиды, которые либо всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозоили дезок-сирибозо-1-фосфата, пуриновых и пиримиди-новых оснований. Пищевые пурины и пиримидины не являются незаменимыми пищевыми факторами и очень мало используются для синтеза нуклеиновых кислот тканей. В энтероцитах обнаружена высокая активность ксантиноксидазы - фермента, который большую часть пуринов, поступающих в клетки, превращает в мочевую кислоту, удаляющуюся с мочой. Пиримидиновые основания, не успевшие поступить в энтероциты, под действием микрофлоры кишечника расщепляются до NH3, CO2, β-аланина и β-аминоизобутирата. В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым «запасным» путям. Последовательность ферментативных реакций гидролиза пиримидиновых нуклеозидов можно представить в виде схемы:  Рис. 10-1. Переваривание нуклеиновых кислот пищи. novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым «запасным» путям. Последовательность ферментативных реакций гидролиза пиримидиновых нуклеозидов можно представить в виде схемы: 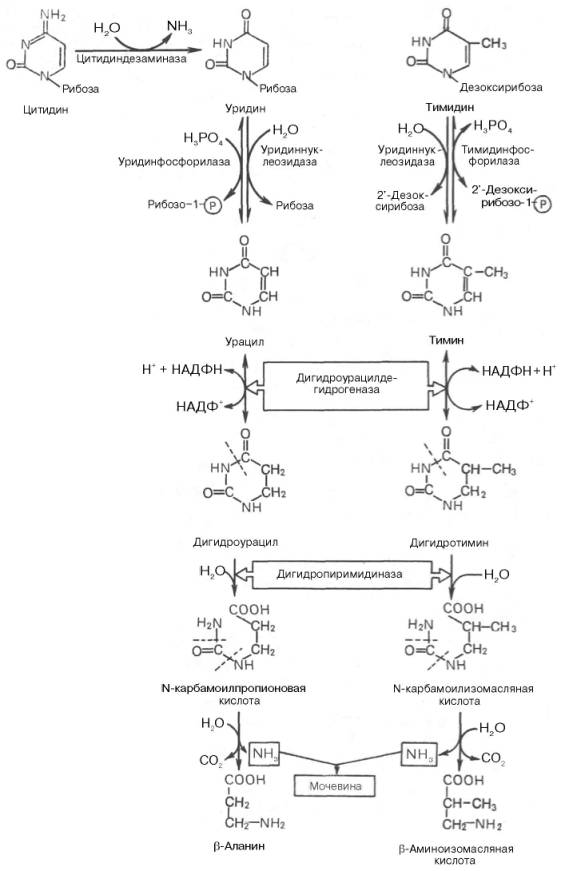 Начальные этапы реакции распада пиримидиновых нуклеотидов катализируются специфическими ферментами. Конечными продуктами реакции являются СО2, NH3, мочевина, β-аланин и β-аминоизомасляная кислота. Следует указать, что гидролитический путь распада пиримидинов является, очевидно, главным путем образования β-аланина, который может служить источником для синтеза ансерина и карнозина (см. главу 20), а также для образования КоА. Известно, что β-аланин в животных тканях подвергается дальнейшему распаду. В тканях животных открыта специфическая аминотрансфераза, катализирующая трансаминирование между β-аланином и пировиноградной кислотой. В процессе этой обратимой реакции синтезируются α-аланин и формилацетат (полуальдегид малоновой кислоты): 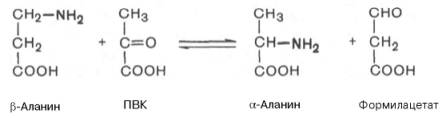 Образовавшийся формилацетат далее подвергается окислительному декарбоксилированию с образованиемуглекислоты и ацетил-КоА. А. ОРОТАЦИДУРИЯ Это единственное нарушение синтеза пирими-динов de novo. Оно вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от образования пиримидинов de novoзависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента. Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы. Установлено, что содержание оротовой кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оро-тата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пирими-диновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента по механизму ретроингибирования, из-за чего возникает гиперпродукция оротата.
Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная неспособностью организма обеспечить нормальную скорость деления клеток эритро-цитарного ряда. Её диагностируют у детей на том основании, что она не поддаётся лечению препаратами фолиевой кислоты. Недостаточность синтеза пиримидиновых нуклеотидов сказывается на интеллектуальном развитии, двигательной способности и сопровождается нарушениями работы сердца и ЖКТ. Нарушается формирование иммунной системы, и наблюдается повышенная чувствительность к различным инфекциям. Гиперэкскреция оротовой кислоты сопровождается нарушениями со стороны мочевы-водящей системы и образованием камней. При отсутствии лечения больные обычно погибают в первые годы жизни. При этом оротовая 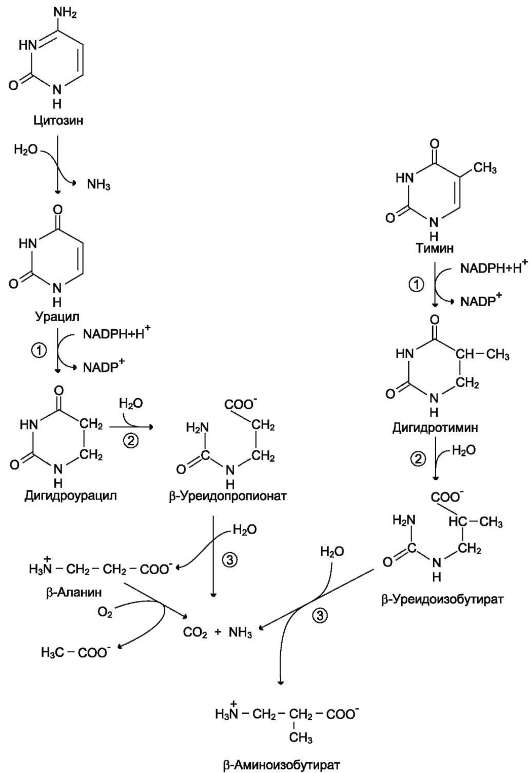 Рис. 10-16. Катаболизм пиримидиновых оснований. 1 - дигидропиримидиндегидрогеназа; 2 - дигидропи-римидинциклогидролаза; 3 - уреидопропионаза. кислота не оказывает токсического эффекта. Многочисленные нарушения в работе разных систем организма вызваны «пиримидиновым голодом». Для лечения этой болезни применяют уридин (от 0,5 до 1 г/сут), который по «запасному» пути превращается в УМФ. Уридин + АТФ → УМФ + АДФ. Нагрузка уридином устраняет «пиримидино-вый голод», а поскольку из УМФ могут синтезироваться все остальные нуклеотиды пиримиди-нового ряда, то снижается выделение оротовой кислоты из-за восстановления механизма рет-роингибирования КАД-фермента. Для больных оротацидурией лечение уридином продолжается в течение всей жизни, и этот нуклеозид становится для них незаменимым пищевым фактором. Кроме генетически обусловленных причин, оротацидурия может наблюдаться: • при гипераммониемии, вызванной дефектом любого из ферментов орнитинового цикла, за исключением карбамоилфосфатсинтетазы I. В этом случае карбамоилфосфат, синтезированный в митохондриях, выходит в цитозоль клеток и начинает использоваться на образование пиримидиновых нуклеоти-дов. Концентрация всех метаболитов, в том числе и оротовой кислоты, повышается. Наиболее значительная экскреция оротата отмечается при недостаточности орнитин-карбамоилтрансферазы (второго фермента орнитинового цикла);
• в процессе лечения подагры аллопурино-лом, который превращается в оксипури-нолмононуклеотид и становится сильным ингибитором УМФ-синтазы. Это приводит к накоплению оротовой кислоты в тканях и крови. 27 вопрос Биосинтез пиримидиновых нуклеотидов: стадии процесса, ферменты. Запасные пути синтеза пиримидиновых нуклеотидов. Регуляция биосинтеза пиримидиннуклеотидов. Образование пиримидиновых нуклеотидов DE NOVO В отличие от синтеза пуринов, где формирование гетероциклического основания осуществляется на остатке рибозо-5-фосфата, пиримидиновое кольцо синтезируется из простых предшественников: глутамина, СО2 и аспарагиновой кислоты и затем связывается с рибозо-5-фосфатом, полученным от ФРДФ. Образование дигидрооротата Ключевой регуляторной реакцией в синтезе пиримидиновых нуклеотидов является синтез карбамоилфосфата из глутамина, СО2 и АТФ, в реакции катализируемой карбамоилфосфатсинтетазой II (КФС II), которая протекает в цитозоле клеток. В реакции NH2-гpyппa карбамоилфосфата образуется за счёт амидной группы глутамина, что отличает эту реакцию от реакции синтеза карбамоилфосфата в митохондриях в процессе синтеза мочевины из СО2, NH3 и АТФ с участием КФС I. Карбамоилфосфат, использующийся на образование пиримидиновых нуклеотидов, является продуктом полифункционального фермента, который наряду с активностью КФС II содержит каталитические центры аспартаттранскарбамоилазы и дигидрооротазы. Этот фермент назвали "КАД-фермент" - по начальным буквам ферментативных активностей, которыми обладают отдельные каталитические домены этого белка. Объединение первых трёх ферментов метаболического пути в единый полифункциональный комплекс позволяет использовать почти весь синтезированный в первой реакции карбамоилфосфат на взаимодействие с аспартатом и образование карбамоиласпартата, от которого отщепляется вода и образуется циклический продукт – дигидрооротат. 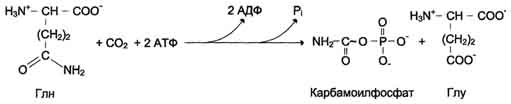 Отщепляясь от КАД-фермента, дигидрооротат подвергается дегидрированию NAD-зависимой дигидрооротатдегидрогеназой и превращается в свободное пиримидиновое основание - оротовую кислоту, или оротат. 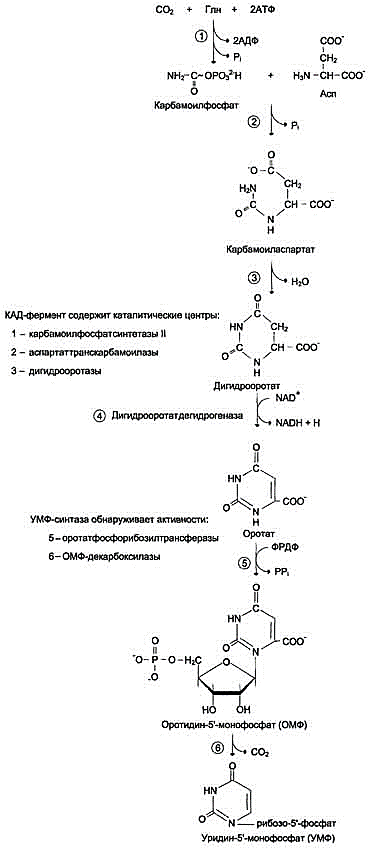 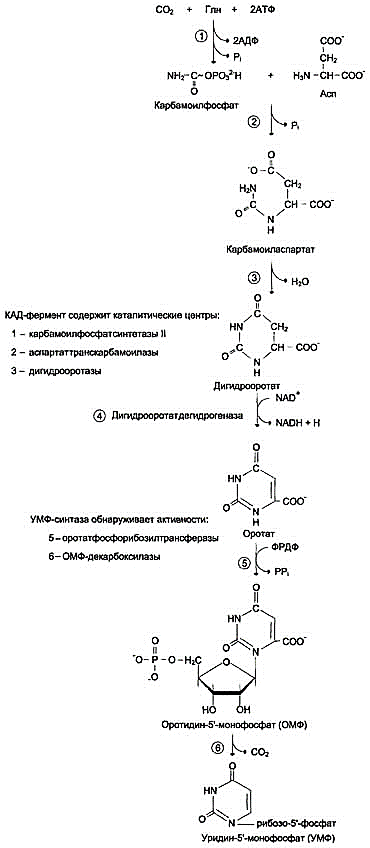 Образование УМФ В цитозоле оротат становится субстратом бифункционального фермента - УМФ-синтазы, которая обнаруживает оротатфосфорибозилтранс-феразную и ОМФ-декарбоксилазную активности. Первоначально фосфорибозильный остаток от фосфорибозилдифосфата переносится на оротат и образуется нуклеотид - оротидин-5'-монофосфат (ОМФ), декарбоксилирование которого даёт уридин-5-монофосфат (УМФ). Таким образом, шесть последовательных реакций синтеза пиримидиновых нуклеотидов осуществляются тремя ферментами, которые кодируются в геноме человека тремя различными структурными генами. Биосинтез УДФ, УТФ и цитидиловых нуклеотидов УМФ под действием специфических нуклеозидмонофосфат (НМФ) и нуклеозиддифосфат (НДФ) киназ превращается в УДФ и УТФ в результате переноса γ-фосфатного остатка АТФ на соответствующий субстрат. НМФ-киназа катализирует следующую реакцию: УМФ + АТФ → УДФ + АДФ, а НДФ-киназа: УДФ + АТФ → УТФ + АДФ. ЦТФ синтетаза катализирует амидирование УТФ, осуществляя АТФ-зависимое замещение кетогруппы урацила на амидную группу глутамина с образованием цитидин-5'-трифосфата (ЦТФ). "Запасные" пути синтеза пиримидиновых нуклеотидов Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов с расщеплением пиримидинового кольца. В ресинтезе пиримидинов участвуют некоторые ферменты катаболизма нуклеотидов. Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина. Урацил + Рибозо-1-фосфат → Уридин + Н3РО4. Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа. Часть ЦМФ может превращаться в УМФ под действием цитидиндезаминазы и пополнять запасы уридиловых нуклеотидов. ЦМФ + Н2О → УМФ + NH3. Регуляция синтеза пиримидиновых НУКЛЕОТИДОВ Регуляторным ферментом в синтезе пиримидиновых нуклеотидов является полифункциональный КАД-фермент. УМФ и пуриновые нуклеотиды аллостерически ингибируют, а ФРДФ активирует его карбамоилсинтетазную активность, тогда как активность аспартаттранскарбамоилазного домена ингибирует ЦТФ, но активирует АТФ. 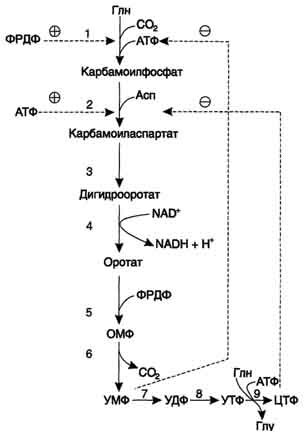 Рис. 10-15. Регуляция синтеза пиримидиновых нуклеотидов. КАД-фермент катализирует реакции 1, 2, 3; дигидрооротатдегидрогеназа - реакцию 4; УМФ синтетаза - реакции 5 и 6; НМФ киназа - реакцию 7; НДФ киназа - реакцию 8; ЦТФ синтетаза - реацию 9. Характеристика и функции гормонов передней доли гипофиза. Регуляция образования и механизм действия. Соматотропный гормон. В передней доли гипофиза синтезируются тропные гормоны, стимулирующие синтез и секрецию гормонов других эндокринных желез или оказывающие влияние на метаболические реакции в других органах мишенях. Синтез и секреция этих гормонов регулируется гормонами гипоталамуса, которые поступают в гипофиз через портальную систему кровеносных сосудов, а также регулируется по механизму обратной связи гормонами продукцию которых они стимулируют в органах мишенях. В передней доли синтезируются гормоны которые по химическому строению являются пептидами и гликопротеинами. Гормон роста стимулирует постнатальный рост скелета и мягких тканей, участвует в регуляции энергетического и минерального обмена. Тиреотропный гормон стимулирует синтез йодтиронинов. Пролактин стимулирует лактацию, лютеинизирующий гормон, у женщин индуцирует овуляцию, у мужчин индуцирует синтез андрогенов в клетках Лейдига. Фолликулостимулирующий гормон у женщин стимулирует рост фолликулов , у мужчин стимулирует сперматогенез. Кортикотропин стимулирует рост надпочечников и синтез кортикостероидов. Бета липотропин стимулирует липолиз. Соматотропный гормон синтезируется в соматотрофных клетках, его содержание 5-16мг. на 1г. железы. Гормон роста состоит из 191 кислотного остатка и имеет 2 внутримолекулярные дисульфидные связи. Секреция гормона роста носит пульсирующий характер с интервалами 20-30мин. Регуляция синтеза и секреции осуществляется множеством факторов (основной стимулирующий- соматолиберин, тормозящий- гипоталамический соматостатин). Основное действие гормона роста направлено на регуляцию обмена белков и процессов, связанных с ростом и развитием организма, усиливается транспорт аминокислот в клетки мышц, синтез белка в костях, хрящах, мышцах, печени и других внутренних органах. |
