Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
28 вопросБиосинтез пуриновых нуклеотидов: происхождение атомов азота и углерода в пуриновом кольце, стадии процесса, ферменты, регуляция. Запасные пути синтеза пуриновых нуклеотидов. Синдром Леша-Нихена у детей. Как видно из приведенной схемы, синтез инозиновой кислоты начинается с D-рибозо-5-фосфата, который, как известно, является продуктом пентозофосфатного цикла и на который переносится в необычной реакциипирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофос-фат (ФРПФ) взаимодействует сглутамином, являющимся донором NH2-группы, в результате чего образуется β-5-фосфорибозил-амин, причем в процессе реакции наряду с освобождением пирофосфата и свободной глутаминовой кислоты происходит изменение его конфигурации (из α- в β-). Таким образом, данная стадия становится ключевой реакцией в синтезе пуринов. На следующей стадии присоединяется вся молекула глицина к свободной NH2-группе β-5-фосфорибозил-амина (реакция нуждается в доставке энергии АТФ) с образованием глицинамидрибонуклеотида. Затем, на следующей стадии, цепь удлиняется за счет присоединения формильной группы из N5,N10-метенил-ТГФК с образованием формилглицинамид-рибонуклеотида. На формильную группу последнего переносится далее амидная группаглутамина и синтезируется формилглицинамидинрибо-нуклеотид (реакция также идет с потреблением энергии АТФ). На следующей стадии замыкается пятичленное имидазольное кольцо и образуется 5-аминоимидазолрибонуклеотид, который способен акцептировать СО2 с образованием рибонуклеотида 5-аминоимидазол-4-карбоновой кислоты. 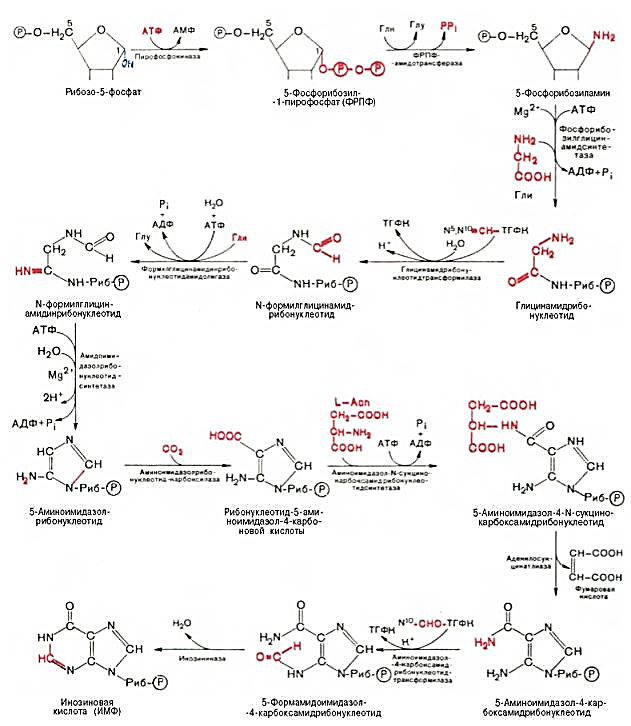 В последующем двухступенчатом процессе, в котором участвуют аспа-рагиновая кислота и АТФ, образуется 5-аминоимидазол-4-карбоксамид-рибонуклеотид и освобождается фумаровая кислота. В этих реакциях азотаспарагиновой кислоты включается в 1-е положение будущего пуринового ядра. Последний углеродный атомпиримидинового остатка кольца пурина вводится в виде формильного остатка (источник N10-формил-ТГФК), который присоединяется к 5-NH2-группе. После этого отщепляется молекула воды и второе кольцо замыкается. В результате образуется первый пу-риновый нуклеотид – инозиновая кислота (ИМФ), которая является предшественникомпуриновых нуклеотидов в составе нуклеиновых кислот. АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих моно-нуклеотидов участвуют по два фермента, различных по своему механизму действия. Образование ГМФ из ИМФ катализируют ИМФ-дегидрогеназа и ГМФ-синтетаза, а образование АМФ из того же предшественника катализируется последовательным действием аденилосукцинатсинтетазы и аденилосукцинат-лиазы. Механизм двухэтапного синтеза АМФ и ГМФ можно представить в виде химических реакций. 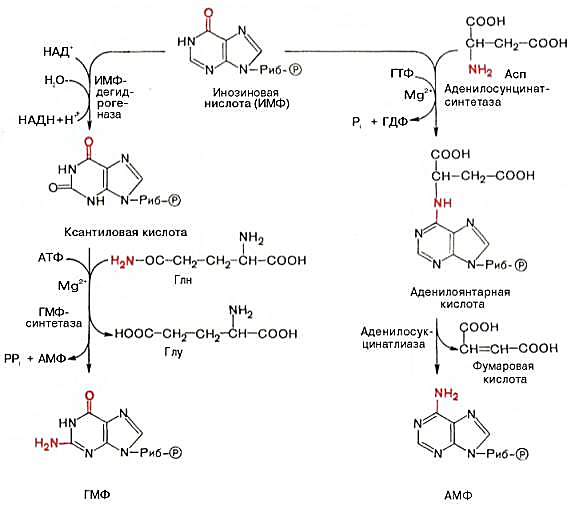 В ферментативном синтезе АМФ из ИМФ специфическое участие принимает аспарагиновая кислота, являющаясядонором NH2-группы, и ГТФ в качестве источника энергии; промежуточным продуктом реакции является аденилоянтарная кислота. Биосинтез ГМФ, напротив, начинается с де-гидрогеназной реакции ИМФ с образованием ксантозиловой кислоты; в аминировании последней используется только амидный азот глутамина. Превращение АМФ и ГМФ в соответствующие нуклеозидди- и нуклео-зидтрифосфаты также протекает в 2 стадии при участии специфических нуклеозидмонофосфат- и нуклеозиддифосфаткиназ : ГМФ + АТФ <=> ГДФ + АДФ; ГДФ + АТФ <=> ГТФ + АДФ. Следует указать на существование в клетках весьма тонкого механизма регуляции синтеза пуриновых нуклеотидов. Синтез их тормозится конечными продуктами по принципу обратной связи, т.е. ингибированием первой стадии переноса аминогруппы глутамина на ФРПФ. Фермент, катализирующий эту стадию, оказался аллостерическим регуляторным ферментом. Вторая особенность механизма регуляции заключается в том, что избыток ГМФ в клеткахоказывает аллостерическое торможение только на свой собственный синтез, не влияя на синтез АМФ, и, наоборот, накопление АМФ подавляет свой синтез, не ингибируя синтеза ГМФ. 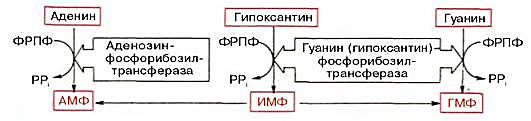 29 вопрос Катаболизм пуриновых нуклеотидов. Гиперурикемия и подагра. Катаболизм пуриновых нуклеотидов приводит к образованию ксантина, который в организме человека превращается в мочевую кислоту(норма 0,15-0,47 ммоль на л, 3-7 мг) путем гидролитического отщепления фосфатного остатка от нуклеотидов с помощью нуклеотидаз или фосфорилаз и окисления азотистых оснований. 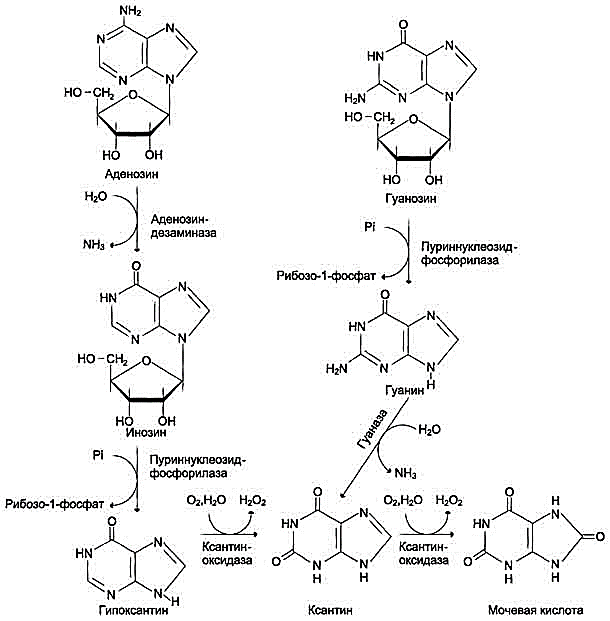 Часть свободных пуриновых оснований используется повторно (реутилизация) под действием ферментов гипоксантин-гуанинфосфорибозилтрансферазы (образование ИМФ и ГМФ из гипоксантина и гуанина) и аденинфосфорибозилтрансферазы (АМФ), которые превращают пуриновые основания в мононуклеотиды. Донором фосфорибозильной группы служит 5’-фосфорибозил-1’-пирофосфат (PRPP). 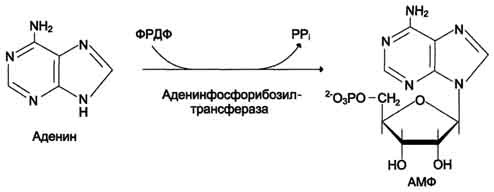 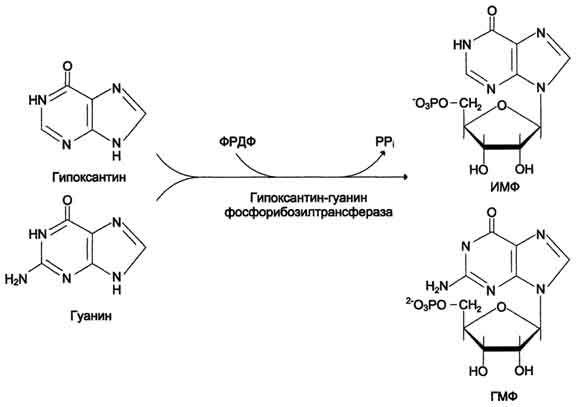 Гиперурикемия - состояние, проявляющееся повышением содержания мочевой кислоты в крови. Причинами гиперурикемии может быть: - избыточный синтез мочевой кислоты вследствие нарушения регуляции-снижение в плазме концентрации уратсвязывающего белка - транспортного белка для мочевой кислоты-замедление выведения мочевой кислоты с мочой -снижение скорости реутилизации пуриновых оснований. Подагра - заболевание, причиной которого является гиперурикемия. Так как мочевая кислота плохо растворимое соединение, то при повышении концентрации происходит ее кристаллизация и накопление в суставах, подкожной клетчатке с образованием подагр.узлов, тофусов, или в виде уратных камней.причиной воспаления является разрушение лизосомальных мембран дейкоцитов кристаллами мочевой кислоты. Лизосом. Ферменты выходят в цитозоль и разрушают клетки, вызывая воспаления. Способом, снижающим синтез мочевой кислоты, является применение в качестве лекарства аллопуринола - конкурентного ингибитора ксантиноксидазы, фермента, катализирующего превращение гипоксантина в ксантин и ксантина в мочевую кислоту. В результате катаболизм нуклеотидов приводит к образованию гипоксантина, который является более растворимым веществом. Синдром Леша-Нихана - генетическое заболевание, наследуется как рецессивный признак(х-хромосома, только у мальчиков), связанное с повышением у детей синтеза мочевой кислоты и, как следствие этого, развитием различных нейрофизиологических нарушений: замедлению умственного развития, агрессивности и т.д. Причиной этого является дефект фермента гипоксантин-гуанин-фосфорибозил-трансферазы, который катализирует реутилизацию гуанина и гипоксантина. В этом случае образуется больше ксантина и, следовательно, мочевой кислоты. Гиперурикемия(моч.кислота превышает 600 мг в сутки) Кроме того, снижение синтеза GMP и IMP из свободных оснований ухудшает регуляцию скорости их синтеза из мелких фрагментов путем реутилизации.ранние тофусы, утратные камни, невологич.отклонения, нарушении речи, параличи, склонность к нанесению себе увечий. Катаболизм пиримидиновых нуклеотидов приводит к образованию пиримидиновых оснований, а затем протекает разными путями в зависимости от вида организма. У человека конечными продуктами распада являются СО2, NН4, бетта -аланин (из урацила) и бетта -аминомасляная кислота из тимина. Ферменты реутилизации свободных пиримидиновых оснований не были обнаружены, но клетки млекопитающих обладают способностью реутилизировать пиримидиновые рибонуклеозиды - уридин и цитидин, превращая их в соответствующие нуклеотиды. Реутилизация пуриновых оснований Свободные пуриновые и пиримиди-новые основания непрерывно образуются в клетках в результате описанного выше метаболического распада нуклеотидов. Значительная часть этих свободных пуриновых оснований не подвергается дальнейшему распаду, а реутилизирует-ся, т.е. используется вновь для синтеза пуриновых нуклеотидов. В этом случае нуклеотиды образуются совсем не так. как при биосинтезе denovo, который мы рассмотрели выше. Пуриновое ядро аденина, синтезирующееся denovo, строится на рибозо-5-фосфате этап за этапом, в длинной последовательности реакций. Путь биосинтеза из готовых продуктов гораздо проще. Он включает всего лишь одну реакцию, в ходе которой свободный аденин взаимодействует с 5-фосфорибозил-1-пирофосфатом (ФРПФ), что и приводит к образованию аденинового нуклеотида Аденин + ФРПФ -»• AMP + РР,. Свободный гуанин реутилизируется тем же путем при помощи другого фермента Гуанин + ФРПФ — GMP + РР;. 30 вопрос Биосинтез дезоксирибонуклеотидов, регуляция. Рибонуклеотидредуктазный комплекс. Патологии, вызванные недостаточностью ферментов катабализма пуриннуклеозидов у детей. Биосинтез тимидиловых нуклеотидов. Запасные пути синтеза дезоксирибонуклеотидов. Синтез дезоксирибонуклеотидов идёт с заметной скоростью только в тех клетках, которые вступают в S-фазу клеточного цикла и готовятся к синтезу ДНК и делению. В покоящихся клетках дезоксинуклеотиды практически отсутствуют. Все дезоксинуклеотиды, кроме тимидиловых, образуются из рибонуклеотидов путём прямого восстановления ОН-группы у второго углеродного атома рибозы в составе рибонуклеозиддифосфатов до дезоксирибозы. Тимидиловые нук-леотиды синтезируются из dУМФ особым путём с участием N5,N10-метилен-Н4-фолата. Рибонуклеотидредуктазный комплекс Реакцию восстановления НДФ в дезоксипроизводные катализирует рибонуклеотидредук-тазный комплекс, в состав которого входят: собственно рибонуклеотидредуктаза (РНР), белок тиоредоксин и фермент тиоредоксинредуктаза, обеспечивающий регенерацию восстановленной формы тиоредоксина (рис. 10-17). 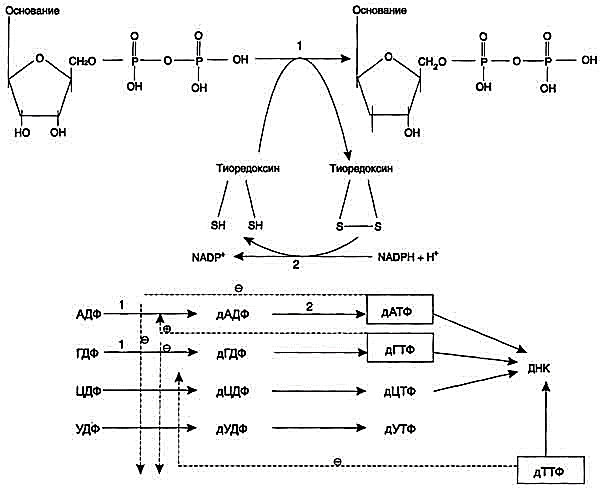 Рибонуклеотидредуктаза - олигомерный белок, состоящий из двух В1- и двух В2-субъединиц, и содержит негеминовое железо в качестве кофактора. Непосредственным донором водорода в реакции восстановления рибозы служит низкомолекулярный белок тиоредоксин. В рабочую часть этого белка входят 2 SH-группы, которые, отдавая водород, окисляются с образованием дисульфидного мостика. Второй фермент комплекса - тиоредоксинредуктаза - катализирует гидрирование окисленного тиоредоксина с использованием NADPH. При участии комплекса РНР образуются: dАДФ, dГДФ, dУДФ и dЦДФ, которые с помощью НДФ-киназ превращаются в дНТФ, 3 из которых (кроме дУДФ) непосредственно используются в синтезе ДНК. дНДФ + АТФ → дНТФ + АДФ. Биосинтез тимидиловых нуклеотидов Тимидин-5'-монофосфат (дТМФ) образуется из дУМФ в реакции, катализируемой тимидилатсинтазой (рис. 10-18). Донором метильной группы, появляющейся в 5-положении пиримидинового кольца в молекуле дТМФ, служит кофермент тимидилатсинтазы - N5,N10-метилен-Н4-фолат. С помощью этого кофермента в молекулу дУМФ включается метиленовая группа и восстанавливается в метальную, используя 2 атома водорода от Н4-фолата. 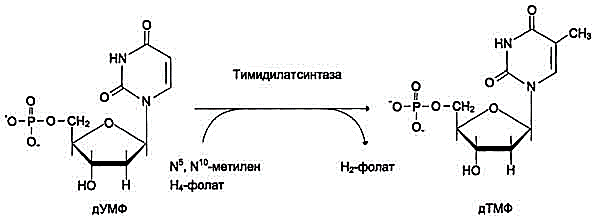 Образование субстрата тимидилатсинтазной реакции - дУМФ осуществляется двумя путями (рис. 10-19):
Скорость синтеза дТМФ зависит также от количества второго субстрата тимидилатсинтазной реакции - N5,N10-метилен-Н4-фолата, пополнение запасов которого осуществляется при участии 2 ферментов: дигидрофолатредуктазы, которая с участием NADPH восстанавливает Н2-фолат в Н4-фолат, и серии гидроксиметилтрансферазы, осуществляющей перенос β-гидроксиметиленовой группы серина на Н4-фолат. У человека дТМФ образуется, главным образом, из дЦДФ. 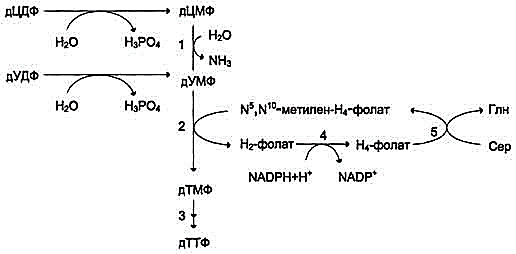 "Запасные" пути синтеза дезоксирибонуклеотидов В быстроделящихся клетках наряду с синтезом дезоксинуклеотидов с помощью рибонуклеотид-редуктазного комплекса и тимидилатсинтазы активируются реакции, обеспечивающие повторное использование тимина и дезоксицитидина в реакциях, катализируемых ферментами "запасных" путей и обратимых реакций катаболизма. Под влиянием тимидинфосфорилазы протекает следующая реакция: Тимин + Дезоксирибоза-1-фосфат → Тимидин + Н3Р04. Тимидинкиназа катализирует следующую реакцию: Тимидин + АТФ → дТМФ + АДФ. Дезоксицитидинкиназа катализирует следующую реакцию: Дезоксицитидин + АТФ → дЦМФ + АДФ. Нарушения в работе РНР, вызванные недостаточностью ферментов катаболизма пуриннуклеотидов Аденозиндезаминаза (АДА) и пуриннуклеозидфосфорилаза (ПНФ) участвуют в превращении пуриновых нуклеозидов в азотистые основания. Их недостаточность сопровождается развитием тяжёлых форм иммунодефицита. Недостаточность аденозиндезаминазы.АДА катализирует гидролитическое дезаминирование аденозина и дезоксиаденозина: Аденозин + Н2О → Инозин + NH3, Дезоксиаденозин + Н2О → Дезоксиинозин + NH3. Фермент АДА обнаружен во многих органах и тканях, однако его недостаточность имеет наиболее тяжёлые последствия для клеток лимфоци-тарного ряда. Низкая активность этого фермента нарушает пролиферацию и созревание Т- и В-лимфоцитов и сопровождается тяжёлыми формами клеточного и гуморального иммунодефицита. Дети, страдающие этой патологией, как правило, погибают в раннем возрасте от бактериальных, вирусных или грибковых инфекций. Столь тяжёлые последствия недостаточности АДА для клеток лимфоцитарного ряда объясняют тем, что при снижении скорости дезаминирования адениловых и дезоксиадениловых нук-леотидов в клетках увеличивается концентрация дАТФ, который ингибирует РНР. Это нарушает синтез всех дНТФ и лишает клетки субстратов для синтеза ДНК. Для нелимфоцитарных клеток недостаточность АДА не сопровождается нарушениями метаболизма в связи с тем, что в них активно работает фосфатаза дАТФ, которая предотвращает накопление основного ингибитора РНР - дАТФ. Фермент обладает групповой субстратной специфичностью и использует в качестве субстратов некоторые производные аденозина, которые применяются в терапии онкологических и противовирусных заболеваний (аденозинарабинозид, формицин). Недостаточность пуриннуклеозидфосфорилазы (ПНФ).ПНФ катализирует фосфоролиз пуриновых рибо- и дезоксирибонуклеозидов с освобождением азотистых оснований и рибозо- или дезоксирибозо-1-фосфата. Субстратами служат гуанозин, дезоксигуанозин и инозин. Нуклеозид + Н3РО4 → Азотистое основание + Рибозо-1-фосфат. Фермент обнаружен во многих органах и тканях, но особенно активен в клетках-предшественниках Т-лимфоцитов в процессе их созревания в тимусе. При наследственной недостаточности пуриннуклеозидфосфорилазы, вызванной генными мутациями, в крови снижается образование и количество зрелых Т-лимфоцитов. Нарушение созревания Т-лимфоцитов вызвано тем, что в этих клетках высокой активностью обладает дезоксигуанозинкиназа, а это приводит к накоплению дГТФ в концентрациях, которые, подобно дАТФ, ингибируют РНР. У детей снижен клеточный иммунитет, хотя гуморальный иммунитет не страдает, так как в В-лимфоцитах дезоксигуанозинкиназа малоактивна и накопления дГТФ в токсических концентрациях не отмечают. Болезнь, вызванная недостаточностью ПНФ, характеризуется более лёгким течением, чем болезнь, обусловленная дефицитом АДА. |
