Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
19 вопросОбщий путь катаболизма как основной поставщик протонов и электронов для дыхательной цепи. Окислительное декарбоксилирование пирувата: строение и регуляция пируватдегидрогеназного комплекса, связь с цепью переноса электронов (ЦПЭ). Суммарное уравнение процесса. В пище человека практически не содержится готовых первичных доноров водорода для дегидрогеназ; они образуются из пищевых веществ в ходе катаболизма. В едином катаболическом процессе можно выделить два типа путей:специфические пути катаболизма(спк) и общий путь катаболизма(опк). СПК – распад органических соединений различных классов(белков,липидов,углеводов), составляющих основу питания. ОПК интегрирует все специфические пути и является их общим продолжением. В результате специфических путей катаболизма продукты переваривания пищевых веществ(моносахариды,глицерин,жирные кислоты,аминокислоты) превращаются всего в два соединения – ПВК и ацетил-КоА, которые затем направляются в общий путь катаболизма, включающий в себя процесс декарбоксилирования ПВК и цикл трикарбоновых кислот. Некоторые специфические пути включаются в общий путь на стадии пирувата, другие-на стадии ацетил-КоА. Ряд веществ поступает в общий путь катаболизма на промежуточных стадиях цикла трикарбоновых кислот. Именно общий путь катаболизма является источником основной массы первичных доноров водорода для дыхательной цепи. Окислительное декарбоксилирование ПВК можно отразить следующим уравнением: Данный процесс многостадиен и катализируется пируватдегидрогеназным ферментативным комплексом (пдк). ПДК состоит из 3 ферментов: пируватдекарбоксилазы, ацетилтрансферазы и дегидрогеназы дегидролипоевой кислоты. Кроме того, в реациях участвует 5 коферментов: НАД, ФАД, тиаминдифосфат(ТДФ), липоевая кислота и HS-KoA. Каждый фермент и, соответственно, кофермент катализует определенную реакцию данного многостадийного процесса. Например, дегидрогеназа дегидролипоевой кислоты катализирует последнюю стадию окислительного декарбоксилирования, в результате которой дигидролипоевая кислота превращается в дегидролипоевую, что служит сигналом для связывания следующей молекулы пирувата с ПДК. ПДК представляет собой крупную надмолекулярную структуру с молекулярной массой 7-10 млн. Он встроен во внутреннюю мембрану митохондрий. Пируват поступает к комплексу межклеточного пространства, и сюда же высвобождается ацетил-КоА и восстановленная форма (НАДН+Н+). 20 вопросЦитратный цикл: последовательность реакций, ферменты, связь с ЦПЭ. Энергетическая эффективность и аллостерическая регуляция процесса. Реакции, пополняющие цитратный цикл. Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил- КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций. 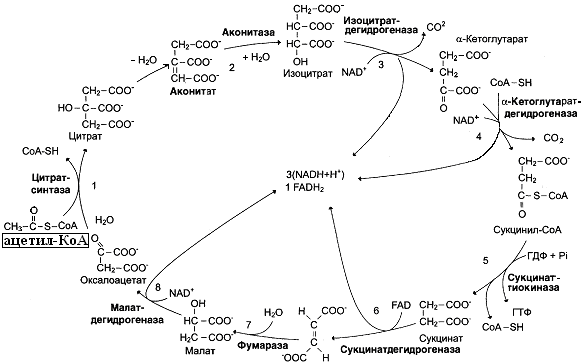 1. Последовательность реакций цитратного цикла Образование цитрата В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата (рис. 6-24); одновременно расщепляется тиоэ-фирная связь и освобождается коэнзим A (ΔG0' = -37,6 кДж/моль). Равновесие реакции в клетке сильно сдвинуто вправо, о чём свидетельствует отрицательная величина стандартной свободной энергии. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий. Превращение цитрата в изоцитрат Вторая реакция цитратного цикла - обратимое превращение цитрата в изоцитрат (рис. 6-24). Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции. Окислительное декарбоксилирование изоцитрата Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве коферментa NAD+, вторая - NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; NADP-зависимый фермент, присутствующий и в митохондриях, и В) цитоплазме, играет иную метаболическую роль, В результате действия этого фермента на изоцитрат образуется α-кетоглутарат (см. рис. 6-24). Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента. Окислительное декарбоксилирование α-кетоглутарата В этой реакции α-кетоглутарат подвергается окислительному декарбоксилированию с образованием в качестве конечных продуктов сук-цинил-КоА, СО2 и NADH + Н+. В результате этой реакции образуется сукцинил-КоА (см. рис. 6-24). Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом (ПДК). Подобно ПДК, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD. Существенное отличие этой ферментной системы от ПДК - то, что она не имеет сложного механизма регуляции, какой характерен для ПДК. В частности, в этом комплексе отсутствуют регуляторные субъединицы. Равновесие реакции окислительного декарбоксилирования α-кетоглутарата сильно сдвинуто в сторону образования сукцинил-КоА, и её можно считать однонаправленной. Превращение сукцинил-КоА в сукцинат Сукцинил-КоА - высокоэнергетическое соединение. Изменение свободной энергии гидролиза этого тиоэфира составляет ΔG0'= -35,7 кДж/моль. В митохондриях разрыв тиоэфирной связи сук-цинил-КоА сопряжён с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ). Сукцинил-КоА → Сукцинат (ΔG0 = -10,36 кДж/моль). Эту сопряжённую реакцию (см. рис. 6-24) катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ. С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа. ГТФ + АДФ ↔ ГДФ + АТФ. Образование высокоэнергетической фосфо-ангидридной связи за счёт энергии субстрата (сукцинил-КоА) - пример субстратного фосфорилирования. Дегидрирование сукцината Образовавшийся на предьщущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы (см. рис. 6-24). Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD. Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов. Образование малата из фумарата Образование малата происходит при участии фермента фумаратгидратазы. Этот фермент более известен как фумараза. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата. Дегидрирование малата В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоацетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий. Равновесие малатдегидрогеназной реакции сильно сдвинуто влево. Тем не менее, в интактных клетках эта реакция идёт слева направо, потому что продукт реакции, оксалоацетат, активно используется в цитратсинтазной реакции. В цитозоле содержится изоформа малат-дегидрогеназы, также NAD-зависимая, но не принимающая участие в цитратном цикле. Обе изоформы малатдегидрогеназы - димеры. Регуляция цикла.Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса. Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалацетат(субстрат Цикла Кребса) + АДФ + Фн. Функции Интегративная функция — цикл является связующим звеном между реакциями анаболизма и катаболизма.Катаболическая функция — превращение различных веществ в субстраты цикла: Жирные кислоты, пируват,Лей,Фен — Ацетил-КоА. Арг, Гис, Глу — α-кетоглутарат;Фен, тир — фумарат. Анаболическая функция — использование субстратов цикла на синтез органических веществ: Оксалацетат — глюкоза, Асп, Асн;Сукцинил-КоА — синтез гема. CО2 — реакции карбоксилирования. Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент - пируваткарбоксилаза. |
