Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
42 вопросПрямое и непрямое окислительное дезаминирование аминокислот. Последовательность реакций, ферменты, биологическая роль. Поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот. Наибольшее количество свободных аминокислот поступает из мышц и кишечника, причем до 50% составляет глутамин и аланин. Основное кол-во глутамина поставляют в кровь мышцы и мозг. Из кровеносного русла его поглощают печень и почки, Где он подвергается действию глутаминазы. Почки – основной источник серина и частично аланина. Головной мозг способен поглощать и окислять большие кол-ва аминокислот с разветвленной боковой цепью(валин, лейцин, изолейцин).  Дезаминирование аминокислот – это реакция отщепления альфа-аминогруппы от аминокислоты, в результате чего образуется соответствующая альфа-кетокислота (безазотистый остаток) и выделяется молекула аммиака. 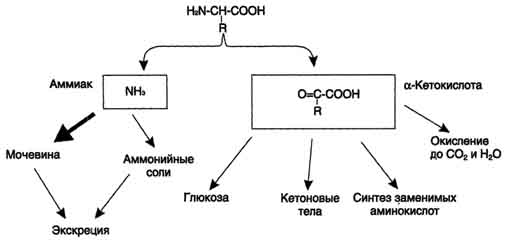 Существует несколько способов дезаминирования: окислительное, непрямое9трансдезаминирование), неокислительное, внутримолекулярное. Окислительное дезаминирование наиболее активно идет на примере глутаминовой кислоты. Реакция идет в 2 этапа. В начале идет ферментативное дегидрирование глутамата образования альфа-эминоглутарата под действием глутаматдегидрогеназой (кофермент NAD), затем – неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется альфа-кетоглутарат. 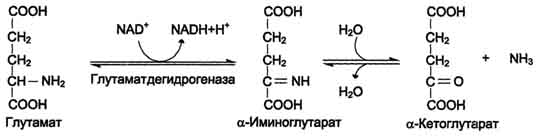 Окислительное дезаминирование глутамата – обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное аминирование альфа-кетоглутарата. Глутаматдегидрогеназа – фермент, в печени и почках фермент L –аминокислота и D-аминокислота – способны к дезаминированию АК. Непрямое дезаминирование (трансдезаминирование) – основной способ дезаминирования большинства аминокислот. В результате трансаминирования переносят аминогруппы АК на a-кетоглуторат с образованием глутаминовой кислоты, которая затем подвергается прямому окислению дезаминированию. 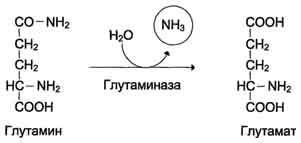 Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей альфа-кетакислоты. 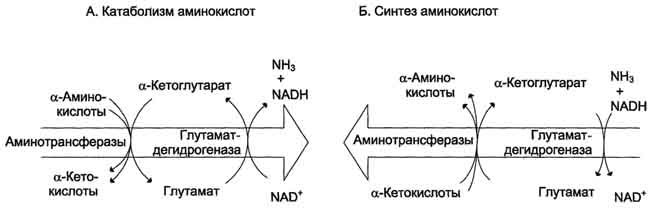 Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты трансаминазы функционируют как в процессах катабализма, так и биосинтеза аминокислот. Трансаминирование – заключительный этап синтеза зменимых АК и первая стадия дезаминирования большинства АК. Трансаминазы классический пример ферментов, катализирующих реакции, протекающие по механизму типа пинг-понг В таких реакциях первый продукт должен уйти из активного центра фермента до того, как 2-ой субстрат сможет к нему присоединиться. В норме в крови активность трансаминаз очень мала. В клинической практике щироко используют определение активности АСТ и АЛТ для диагностики некоторых заболеваний. При повреждение клеток соответствующего органа ферменты приходят в кровь, где активность их резко повышается. Аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) наиболее активны в клетках печени, сердца и, в меньшей степени скелетных мышц, их используют для диагностики болезни этих органов. Соотношение активностей АСТ/АЛТ называют коэффициент де Ритиса (норм 1,33+-0,42).при инфаркте миокарда этот коэффициент резко возрастает, а при гепатитах снижается до 0,6, при циррозе увеличивается. |
