Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
36 вопросБиохимические основы биологической эволюции, наследственности и изменчивости. Теория оперона. Схема Жакоба и Мано. Особенности регуляции генов у про- и эукариотов, характеристика процессов индукции и репрессии. Роль энхансеров (усилителей) и селенсеров (тушителей), амплификации (увеличение копий) и перестройки генов, процессинга, транспорта из ядра в цитоплазму и изменение стабильности мРНК в регуляции синтеза белков у эукариотов-основа онтогенеза и специализации органов и тканей организма. Организмы адаптируются к меняющимся условиям окружающей среды путём изменения экспрессии (скорости транскрипции) генов. Этот процесс, в деталях изученный на бактериях и вирусах, включает взаимодействие специфических белков с участками ДНК в непосредственной близости от стартового участка транскрипции. При этом может происходить включение или выключение транскрипции. Эукариотические клетки используют тот же самый принцип, хотя в регуляции реализуются и некоторые другие более сложные механизмы. Регуляция активности генов у прокариотов. Теория оперона Исследования на клетках Е. coli позволили установить, что у бактерий существуют ферменты 3 типов:
1. Теория оперона На основании генетических исследований индукции β-галактозидазы, участвующей в клетках Е. coli, в гидролитическом расщеплении лактозы(рис), Франсуа Жакоб и Жак Моно в 1961 г. сформулировали гипотезу оперона, которая объясняла механизм контроля синтеза белков у прокариотов. 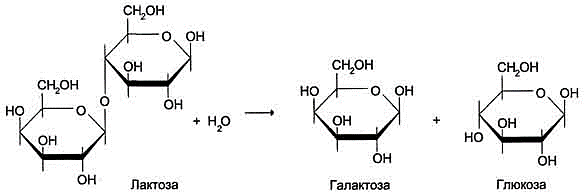 В экспериментах гипотеза оперона получила полное подтверждение, а предложенный в ней тип регуляции стали называть контролем синтеза белка на уровне транскрипции, так как в этом случае изменение скорости синтеза белков осуществляется за счёт изменения скорости транскрипции генов, т.е. на стадии образования мРНК. Согласно теории Ф. Жакоба и Ж. Моно, в биосинтезе белка у бактерий участвуют по крайней мере 3 типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. Именно эти гены в цепи ДНК являются основой для биосинтеза мРНК, которая затем поступает в рибосому и, как было указано, служит матрицей для биосинтеза белка. Синтез мРНК на структурных генах молекулы ДНК непосредственно контролируется определенным участком, называемым геном-оператором. Он служит как бы пусковым механизмом для функционирования структурных генов. Ген-оператор локализован на крайнем отрезке структурного гена или структурных генов, регулируемых им. «Считывание» генетического кода, т.е. формирование мРНК, начинается с промотора – участка ДНК, расположенного рядом с геном-оператором и являющегося точкой инициации для синтеза мРНК, и распространяется последовательно вдоль оператора и структурных генов. Синтезированную молекулу мРНК, кодирующую синтез нескольких разных белков, принято называть полигенным (полицистронным) транскриптом. Координированный одним оператором одиночный ген или группа структурных генов образует оперон. В свою очередь деятельность оперона находится под контролирующим влиянием другого участка цепи ДНК, получившего название гена-регулятора. Структурные гены и ген-регулятор расположены в разных участках цепи ДНК, поэтому связь между ними, как предполагают Ф. Жакоб и Ж. Моно, осуществляется при помощи вещества-посредника, оказавшегося белком и названного репрессором. Образование репрессора происходит в рибосомах ядра на матрице специфической мРНК, синтезированной на гене-регуляторе. Репрессор имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс. Образование такого комплекса приводит к блокированию синтеза мРНК и, следовательно, синтеза белка, т.е. функция гена-регулятора состоит в том, чтобы через белок-репрессор прекращать (запрещать) деятельность структурных генов, синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Если такой индуктор соединяется с репрессором, то последний теряет способность связываться с геном-оператором, который, таким образом, выходит из-под контроля гена-регулятора, и начинается синтез мРНК. Это типичный пример отрицательной формы контроля, когда индуктор, соединяясь с белком-репрессором, вызывает изменения его третичной структуры настолько, что репрессор теряет способность связываться с геном-оператором. Процесс этот аналогичен взаимоотношениям аллостерического центра фермента с эффектором, под влиянием которого изменяется третичная структура фермента и он теряет способность связываться со своим субстратом. Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от функционального состояния репрессора. Если он находится в активном состоянии, т.е. не связан с индуктором, то блокирует ген-оператор и синтеза мРНК не происходит. При поступлении метаболита – индуктора – в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижают его сродство к гену-оператору). Структурные гены выходят из-под запрещающего контроля и начинают синтезировать нужную мРНК. Регуляция экспрессии активности генов у эукариот осуществляется значительно более сложным путем, поскольку процессы транскрипции и трансляции разделены не только пространственно ядерной биомембраной, но и во времени. Эта регуляция базируется как минимум на 6 уровнях сложных биологических процессов, определяющих скорость синтеза и распада генетического продукта. Для большинства эукариотических клеток, как и клеток прокариот, стадия инициации транскрипции является основной, главной регуляторной точкой экспрессии активности генов. Тем не менее имеются существенные различия: во-первых, место процессов транскрипции (в ядре) и трансляции (в цитоплазме); во-вторых, активирование транскрипции у эукариот связано с множеством сложных изменений структуры хроматина в транскрибируемой области; в-третьих, в эукариотических клетках превалируют положительные регуляторные механизмы над отрицательными. Положительная или отрицательная регуляция определяется типом белков, вовлеченных в механизм регуляции. Получены доказательства существования минимум 3 типов белков, участвующих в регуляции процесса инициации транскрипции, опосредованного через РНК-полимеразу: специфические факторы, репрессоры(сайленсеры)и активаторы(энхансеры). Первые вызывают изменение специфичности РНК-полимеразы к данному промотору или группе промоторов; репрессоры связываются с промотором, блокируя тем самым доступ РНК-полимеразы к промотору; активаторы, напротив, связываются вблизи промоторного участка, повышая связывание промотора и РНК-полимеразы. Амплификация (или увеличение числа) генов используется организмом в том случае, когда возникает необходимость увеличить синтез определённого генного продукта. Многие гены, кодирующие белки или РНК, необходимые организму в больших количествах (например, гистоны, рРНК, тРНК), постоянно присутствуют в амплифицированном состоянии. Перестройка генов У высших организмов, так же как и у прокариотов, отмечают процесс обмена, перемещения генов между хромосомами или внутри хромосомы, объединение генов с образованием изменённой хромосомы, которая после таких структурных изменений способна к репликации и транскрипции. Этот процесс получил название "генетическая рекомбинация". У эукариотов рекомбинации наблюдают:
В организме животных существенное значение в обеспечении разнообразия белков играет посттранскрипционный процессинг РНК. Основные способы такой регуляции - альтернативный сплайсинг и изменение стабильности РНК. Альтернативный сплайсинг. Установлено, что многие эукариотические гены, будучи транскрибированы, образуют несколько вариантов зрелой мРНК в ходе процессинга (или созревания) первичного транскрипта, имеющего полиэкзонное строение. Наиболее часто промотор сохраняется на одном из концов транскрипта, а в ходе сплайсинга происходит "вырезание" одного или нескольких экзонов. В других случаях в зрелой мРНК сохраняется часть интрона и включается в состав экзона с 5' или 3'-конца. Сплайсинг может влиять на выбор промотора или участка полиаденилирования. С помощью альтернативного сплайсинга в процессе синтеза антител образуются мембраносвязанные и секреторные формы антител "Редактирование" РНК. Описан ряд случаев, когда первичная структура мРНК изменяется ("редактируется") после транскрипции. Последовательность нуклеотидов в таких генах одинакова, а транскрибируемая в разных тканях мРНК различается в результате появления в молекуле замен, вставок или выпадений нуклеотидов. Пример "редактирования" РНК - образование апопротеина В (апо-В) в клетках печени и тонкого кишечника. Изменение стабильности мРНК. Для того, чтобы участвовать в синтезе белка, мРНК должна выйти из ядра в цитоплазму через ядерные поры. Установлено, что в ядре клеток обычно синтезируется больший набор гетерогенных РНК, чем тот, что выходит в цитоплазму. Многие продукты транскрипции подвергаются расщеплению нуклеазами, а те мРНК, что, транспортируются из ядра в цитоплазму, защищаются от гидролитического разрушения, образуя комплексы с белками. Время жизни эукариотических мРНК значительно больше (t1/2 составляет от нескольких часов до нескольких дней), чем t1/2 мРНК прокариотов, равное нескольким минутам. Очевидно, что стабильность молекул мРНК - фактор, изменение которого влияет на уровень трансляции. Стабилизация мРНК при фиксированной скорости транскрипции приводит к накоплению и увеличению количества образующегося белкового продукта. Описано много примеров регуляции количества синтезирующихся белков за счёт изменения продолжительности функционирования мРНК. Так, стабильность мРНК-матриц для синтеза молекул гистонов сильно зависит от фазы клеточного цикла. В S-фазе гистоны постоянно синтезируются и используются для укладки вновь образованной ДНК в нуклеосомы. Гистоновая мРНК в этот период стабильна в течение нескольких часов. После S-периода, когда ДНК уже не синтезируется, в клетках образуется небольшое количество гистонов, так как они не требуются для формирования нуклеосом. В этот период t1/2 для гистоновой мРНК составляет 10-15 мин. |
