Пептид если от 10 до 40 аминокислот полипептид
 Скачать 7.45 Mb. Скачать 7.45 Mb.
|
45 вопросПути биосинтеза заменимых аминокислот: реакции, ферменты. В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про (рис. 9-23). Углеродный скелет этих аминокислот образуется из глюкозы. α-Аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования.Универсальным донором α-аминогруппы служит глутамат. Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты (см. схему А на с. 492). 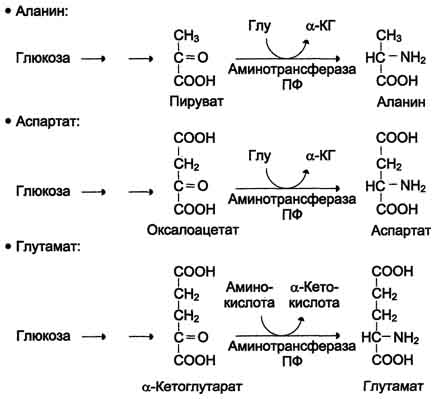 Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой. Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими. 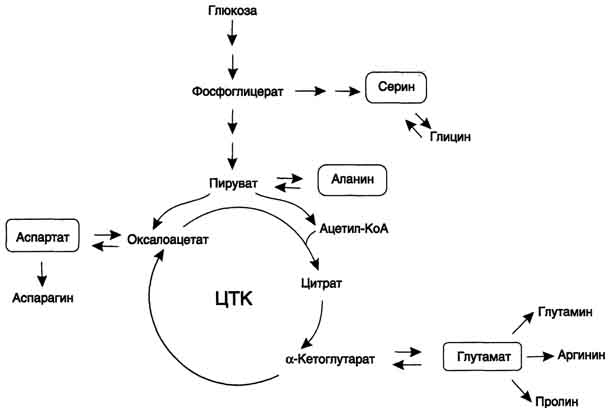 Рис. 9-23. Пути биосинтеза заменимых аминокислот. Амиды глутамин и аспарагин синтезируются из соответствующих дикарбоновых аминокислот Глу и Асп (см. схему А). 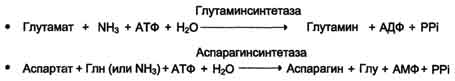
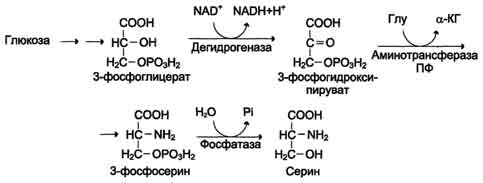
1) из серина с участием производного фолиевой кислоты в результате действия се-риноксиметилтрансферазы: 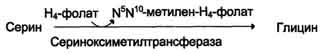 2) в результате действия фермента глицинсинтазы в реакции: 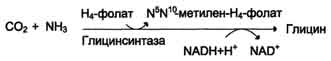
 Кроме восьми перечисленных заменимых аминокислот, в организме человека могут синтезироваться ещё четыре аминокислоты. Частично заменимые аминокислоты Apr и Гис синтезируются сложным путём в небольших количествах. Большая их часть должна поступать с пищей.
 Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно (см. подразделы VIII и IX). Образование других аминокислот также возможно при наличии соответствующих α-кетокислот, которые могут трансаминироваться с глутаматом. Таким образом, незаменимой частью молекулы аминокислот является их углеродный скелет. Источником таких незаменимых ос-кетокислот служат только белки пищи. Исключение составляют лизин и треонин, которые не подвергаются трансаминированию, их а-кетоаналоги с пищей практически не поступают и в организме не синтезируются. Единственный источник этих аминокислот - пищевые белки. 46 вопросПути обмена серина и глицина. Роль серина, глицина и метионина в образовании одноуглеродных фрагментов и реакциях трансметилирования, участие тетрагидрофолиевой кислоты в этих процессах. Недостаточность фолиевой кислоты. Механизм бактериостатического действия сульфаниламидных препаратов. Особенности обмена метионина. S-аденозилметионин-донор метильных групп. Обмен серина и глицина Серин - заменимая аминокислота, синтезируется из промежуточного продукта гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты. Глицин - также заменимая аминокислота, основным источником которой служит серии. Реакцию синтеза глицина из серина катализирует фермент серин-оксиметилтрансфераза, кофермен-том которой является Н4-фолат (см. схему А). 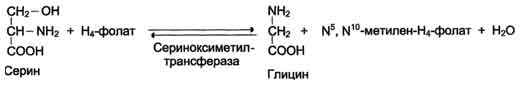 Реакция превращения серина в глицин легко обратима. Основной путь катаболизма глицина у человека и других позвоночных также связан с использованием Н4-фолата (см. схему Б). 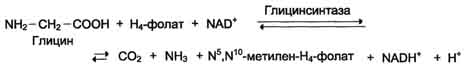 Эта реакция обратима и катализируется глицинсинтазой - ферментным комплексом, похожим на пируватдегидрогеназный комплекс, и локализованным в митохондриях клеток печени. По последним данным глицинрасщепляющая ферментная система несколько отличается от глицинсинтазы и содержит 4 белка: Р-белок, включающий кофермент ПФ, Н-белок, содержащий липоевую кислоту, Т-белок с коферментом Н4-фолат, L-белок, являющийся дигидролипоилдегидрогеназой с коферментом NAD+. 1. Пути метаболизма серина и глицина Аминокислоты серии и глицин выполняют в организме человека разнообразные и очень важные функции. Роль серина и глицина в синтезе многих биологически важных соединений представлена на рис. 9-24. 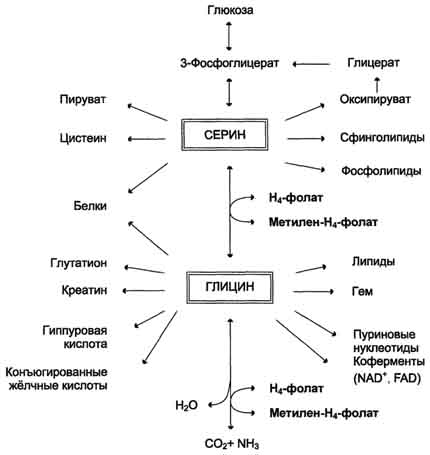 На рисунке видно, что обе аминокислоты необходимы не только для синтеза белков и глюкозы (при её недостатке в клетках), но и нуклеотидов, коферментов, тема, сложных липидов, креатина и других соединений. Многие из этих реакций представлены в соответствующих разделах учебника. Роль фолиевой кислоты в обмене аминокислот В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Этот витамин широко распространён в животных и растительных пищевых продуктах (см. раздел 3). Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот (см. схему А на с. 496). 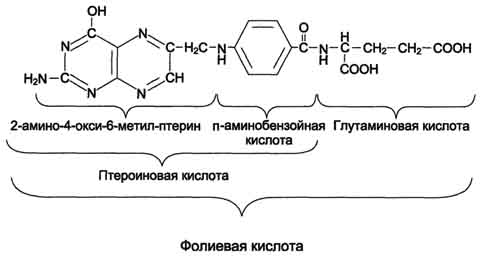 Фолиевую кислоту (фолат) называют также птероилглутаминовой кислотой. Птерины широко распространены в природе. Некоторые из них, например ксантоптерин, являются пигментами глаз и крыльев насекомых (бабочек). Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат) (см. схему Б на с. 496). 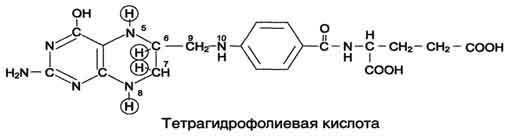 Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH. Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат (см. схему В на с. 496). 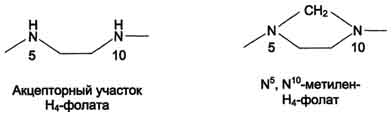 3. Образование и использование одноуглеродных фрагментов Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH) (рис. 9-25). Ещё один источник формального и форми-мино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций (см. схему на с. 498). 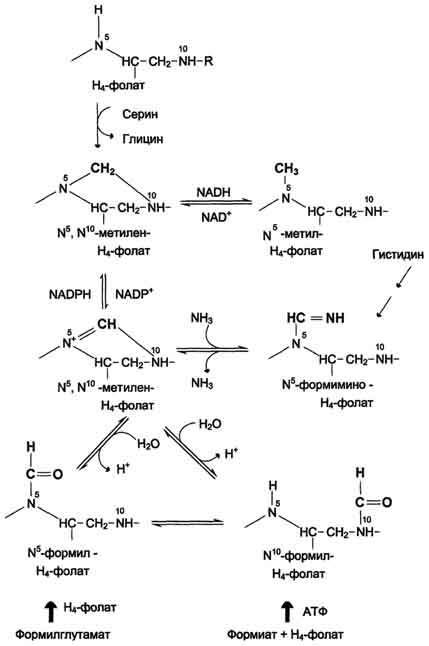 Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат. Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных (формиминоглицина и т.д.) (рис. 9-26). 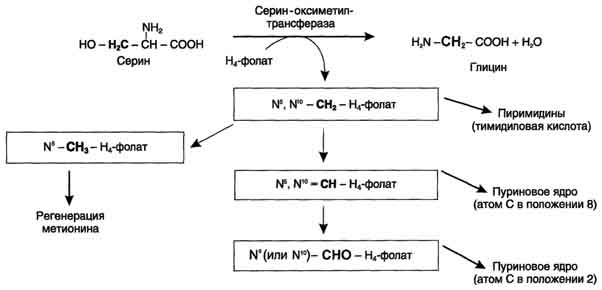 Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени. Недостаточность фолиевой кислоты Недостаточность фолиевой кислоты у человека возникает редко. Гиповитаминоз фолиевой кислоты приводит к нарушению обмена одноуглеродных фрагментов. Такое же нарушение наблюдается и при недостаточности витамина В12, использование которого связано с обменом фолиевой кислоты. Первое проявление дефицита фолиевой кислоты - мегалобластная (макроцитарная) анемия. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина этих симптомов - нарушение синтеза ДНК и РНК из-за недостатка их предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата. Клетки кроветворной ткани быстро делятся, поэтому они в первую очередь реагируют на нарушение синтеза нуклеиновых кислот снижением скорости эритропоэза. Мегалобластная анемия возникает чаще всего в результате недостаточности фолиевой кислоты и/или витамина В12. 5. Механизм антибактериального действия сульфаниламидных препаратов Фолиевая кислота является витамином для человека и животных. Однако многие патогенные бактерии способны синтезировать это соединение, используя парааминобензойную кислоту (ПАБК) - одну из составных частей фолата. ПАБК поступает в бактериальные клетки из внешней среды. Сульфаниламидные лекарственные препараты - производные сульфаниламида (белого стрептоцида), похожи по строению на парааминобензойную кислоту. Отличаются они только радикалами (см. схему на с. 499). 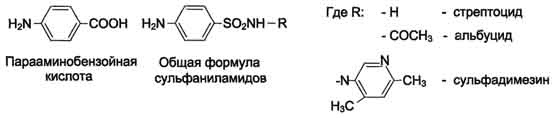 Эти препараты подавляют синтез фолиевой кислоты у бактерий, потому что: конкурентно ингибируют бактериальные ферменты синтеза фолата, так как являются структурными аналогами парааминобензойной кислоты - одного из субстратов процесса; могут использоваться как псевдосубстраты из-за относительной субстратной специфичности ферментов, в результате чего синтезируется соединение, похожее на фолиевую кислоту, но не выполняющее её функции. В обоих случаях в клетках бактерий нарушается обмен одноуглеродных фрагментов и, следовательно, синтез нуклеиновых кислот, что вызывает прекращение размножения бактерий. В клетках больного сульфаниламидные лекарственные вещества не вызывают подобных изменений, поскольку человек получает с пищей готовую фолиевую кислоту. Особенности обмена метионина Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции. Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метальная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты. Реакция активация метионина Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ (см. схему А). Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT) |
