методика преподавания химии. Периодический закон и периодическая система Д. И. Менделеева
 Скачать 448.1 Kb. Скачать 448.1 Kb.
|
|
Li Be B C N O F 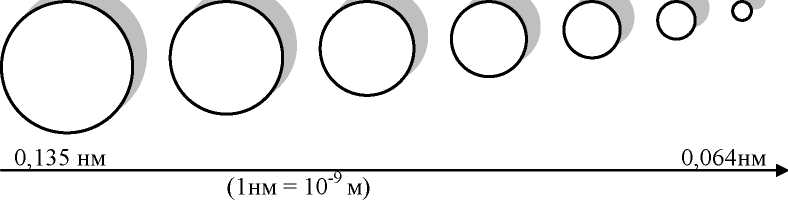 Увеличение заряда ядра (электронная оболочка атомов сжимается), увеличение притяжения e к ядру, увеличение электроотрицательности, восстановительная способность уменьшается, растёт окислительная, переход от металлических свойств через амфотерные к типичным неметаллам. Вертикальное направление (сверху вниз по группе) NaO к О Rb увеличение числа электронных уровней (радиуса атома) уменьшение притяжения e к ядру увеличивается способность отдавать электроны увеличивается восстановительная способность (металлические свойства) уменьшается окислительная способность (неметаллические свойства) Диагональное направление (из левого верхнего угла к нижнему правому) - более короткое, в с Si объединяет отчасти сходные элементы. (слева направо по периоду) Горизонтальные направление (слева - направо): металличность убывает, неметалличность возрастает. По вертикальному направлению (сверху - вниз): нарастание метал- личности. Радиусы атомов увеличиваются, поэтому атомы легче отдают электроны, их восстановительная способность увеличивается, и наоборот, окислительная способность постепенно уменьшается. Диагональное направление, идущее из верхнего левого угла таблицы по направлению к нижнему правому, объединяет элементы отчасти сходные. Пересечение всех 3-х направлений приводит к так называемой звезд- ности (см. кодограмму 5), (термин, введенный в науку А.Е. Ферсманом). Свойства центрального элемента являются средним из свойств элементов, окружающих его. Значение периодического закона и периодической системы химических элементов. Периодический закон и графическое отображение его позволили: а) исправить неверные относительные атомные массы у некоторых химических элементов (например, у Ве с 1 на 9); б) исправить валентности (так, у Ве с III на II); в) предсказать, описать свойства и указать пути открытия еще неизвестных химических элементов. Благодаря периодическому закону были открыты галлий, скандий и германий, предсказанные еще Д.И. Менделеевым под названием экабора, экаалюминия и экасилициума. Периодический закон - величайшее научное обобщение, отображающее всеобщий закон природы. В честь Д.И. Менделеева элемент № 101 назван менделевием. Значение периодического закона Менделеева для диалектико - материалистического понимания природы. Периодический закон подтверждает материальность мира, единство и взаимосвязь элементов. Элементы - ступени развития вещества. Основой их единства и взаимосвязи служит сходство элементарных частиц ( 1 1 р, 1 1 n, е), входящих в состав атомов. Все элементы взаимосвязаны и объединены в группы на основе равного количества валентных электронов (у элементов главных подгрупп сходны электронные структуры) и в периоды на основе равного количества электронных слоев. Эволюция химических элементов возможна потому, что в самом атоме и во всей системе элементов есть противоположные, взаимоисключающие черты. (Внутри атома - 1 1р и е, в периодах и группах - металличность и неметалличность свойств элементов. Единство и «борьба» противоположностей.) Наличие противоположностей, их взаимосвязь и взаимодействие- причина развития. Эволюция, развитие элементов идет путем накопления количественных изменений и перехода их в качественные. (Совершается в виде скачка: 11 1 1р в ядре - это Na, а 12 1 1 р - это Mg...).  ЗВЕЗДНОСТЬ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Пересечение всех 3-х направлений при- водит к звездности. 
(А. Ферсман) Под звездностью системы понимается то, что каждый элемент предстает в окружении четырех главных соседей и четырех второстепенных. 
Схема звездности периодической системы. Свойства центрального элемента являются средними из свойств элементов, окружающих его. Скажи мне, с кем ты дружбу ведешь (т.е. какими элементами окружен), и я скажу тебе, кто ты. Изменение свойств элементов в зависимости от строения атома - причинно-следственная связь. Развитие элементов — поступательное движение от простого к сложному, от низшего к высшему. Каждый последующий элемент заимствует электронную структуру предыдущего и отличается от него на один протон в ядре и электрон в электронной оболочке атома. И это различие обуславливает новизну свойств элемента. Таким образом, проявляется закон отрицания отрицания. Значение периодического закона Менделеева для развития науки и практики. Прогностическое значение закона Менделеева для целенаправленного поиска в природе, а также синтеза новых элементов очень велико. Периодическая система выражает взаимосвязь не только самих элементов, но и образуемых ими простых и сложных веществ, поэтому она является обобщением сведений о веществах вообще. Например
Ряд открытий XX в., определяющих современную цивилизацию, базируется на периодическом законе. Это взаимопревращение элементов и поиск новых путей освобождения ядерной энергии, получение новых изотопов и синтез химических элементов (см. кодограмму 6).  ИЗОТОПЫ Изотопы - это разновидности атомов одного элемента, имеющие одинаковое число про- тонов и различное число нейтронов (различную массу ядра атома). «изос» (греч.) - один, «топос» (греч.) - место Занимающий одно место (клетку) в периодической таблице элементов Д.И.Менделеева. Обозначение изотопов в природной смеси углерод - 12 612C (6 11p 6 o1n) 98,892% углерод - 13 613С (6 11p 7o1n) 1,108% At (C) = 12 * 0,98892 + 13 * 0,01108=12,011 (совпадает с Ar (C) в периодической таблице Д.И.Менделеева.) Химические свойства изотопов практически одинаковы Ф. Энгельс писал о Д.И. Менделееве: «Д.И. Менделеев, выдвинув прогнозы свойств неизвестных еще элементов, совершил научный подвиг, который смело можно поставить рядом с открытием Леверье, вычислившего орбиту еще неизвестной планеты- Нептуна». Открытие ученых должны применяться исключительно в гуманных целях, служить прогрессу общества. На основе познанных законов человек способен преобразовать мир: освоение атомной энергии, использование явлений искусственной и естественной радиоактивности, синтез элементов, отсутствующих на нашей планете. В заключение приводится высказывание А.Е. Ферсмана: «Будут, конечно, появляться и умирать новые теории, блестящие обобщения и новые представления будут сменять устаревшие понятия; величайшие открытия и эксперименты будут далеко превосходить все прошлое и открывать невероятные и по новизне, и широте горизонты, - все это будет приходить и уходить, но периодический закон Менделеева будет всегда жить, развиваться, уточняться и руководить исканиями». Словарь терминов: АКТИНОИДЫ - это 5 f -элементы, обладающие явлением радиоактивности, т. е. испускают невидимые для глаз лучи (аДу). АТОМ - электронейтральная система, состоящая из положительно заряженного ядра ( образованного протонами и нейтронами) и отрицательно заряженных электронов. ГРУППА - это вертикальный столбец химических элементов, расположенных по возрастанию порядкового номера, обладающих однотипным электронным строением и являющихся химическими аналогами (обозначается римской цифрой от I до VIII). ГЛАВНАЯ ПОДГРУППА - в нее входят S и P элементы больших и малых периодов. ЗАРЯД ЯДРА - порядковый номер элемента, определяющий его химические свойства. ИЗОТОПЫ - разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра, но разные массовые числа (одинаковое число протонов, но разное число нейтронов). ЛАНТАНОИДЫ - это 4 f-элементы, открытые после лантана, проявляющие валентность равную III и по свойствам похожие на лантан. МОЛЕКУЛА - это электронейтральная частица, сохраняющая химические свойства данного вещества. НЕЙТРОН - частица, не имеющая заряда, ее масса равна 1. НОМЕР ПЕРИОДА - соответствует числу энергетических уровней (электронных слоев) в атомах элементов данного периода. НОМЕР ГРУППЫ - соответствует числу электронов на внешнем уровне для элементов главных подгрупп и максимальному числу валентных электронов для элементов побочных подгрупп. ОРБИТАЛЬ - пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона 90 %. ПЕРИОД - это горизонтальная последовательность элементов, построенная по возрастанию их порядковых номеров, начинающаяся щелочным металлом и заканчивающаяся галогеном и инертным газом (обозначается арабской цифрой от 1 до 7). ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА - свойства химических элементов и образованных ими веществ находятся в периодической зависимости от их относительных атомных масс. ПЕРИОДИЧЕСКИЙ ЗАКОН - (СОВРЕМЕННАЯ ФОРМУЛИРОВКА) свойства химических элементов и образованных ими веществ находятся в периодической зависимости от зарядов их атомных ядер. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ - это графическое отображение периодического закона. ПОБОЧНАЯ ПОДГРУППА - в нее входят d элементы больших периодов. ПОРЯДКОВЫЙ (АТОМНЫЙ) НОМЕР - указывает на заряд его атомного ядра, на число протонов и на число электронов. ПРОТОН - частица, имеющая массу, приблизительно равную 1 углеродной единице, и заряд ядра +1. РАДИУС АТОМОВ - это расстояние от центра атома до последнего электронного слоя. P - ЭЛЕМЕНТЫ - элементы, у которых идет заполнение соответственно р- орбитали S - ЭЛЕМЕНТЫ - элементы, у которых идет заполнение соответственно s - орбитали ХИМИЧЕСКИЙ ЭЛЕМЕНТ - это вид атомов с одинаковым зарядом ядра, т.е. совокупность изотопов (содержащих одинаковое число протонов). f -ЭЛЕМЕНТЫ - элементы, у которых идет заполнение соответственно f - орбитали. ЭЛЕКТРОН - отрицательная заряженная частица- 1. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ - электроны, обладающие близкими значениями энергии, образующие единый электронный слой. 5. Операционно-познавательный блок Цель закрепления темы: анализ свойств химических элементов и выявление их периодических изменений. 5.1 Закрепление изученного материала. I. Работа студентов с периодической таблицей химических элементов Д.И. Менделеева (табл. 3, 4); каждый студент характеризует химический элемент по плану (см. кодограмму 7). Работа студентов с новой терминологией по теме занятия. Самостоятельная работа студентов с кодограммами [8], рисунками (рис. c 1 по 11, приложение Б). Знакомство с интерактивной периодической таблицей химических элементов Д.И. Менделеева с возможностью наглядной классификации элементов. Просмотр презентаций по теме: «Периодический закон и периодическая система Д. И. Менделеева». Работа с карточками [5, 11]. Смысловая группировка материала. Задание №1. Закончите предложения в листе рассказа и перескажите его. Лист рассказа «Периодический закон и строение атома» 1. Главная характеристика атома ... . 2. Заряд ядра численно совпадает: а) с... ; б) с... и определяется числом ... . 3. Изотопы - это ... . 4. Химический элемент — это ... . 5. Физический смысл порядкового номера химического элемента .... 6. Электроны располагаются по электронным слоям, которые могут быть: а) ... ; б)... ; в) ... ; г) .... 7. На внешнем электронном слое может находиться не более ... . 8. Максимальное число электронов на внутренних электронных слоях можно рассчитать по формуле ... . 9. Постепенное изменение свойств в малых периодах связано с .... 10. Для строения атомов металлов характерно: а)... ; б)... . 11. Для строения атомов неметаллов характерно: а) ... ; б)... . 12. Для строения атомов инертных элементов характерно: а)...; б) .... 13. Скачкообразное изменение свойств от F к Ne вызвано .... 14. Скачкообразное изменение свойств от № к № объясняется ... . 15. Физический смысл номера периода ... . 16. У атомов элементов главных подгрупп число электронов на внешнем электронном слое численно совпадает с ... . 17. В главных подгруппах сверху вниз свойства химических элементов изменяются так: ... , потому что ... . Задание №2. Составьте рассказ по ключевым словам так, чтобы каждое предложение начиналось с ключевого слова: атом; ядро; протон; ней- трон; электронная оболочка; электроны. Пример составления рассказа по ключевому слову «атом». атом - мельчайшая частица химического элемента; атом входит в состав молекулы; атом - нейтральная частица; атом - сложная система, состоящая из положительного ядра и вращающихся вокруг него электронов и т.д. Аналогичная работа ведется с каждым последующим ключевым словом. |


