методика преподавания химии. Периодический закон и периодическая система Д. И. Менделеева
 Скачать 448.1 Kb. Скачать 448.1 Kb.
|
|
ПЛАН ХАРАКТЕРИСТИКИ ХИМИЧЕСКОГО ЭЛЕМЕНТА ПО ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА I. Положение элемента в периодической системе: порядковый номер период, номер группа, подгруппа относительная атомная масса II. Строение атома элемента: заряд ядра атома формула состава атома (количество 11 p, 01n, e) количество энергетических уровней и размещение на них электронов (е) формула электронной конфигурации (1S22S...) квантовые ячейки число е на последнем слое => металл или неметалл III. Формулы соединений: оксида гидроксида (кислоты или основания) летучего водородного соединения (для неметаллов) IV. Химический характер, его доказательства: кислотный: кислотный оксид+щелочъ=солъ+вода кислота+основание=солъ+вода основный: основный оксид+кислота=солъ+вода основание+кислота=солъ+вода амфотерный (a+b) V. Сравнение с соседями: а) по периоду b) по группе (металл с неметаллами сравниватъ нелъзя) Способ создания образа       масса заряд обо зна чение Строение атома *• масса заряд обо зна чение Задание №3. Заполните схему, используя следующие понятия и обозначения (подсказка дана в кодограммах 8): масса очень мала; электрон — e; протон — 1 1 p; нейтрон — x0n; ядро; электронный слой. Сформулируйте вывод, закончив предложения.  л. Атом электронейтрален, т.к. Масса атома сосредоточена в ... . Ядро атома имеет ... заряд.     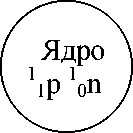           Число Протонов ( \р ) I Заряд ядра Общее число электронов ("е ) £ Атом электронейтрален e 1/1840 а.е.м. 1е - 3е металлы Т Y Внутренние Внешний слои (N=2n2) слой (N<8e) -► 4е - 7е неметаллы Масса Атома 8е инертные химиче ские элементы 2е - Не Задание № 4. Озвучьте схему «Строение атома».  АТОМНОЕ ЯДРО (Протонно-нейтронная теория Д. Иваненко, Е. Гапон 1932г.) Ядро атомов имеет сложное строение. Ядро состоит из протонов и нейтронов. Оно заряжено положительно. Протон Нейтрон  1, 673 * 1024г 1,675 * 1024г Элементарная частица, имеющая массу приблизительно 1а.е.м. Заряд  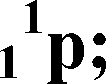   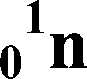 0 Обозначается 1ТТ iH +1 Число протонов в ядре атома элемента строго определенно (равно порядковому номеру элемента в периодической системе Z). Число нейтронов в ядре атома одного и того же элемента может быть различным (равно A-Z, где A - относительная атомная масса элемента, Z - порядковый номер). Заряд ядра атома определяется зарядом протонов. Масса ядра атома определяется суммой масс протонов и нейтронов. С т о н и 1 8 9 1 г. Электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. Он назвал эту частицу «электрон» («электрон» (греч.) - «янтарь») Через несколько лет Д.Томсон и Ж. Перрен определили, что электроны несут отрицательный заряд. Д. Томсон определил скорость и массу электрона. Электрон - отрицательно заряженная частица. Его заряд численно равен, но противоположен по знаку, заряду протона (-1) Масса очень мала, приблизительно равна 1/1840 а.е.м. (9,109* 10-28 г.)   обозначается ЭЛЕКТРОН e, o-i e Число электронов в атоме равно числу протонов. (Определяется по порядковому номеру элемента в периодической системе элементов -Z) В 1924 г. Луи де Бройль установил двойственную природу электрона - волна и частица Блок контроля эффективности обучения Цель контроля эффективности обучения: закрепить знания, полученные о периодическом законе и периодической системе; раскрыть их сущность, усвоить правила пользования периодической таблицей. План контроля эффективности обучения 6.1. Проверка теоретических знаний [13-14]. При наличии времени - освещение следующих вопросов ( предлагаются варианты вопросов, дифференцированных заданий). Докажите, что Периодический закон Д.И. Менделеева, как и любой другой закон природы, выполняет объясняющую и предсказательную функции. Приведите примеры, иллюстрирующие эти функции и примеры других законов, известных из курсов химии, физики, биологии. Назовите химический элемент, в атоме которого электроны располагаются по уровням согласно ряду чисел 2;5; Какое простое вещество образует этот элемент? Бериллий раньше относили к элементам, соответствующим III группе, его относительная атомная масса считалась равной 13,5. Почему Д.И. Менделеев перенес его во II группу и исправил атомную массу бериллия с 13,5 на 9? Написать уравнение реакции между простыми веществами (см. в решении). Расположите в порядке возрастания металлических свойств следующие элементы: А&, Sb, N, Р, Bi. Обоснуйте полученный ряд, исходя из строения атомов этих элементов. Расположите в порядке возрастания неметаллических свойств следующие элементы: Si, А1, Р, S, С1, М§, №. Обоснуйте полученный ряд, исходя из строения атомов этих элементов. Рассмотрите в порядке уменьшения кислотных свойств следующие оксиды: SiO2, Р 2 O5, А12Оз,№ 2 О, М§О, С1 2 O 7. Обоснуйте полученный ряд, запишите формулы гидроксидов, соответствующих этим оксидам. Как изменяется их кислотный характер в предложенном вами ряду? 8.Запишите формулы оксидов бора, бериллия и лития и расположите их в порядке возрастания основных свойств. Запишите формулы гидроксидов, соответствующих этим оксидам. Каков их химический характер? 9.Что такое изотопы? Как открытие изотопов способствовало становлению периодического закона? Почему заряды атомных ядер элементов в периодической системе меняются монотонно? Приведите три формулировки периодического закона. Работа с карточками [5, 15]. Выделение логической схемы. Задание № 1. Разложите карточки со словами «увеличение», «уменьшение», «усиление», «ослабление» в соответствующие кармашки плаката. Сделайте вывод о закономерностях изменения свойств в малых периодах.
Задача № 2. Укажите соответствие между данными, обозначенными цифрами и буквами. Элементы VI группы, главной подгруппы, третьего периода. Элементы VI группы, побочной подгруппы, четвертого периода, четного ряда. Элементы четвертого периода, образует летучее водородное соединение с формулой H2R. Общая формула высших оксидов элементов III группы. Общая формула летучих водородов соединений элементов VII группы. Общая формула высших оксидов элементов VI группы. Общая формула летучих водородных соединений элементов VI группы. RO3 Б) Se Сг Г) S Д) H2R Е) HR Ж) R2O3 Выделение логической связи Задание №3. Характеристики элемента с зарядом ядра +11.Дайте ответ в логической последовательности.
6.3. Самостоятельная работа [17]. вариант. Расположите элементы в порядке возрастания их металлических свойств: а) цезий; б) барий; в) германий; г) стронций; д) кальций. Расположите формулы летучих H соединений элементов № 33, 15, 17, 16 в порядке усиления их устойчивости. Приведите по две формулы: а) гидроксидов, менее основных, чем NaOH; б) гидроксидов, более основных, чем NaOH; в) оксидов, более кислотных, чем высший оксид элемента № 15. Высшая валентность какого из этих элементов не соответствует номеру группы: а) Au (№ 79); б) Zn (№ 30); в) H (№ 1)? вариант. Расположите элементы в порядке возрастания их неметаллических свойств: а) олово; б) кислород; в) сера; г) теллур; д) селен. Расположите формулы летучих H соединений элементов IV группы. Какое из них самое устойчивое? Самое неустойчивое? Приведите по два примера формул оксидов: а) более кислотных, чем оксид элемента № 34; б) более основных, чем оксид элемента № 38. Высшая валентность какого из этих элементов не соответствует номеру группы: а) Cu (№ 29); б) Os (№ 76); в) Au (№ 79)? вариант. Расположите гидроксиды в порядке увеличения их металлических свойств: а) CsOH; б) KOH; в) Fe(OH)3; г) Ca(OH)2; д) Fe(OH)2. Приведите примеры двух элементов: а) более неметаллических, чем S; б) менее неметаллических, чем S; в) более неметаллических, чем Mg; г) менее неметаллических, чем Mg. Расположите формулы летучих H соединений: а) элементов III периода. Какое из них самое устойчивое? Самое неустойчивое? б) элементов VII группы. Какое из них самое устойчивое? Самое неустойчивое? Высшая валентность какого из этих элементов не соответствует номеру группы: а) V (№ 23); б) Cu (№ 29); в) Si (№ 14)? вариант. Расположите оксиды в порядке уменьшения их кислотных свойств: Методическое пособие 1 1.Введение 6 2.Методический блок 7 ГОРИЗОНТАЛЬНОЕ НАПРАВЛЕНИЕ 28 Вертикальное направление 28 к О Rb 28 Диагональное направление 28 Протон Нейтрон 41 Заряд 41 +1 41 Обозначается 41 iH 41 e, o-i e 42 6.4 Подведение итогов занятия 49 Приложения А. Эталоны ответов. 52 Расположите элементы в порядке возрастания их неметаллических свойств: а) кислород; б) полоний; в) сера; г) селен; д) теллур. Приведите по два примера элементов: а) более металличных, чем №20; б) образующих более основные оксиды, чем №3. в) образующих менее устойчивые летучие Н-соединения, чем элемент № 16. У какого из приведенных элементов высшая валентность не соответствует номеру группы: а) Cd (№ 48); б) F (№ 9); в) Al (№13)? вариант Расположите оксиды в порядке возрастания кислотных свойств: а) MgO; б) Al2O2; в) N2O5 ; г) В2Oз; д) CO2; Расположите элементы в порядке ослабления их металлических свойств: а) калий; б) мышьяк; в) кальций; г) германий; д) селен. Приведите по два примера элементов: а) образующих более кислотные оксиды, чем элемент №15; б) образующих более основные гидроксиды, чем №19; в) образующих более устойчивые летучие Н-соединения, чем №33. У какого из приведенных элементов высшая валентность соответствует номеру группы: а) Au (№79); б) F (№ 9); в) бп (№50); ^Fe (№ 26)? вариант Расположите гидроксиды в порядке увеличения их свойств: а) Si(OH)4; б) KOH; в) А1(ОН)з; г) Ca(OH)2; д) Mg(OH)2. Приведите по два примера элементов: а) образующих более устойчивые Н-соединения, чем элемент №33; б) образующих более кислотные высшие оксиды, чем элемент №14; в) образующих более основные гидроксиды, чем элемент №12. Приведите формулы высших оксидов элементов №14, 16, 53. Какой из них более кислотный? Подчеркните. Высшая валентность какого из этих элементов соответствует номеру группы: а) Fe (№ 26); б) Не (№ 2); в) Sb (№ 51)? 6.4 Подведение итогов занятия Оценка достижения целей и выполнения поставленных задач. Коррекция ошибок. Преподаватель предлагает студентам сформулировать вывод и выделить важные моменты, на которые необходимо обратить внимание при выполнении домашнего задания. Основные положения занятия. Периодический закон отражает диалектику свойств химических элементов, раскрывает материальное единство вещества, является орудием его познания и преобразования. Периодическая система химических элементов, разработанная Д.И. Менделеевым на основе открытого им периодического закона, отражает взаимосвязь не только самих элементов, но и образуемых ими простых и сложных веществ, поэтому она является обобщением сведений о веществах вообще. Общий вывод занятия Закон и система Д.И. Менделеева лежат в основе совершенного учения о строении вещества, играют первостепенную роль в изучении всего многообразия химических веществ в синтезе новых элементов. Свойства химических элементов и их соединений находятся в периодической зависимости от величины заряда их атомов и конфигурации энергетических уровней. Карта для подсчета рейтингового балла и самооценки.
Итого: Итого: Критерии оценок (например из 10 вопросов): 10 правильных ответов - 5 7,6 правильных ответов - 3 9,8 правильных ответов - 4 5 правильных ответов - 2 Разноуровневая домашняя работа [16,19] (по выбору студентов, приведен пример) Задания минимального уровня | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
