1704 химия. Периодический закон и периодическая система химических элементов Д. И. Менделеева
 Скачать 26.11 Kb. Скачать 26.11 Kb.
|
|
I КУРС Периодический закон и периодическая система химических элементов Д.И. Менделеева 1. Из записанных ниже электронных формул атомов выберите ту, которая характерна для атома меди: а) 1S22S22P63S23P63d104S2 б) 1S22S22P63S23P63d104S1 в) 1S22S22P63S23P64S1 г) 1S22S22P63S23P63d84S2 2. Химический элемент электронная формула которого 1S22Р22P63S23P63d104S24P5 в периодической системе распложен? а) в III периоде, II группе, главной подгруппе б) в IV периоде, I группе, побочной подгруппе в) в IV периоде, VII группе, главной подгруппе г) в IV периоде, VII группе, побочной подгруппе Электрическая диссоциация 1. Сокращенное ионное уравнение реакции: 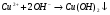 соответствует взаимодействию веществ а) 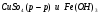 б) 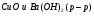 в) 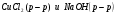 г) 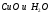 2. Сумма всех коэффициентов в полном и сокращенном ионном уравнении реакции Na2CO3 и H2SO4 в растворе равна: а) 10 и 4 б) 11 и 5 в) 12 и 6 г) 13 и 7 Химические связи 1. Определите вид химической связи в соединении, формула которого KCl а) ионная б) металлическая в) ковалентная полярная г) ковалентная неполярная 2. Ковалентная связь между атомами имеет место в веществе: а) MgCl2 б)H2S в)CaS г)K3P 3. В каком из соединений между атомами образуется ковалентная связь по донорно-акцепторному механизму: а) KCl б)NH4Cl в)CCl4 г)CO2 Гидролиз солей 1. При растворении карбоната натрия в воде среда становится: а) щелочной б) кислой в) нейтральной г) щелочной, кислой или нейтральной в зависимости от температуры и давления 2. Какие соли подвергаются гидролизу? а) BaCl2 б) NaNO3 в) K3PO4 г) Na2SO4 3. Укажите среду водных растворов следующих солей Fe(NO3)2 а) рН=7 б) рН >7 в) рН <7 K2S а) рН =7 б) рН >7 в) рН <7 LiCl а) рН =7 б) рН >7 в) рН <7 Диссоциация воды. Водородный показатель 1. Растворы кислот окрашивают в красный цвет: а) лакмус б) фенолфталеин в) метиловый оранжевый г) все указные индикаторы 2. В щелочной среде: а) лакмус имеет синий цвет б) фенолфталеин имеет малиновый цвет в) метиловый оранжевый индикатор имеет желтый цвет г) все эти утверждения справедливы 3. Чему равен рН 0,01 М раствора гидроксида калия: а) 0,01 б) 2 в) 10 г) 12 Растворы. Растворимость веществ. Количественные характеристики. 1.Массовая доля сульфата натрия в растворе, полученном растворением 10 г его десятиводного кристаллогидрата в 100 г воды, равна: а) 4,0 % б) 4,4 % в) 9,0 % г) 10 % 2. Как правило растворимость твердых веществ в жидкостях растет: а) с повышением температуры б) с понижением температуры в) с повышением температуры и давления г) с понижением температуры и давления 3. Для приготовления раствора с массовой долей гидроксида натрия, 6 % к 200 г раствора с массовой долей гидроксида натрия 30% необходимо прилить воды массой (г): а) 300 г б) 500 г в) 800 г г) 1000 г Окислительно-восстановительные реакции 1. В реакции протекающей по схеме: Cr2S3+KNO3+Na2CO3→K2CrO4+NO+CO2+Na2SO4 окислению подвергаются элементы следующего ряда: а) N, S б) S, Cr в) C, N г) Cr, N 2. Сколько электронов переходит при превращениях: Al0→Al+3 а) 5 б) 2 в) 1 г) 3 N-3→N+5 а) 8 б) 6 в) 2 г) 1 3. Сумма коэффициентов в правой части уравнения реакции KMnO4+HCl→MnCl2+KCl+H2O+Cl2 равна: а) 4 б)8 в) 17 г) 18 Электролиз растворов и расплавов 1. При электролизе водного раствора смеси CuSO4 в нейтральной среде: а) металлическая медь б) металлическая медь и молекулярный водород в) металлическая медь и молекулярный кислород г) металлическая медь и серная кислота 2. При электролизе расплава NaCl образуются: а) металлический натрий и ионы хлора б) ионы натрия и газообразный хлор в) металлический натрий и газообразный хлор г) газообразный хлор и водород Неметаллы. Свойства 1. Галогены являются сильными окислителями, потому что: а) атом галогена легко присоединяет один электрон б) атомы галогенов энергично присоединяют два электрона в) атомы галогенов энергично отдают один электрон г) образуют соединения с кислородом 2. В атмосфере хлора горят: а) Na, Fe, Cu б) O2, NA, Fe в) Fe, Cu, Au г) F2, Fe, Cu 3. Для начала цепной реакции хлороводорода необходимо: а) нагревание смеси газов Н2 и Cl2 б) освещение смеси газов H2 и Cl2 в) освещение или нагревание смеси газов H2 и Cl2 г) присутствие катализаторов Молекулы. Свойства. 1. Однажды на складе были испорчены алюминиевые изделия из-за того, что проводилась побелка потолка гашеной известью, а детали не были надежно защищены от попадания брызг. Порча изделий объясняется тем, что а) детали были загрязнены побелочным раствором б) произошло химическое взаимодействие изделий с раствором гашеной извести в) детали прокорродировали на воздухе в присутствии влаги г) произошло химическое взаимодействие изделий с водой Запишите уравнение химической реакции (в случае химического взаимодействия) 2. В электротехнике для производства ламп накаливания используют металлическую нить из: а) Al б) Cu в) Fe г) W 3. В Ферганской долине была найдена руда, из которой получили металл, необходимый не только в технике, но и в общечеловеческой культуре. Ученые Кыргызстана получили этот металл такой чистоты, что на Всемирной выставке в Брюсселе он был признан лучшим металлом в мире и утвержден международным эталоном. Этот металл в соединениях проявляет переменную валентность, одна из которых равна трем. В оксиде металла с такой валентностью его содержится 83,53% Этот оксид: а) Ga2O3 б) In2O3 в) Sb2O3 г) Bi2O3 в своих соединениях этот металл может проявлять еще валентность: а) 1 б) 2 в) 4 г) 5 4. Контакты некоторых радиодеталей покрывают слоем золота это делается: а) для повышения прочности изделия б) для повышения стоимости изделия в) для предохранения от окисления г) для защиты от радиопомех 6. В 18-каратном золотом изделии массовая доля (%) золота: а) 25 б) 50 в) 75 г) 100 7. Какой из компонентов загрязненного городского воздуха коррозионно-активным по отношению к металлам, особенно при повышенной влажности: а) СО2 б) N2 в) CO г) SO2 8. Зимой во время гололеда обледенелую дорогу посыпают NaCl (поваренная соль) или CaCl2 (хлорид кальция), при этом лед тает. Это объясняется тем, что а) образуется раствор, температура замерзания которого выше, чем у растворителя б) образуется раствор, температура замерзания которого ниже, чем у растворителя в) происходит выделение теплоты г) происходит поглощение теплоты |
