СОП фальсиф. Персонал и ответственность. Сотрудники организации несут ответственность в пределах своей компетенции. Главный врач
 Скачать 0.56 Mb. Скачать 0.56 Mb.
|
|
Целью СОПа является минимизация рисков поступления фальсифицированных, недоброкачественных и контрафактных лекарственных средств (далее в тексте ЛС) и медицинских изделий (далее в тексте МИ). Область применения: Где: ГБУЗ РК «Сысольская ЦРБ». Когда: ежедневно. Ответственность: медсестра, ответственная за лекарственное обеспечение; провизор. Персонал и ответственность. Сотрудники организации несут ответственность в пределах своей компетенции. Главный врач отвечает: – за обеспечение необходимыми ресурсами для функционирования всех процессов работы по отслеживанию фальсифицированных, контрафактных, недоброкачественных лекарственных препаратов и медицинских изделий с целью соблюдения лицензионных требований, санитарно-эпидемиологических требований, установленных законодательством Российской Федерации; Медсестра по лек.обеспечению и провизор: Ежедневно проверять все сведения о закупленных и имеющихся остатках лекарственных средств и медицинских изделий по информации Росздравнадзора на его сайте (http://www.roszdravnadzor.ru). Письма (или отчеты) о проведенном поиске и забраковке сохранять в рабочем компьютере, в отдельной папке. Перемещают фальсифицированные, недоброкачественные, контрафактные ЛС и МИ в карантинную зону. Подают информацию о проведенных мероприятиях по каждому факту выявления ЛС или МИ, подлежащих изъятию из обращения. Несут ответственность за принятие мер к своевременному изъятию из обращения, возврату поставщику (либо уничтожение) лекарственных средств и медицинских изделий, качество которых не соответствует требованиям нормативной документации, а также фальсифицированных, недоброкачественных и контрафактных лекарственных средств – в соответствии с информацией Росздравнадзора. Описание процедуры. 1. Общие положения. Настоящая инструкция устанавливает порядок отслеживания фальсифицированных, недоброкачественных, контрафактных лекарственных препаратов и медицинских изделий в ГБУЗ РК «Сысольская ЦРБ». Исполнение и соблюдение этих требований обеспечивает сохранность качества реализуемой продукции, ее безопасность и эффективность для дальнейшего медицинского применения. В данной СОП рассматриваются ЛС и МИ, поступившие от поставщиков, имеющих лицензию на фармацевтическую деятельность. 2. Порядок сбора и анализа информации о состоянии качества лекарственных средств, поступивших в обращение на территории субъекта РФ в медицинские и аптечные организации. Недоброкачественные лекарственные средства, контрафактные и фальсифицированные лекарственные средства подлежат изъятию и уничтожению из аптеки согласно решению Федеральной службы по надзору в сфере здравоохранения; Федеральная служба по надзору в сфере здравоохранения в случае выявления фактов ввоза на территорию Российской Федерации или фактов обращения на территории Российской Федерации недоброкачественных лекарственных средств, контрафактных и фальсифицированных лекарственных средств принимает решение, обязывающее владельца указанных лекарственных средств осуществить их изъятие, уничтожение и вывоз в полном объеме с территории Российской Федерации. Указанное решение должно содержать: а) сведения о лекарственных средствах; б) основания изъятия и уничтожения лекарственных средств; в) срок изъятия и уничтожения лекарственных средств; г) сведения о владельце лекарственных средств; д) сведения о производителе лекарственных средств; Для отслеживания фальсифицированных, недоброкачественных, контрафактных лекарственных средств и медицинских изделий необходимо лично просматривать письма, размещенные на сайте www.roszdravnadzor.ru Федеральной службы по надзору в сфере здравоохранения; Для лекарственных препаратов это сервис «Поиск изъятых из обращения лекарственных средств»: http://www.roszdravnadzor.ru/services/lssearch. Для медицинских изделий – информационные письма о медицинских изделиях: http://www.roszdravnadzor.ru/services/unreg; Недоброкачественные лекарственные средства, фальсифицированные лекарственные средства и контрафактные лекарственные средства подлежат уничтожению. 3. Порядок отслеживания фальсифицированных, недоброкачественных, контрафактных лекарственных средств и медицинских изделий. Для обнаружения фальсифицированных, недоброкачественных, контрафактных лекарственных средств необходимо на сайте Росздравнадзора http://www.roszdravnadzor.ru/services/lssearch в сервисе «Поиск изъятых из обращения лекарственных средств» набрать наименование лекарственного препарата. 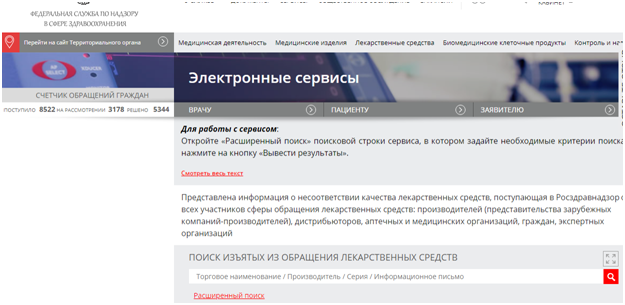 В случае если лекарственный препарат забракован, появится информация о забраковке. 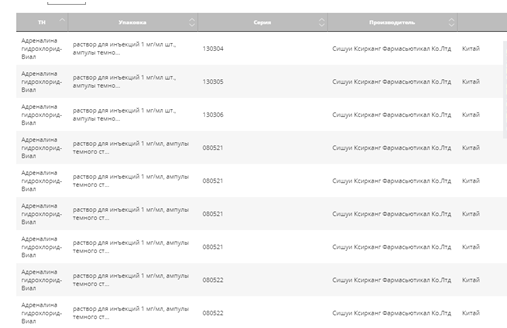 Открыть письмо о лекарственном препарате.  Указанный лекарственный препарат поместить в соответствующую карантинную зону. Информацию о забраковке также можно получить, просматривая информационные письма Росздравнадзора. Для обнаружения фальсифицированных, недоброкачественных, контрафактных медицинских изделий необходимо обратиться к сайту с информационными письмами о медицинских изделиях: http://www.roszdravnadzor.ru/services/unreg. 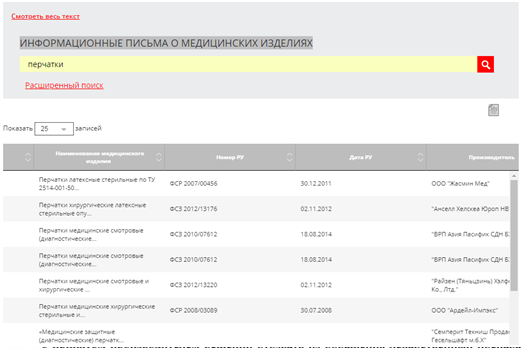 Поиск проводить по номеру регистрационного удостоверения, затем открыть письмо.  Передача информации в Территориальный орган Росздравнадзора. В срок до 10 дней необходимо направить информацию о проведенных мероприятиях, указанных в письмах Росздравнадзора и (или) запросах территориального органа, по каждому факту выявления ЛП в организации на адрес электронной почты: info@reg11.roszdravnadzor.ru В случае если в письме указан иной срок предоставления информации в ТО Росздравнадзора, информация должна быть отправлена к указанному сроку. Для передачи информации о выявлении на складе ГЛФ и МИ, предписанных к изъятию из обращения и приостановленных сериях, партиях ЛП ответственное лицо заполняет табличную форму в формате word. В случае выявления в обращении МИ, указанных в письмах Росздравнадзора и запросах территориального органа, в срок до 10 дней (если в письме нет указания об ином сроке предоставления информации) на адрес электронной почты info@reg11.roszdravnadzor.ru. необходимо направить оперативную информацию по установленной форме (приложение 1). Приложение № 1 К приказу ________ от «___» _______2021 года Форма информации о проведенных мероприятиях по каждому факту выявления ЛС или МИ, подлежащих изъятию из обращения.
Нормативные ссылки. 1. Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». 2. Приказ Министерства здравоохранения от 31.08.2016 № 647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». 3. Приказ Министерства здравоохранения от 31.08.2016 № 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения». 4. Постановление Правительства РФ от 15.09.2020 № 1447 «Об утверждении правил уничтожения изъятых фальсифицированных лекарственных средств, недоброкачественных лекарственных средств и контрафактных лекарственных средств» 5.Федеральный закон от 27.12.2002 № 184-ФЗ «О техническом регулировании» (с изменениями и дополнениями). 7. Приказ Министерства здравоохранения от 13.08.2020 № 844н «Об утверждении типового положения о территориальном органе Федеральной службы по надзору в сфере здравоохранения». |
