Получение серной кислоты контактным и нитрозным методами
 Скачать 157.23 Kb. Скачать 157.23 Kb.
|
|
Муниципальное бюджетное общеобразовательное учреждение Отрадненская средняя общеобразовательная школа РЕФЕРАТ на тему «Получение серной кислоты контактным и нитрозным методами» Работу выполнила: ученица 11 класса Леонова Т учитель химии и биологии Корбукова Н.М. 2018 Содержание Введение…………………………………………………………………….3 Серная кислота: химические свойства и применение…………….4 Сырьевая база для производства серной кислоты………………...9 Производство серной кислоты……………………………………...11 Контактный способ производства серной кислоты……………...11 Нитрозный способ производства серной кислоты……………….16 Производство серной кислоты и охрана окружающей среды……20 Заключение………………………………………………………………….22 Список использованной литературы………………………………………24 ВВЕДЕНИЕ «Едва ли найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота. Где нет заводов для ее добывания - немыслимо выгодное производство многих других веществ, имеющих важное технические значение» Д.И. Менделеев Серная кислота является одним из важнейших компонентов в производстве многих товаров: минеральных удобрений, химических волокон, красителей, цветных металлов, резинотехнических изделий и пластмасс, всевозможных химикатов и бумажно-целлюлозных изделий. О важном месте серной кислоты в мировой экономике говорит тот факт, что за четверть столетия ее производство выросло более чем в три раза и в настоящее время составляет более 200 млн. тонн в год. Потребление серной кислоты, наряду с потреблением нефти, черных и цветных металлов, является важнейшим индикатором, характеризующим экономическую мощь государства. Неслучайно крупнейшими потребителями серной кислоты являются США и Китай с долями, соответственно, 21% и 19%. Серная кислота является важнейшим продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей, солей, минеральных удобрений и хлора. По разнообразию применения серная кислота занимает первое место среди кислот. Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений. Будучи нелетучей кислотой, серная кислота используется для получения других кислот — соляной, плавиковой, фосфорной, уксусной и т. д. Много ее идет для очистки нефтепродуктов — бензина, керосина и смазочных масел — от вредных примесей. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрытием (никелированием, хромированием и др.). Серная кислота применяется в производстве взрывчатых веществ, искусственного волокна, красителей, пластмасс и многих других. Ее употребляют для заливки аккумуляторов. В сельском хозяйстве она используется для борьбы с сорняками (гербицид). Таким образом, по разнообразию применения серная кислота занимает первое место среди кислот. 1. Серная кислота: свойства и применение Серная кислота – тяжелая бесцветная маслянистая жидкость, растворяющаяся в воде в любых соотношениях. Она гигроскопичная, нелетучая, без запаха, не проводит электрический ток. При температуре 10,3°C затвердевает, образуя кристаллы, похожие на лёд. Температура кипения составляет 296,2 ° С, при дальнейшем повышении температуры она разлагается. Плотность 1,83 г/мл (200 °С). Это молекулярное вещество, относящееся к сильным двухосновным кислотам. Растворы SO3 в серной кислоте называют олеумом, они образуют два соединения H2SO4•SO3 и H2SO4•2SO3. Олеум содержит также пиросерную кислоту, получающуюся по реакции: Н2SO4+ SO3=H2S2O7. Химические свойства серной кислоты во многом зависят от её концентрации. В лабораториях и промышленности применяют разбавленную и концентрированную серную кислоту, хотя это деление условно (четкую границу между ними провести нельзя). Взаимодействие с металлами Разбавленная серная кислота взаимодействует с некоторыми металлами, например с железом, цинком, магнием, с выделением водорода: Fe + H2SО4= FeSO4+ H2↑ Некоторые малоактивные металлы, такие как медь, серебро, золото, с разбавленной серной кислотой не реагируют. Концентрированная серная кислота является сильным окислителем. Она окисляет многие металлы. Продуктами восстановления кислоты обычно является оксид серы (IV), сероводород и сера (H2S и S образуется в реакциях кислоты с активными металлами: магнием, кальцием, натрием, калием и др.). Примеры реакций: Cu+2H2SO4=CuSO4+SO2+2H2O Mg+2H2SO4=MgSO4+SO2+2H2O или 4Mg+5H2SO4=4MgSO4+H2S+4H2O Серная кислота высокой концентрации (практически безводная) не взаимодействует с железом в результате пассивации металла. Явление пассивации связано с образованием на поверхности металла прочной сплошной пленки, состоящей из оксидов или других любых соединений, которая препятствует контакту металла с кислотой. Благодаря пассивации можно перевозить и хранить концентрированную серную кислоту в стальной таре. Концентрированная серная кислота пассивирует также алюминий, никель, хром, титан. Взаимодействие с неметаллами Концентрированная серная кислота может окислять неметаллы, например: S + 2H2SO4= 3SO2+ 2H2O Окислительные свойства концентрированной серной кислоты могут также проявляться с некоторыми сложными веществами – восстановителями, например: 2KBr+2H2SO4=Br2+SO2+K2SO4+2H2O Взаимодействие с основными оксидами и основаниями. Серная кислота проявляет все типичные свойства кислот. Так, она реагирует с основными и амфотерными оксидами и гидроксидами с образованием солей. Как двухосновная кислота H2SO4 образует два типа солей: средние соли – сульфаты и кислые соли – гидросульфаты. Примеры реакций: Al2O3+3H2SO4=Al2(SO4)3+3H2O — сульфат алюминия 2KOH+H2SO4=K2SO4+2H2O — сульфат калия KOH+H2SO4=KHSO4+H2O — гидросульфат калия Гидросульфаты образуются, когда кислота берётся в избытке. Многие соли серной кислоты выделяются из растворов виде кристаллогидратов, например: Al2(SO4)3∙18H2O; Na2SO4∙10H2O Взаимодействие с солями С некоторыми солями кислота вступает в реакции обмена, например: CaCO3+ H2SO4= CaSO4+ CO2+ H2O BaCl2+ H2SO4= ВаSO4+ 2HCl Последняя реакция является качественной на серную кислоту и ее соли: об их присутствии в растворе судят по образованию белого осадка BaSO4, который практически не растворяется в концентрированной азотной кислоте. Взаимодействие с водой. При растворении в воде серная кислота активно взаимодействует с ней образуя гидраты: nH2O + H2SO4= H2SO4∙ nH2O, где n = 1, 2, 3, 4 и 6,5. Схема применения серной кислоты (рис.1) 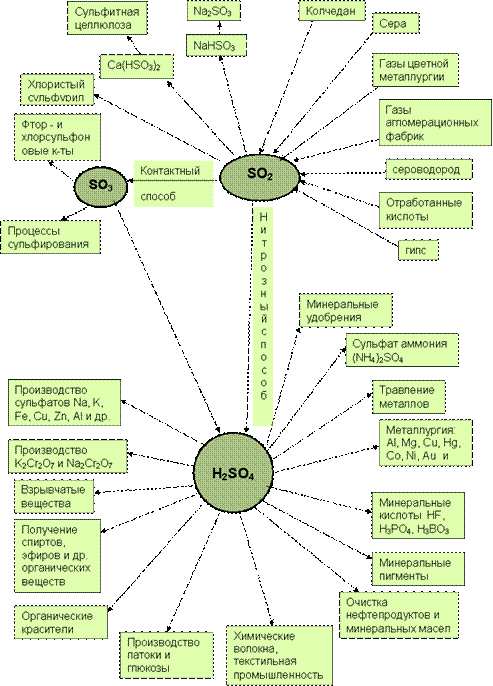 Рисунок 1 — Основные направления использования серной кислоты Серная кислота находит самое широкое применение. Самый крупный потребитель серной кислоты - производство минеральных удобрений. На 1 т Р2О5 фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH4)2SO4 - 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений. Серная кислота также используется для получения соляной, азотной, фосфорной, плавиковой и многих органических кислот методом обмена, органических сульфосоединений, для очистки различных газов, входит в состав нитрующих смесей, используется в производстве красителей, для зарядки аккумуляторов, в металлургии серную кислоту применяют для обнаружения микротрещин в готовой продукции, на металлообрабатывающих заводах серную кислоту используют в цехах гальванопокрытий. Как известно, перед нанесением на металлические изделия электрическим методом никеля, хрома, меди их нужно тщательно очистить, протереть, обезжирить и, наконец, выдержать непродолжительное время в ванне с раствором серной кислоты. При этом она растворяет тончайший слой металла и с ним удаляются следы загрязнений. В то же время поверхность металла становится более шершавой: на ней появляются микроскопические углубления и выступы. Электролитические покрытия к такой поверхности лучше пристают и более прочно сцеплены с металлом. Также серная кислота необходима для переработки различных руд и ископаемых. При переработке руд редких металлов большое значение имеет кислотный способ их расщепления. Обычно для этой цели используют наиболее дешевую нелетучую серную кислоту. Измельченную руду смешивают в определенной пропорции с серной кислотой и нагревают. Полученный раствор и осадок дальше перерабатывают химическим путем, исходя из химических свойств того элемента, который нужно выделить из раствора. На химическую переработку руд редких элементов расходуют тысячи тонн серной кислоты. Большое количество серной кислоты требуется нефтеперерабатывающей промышленности для очистки нефти и ее различных фракций. В органическом синтезе концентрированная серная кислота - необходимый компонент при получении многих красителей и лекарственных веществ. Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль Nа2SO4 * 10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4 * 2Н2О) и безводной соли ангидрита (Са SO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600-700 оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а также искусственного мрамора, бесшовных настилов полов и др. Сульфат магния, или горькая соль (МgSO4*7Н2О) применяется в медицине как слабительное. Сульфат железа (II), или железный купорос (FеSO4*7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4*5Н2О) применяется для борьбы с различными грибками - вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди. Из растворов, содержащих сульфат трехвалентного металла (Fе3+, Аl3+, Сг3+) и сульфат одновалентного металла (К+, NН4+, Rb+), выкристаллизовываются двойные соли типа К2 SO4Al2(SO4)32*4H2O или КАl(SO4)3*12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, т. е. как смесь сульфатов одно- и трехвалентных металлов. Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ. Сырьевая база для производства серной кислоты Сырьем для производства серной кислоты могут быть различные серосодержащие вещества, но наибольшее практическое значение имеют колчедан, элементарная сера, сернистые газы цветной металлургии, сжигания угля, очистки нефти. Колчедан получают в основном как побочный продукт флотационного обогащения. Он имеет низкую себестоимость, хорошую транспортабельность, что делает его основным сырьем в сернокислотном производстве. Основу флотационного колчедана составляет пирит (FeS2), содержащий до 45% железа и серу. В нем имеются также сульфиды мышьяка, селена и др., которые образуют газообразные соединения, попадают в сернистые газы и ухудшают их качество. Поэтому сернистые газы требуют дополнительной очистки, что усложняет технологическую схему производства. Достаточно распространенное сырье — элементарная сера. Она наиболее концентрированный серосодержащий ресурс. В результате более эффективны дальние перевозки, снижается расход сырья на выпуск единицы продукции более чем в 2 раза по сравнению с колчеданом. Процесс производства кислоты проще, требует меньших удельных капвложений, экологичнее. Чистая сера имеет достаточную тепловую способность (10000 кдж/кг), что позволяет при получении сернистого газа использовать ее не только как сырье для кислоты, но и как источник энергии в теплоэнергоблоках для собственных производственных целей и поставки другим потребителям (рис.1).Однако запасы элементарной серы в природе ограничены, асебестоимость ее добычи высокая. Это обусловливает повышенную стоимость конечного продукта по сравнению с кислотой, полученной из колчедана. Наиболее эффективное сырье для выпуска кислоты - сернистые газы цветной металлургии, очистки нефти, сероводород природного газа. Себестоимость тонны кислоты из них в 2,5 - 6 раз меньше, чем из элементарной серы и колчедана, сам процесс достаточно экологичен, а в окружающую среду в результате утилизации серы не попадают вредные соединения. Техногенные выбросы серы в атмосферу вдвое превышают ее мировую добычу в качестве сырья для промышленности. Значительные запасы серы в сульфатах - гипсе, ангидриде. Однако эти виды сырья менее эффективны из-за больших энергетических затрат в производстве. ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ Серную кислоту в промышленности производят двумя способами: контактным и нитрозным. 3.1 Контактный способ производства серной кислоты Серную кислоту контактным способом производят в больших количествах на сернокислотных заводах. В настоящее время этот способ является основным, т.к. имеет преимущества перед другими: - получение продукта в виде чистой концентрированной кислоты, приемлемой для всех потребителей; - уменьшение выбросов вредных веществ в атмосферу с выхлопными газами. Рассмотрим схему получения серной кислоты (рис. 2) 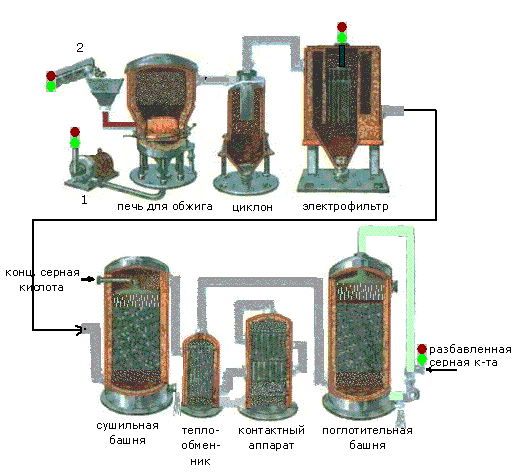 Рисунок 2 — Процесс получения серной кислоты (источник) Процесс состоит из трех стадий.
В общем виде весь вышеизложенный материал можно изобразить следующим образом (рис. 2): 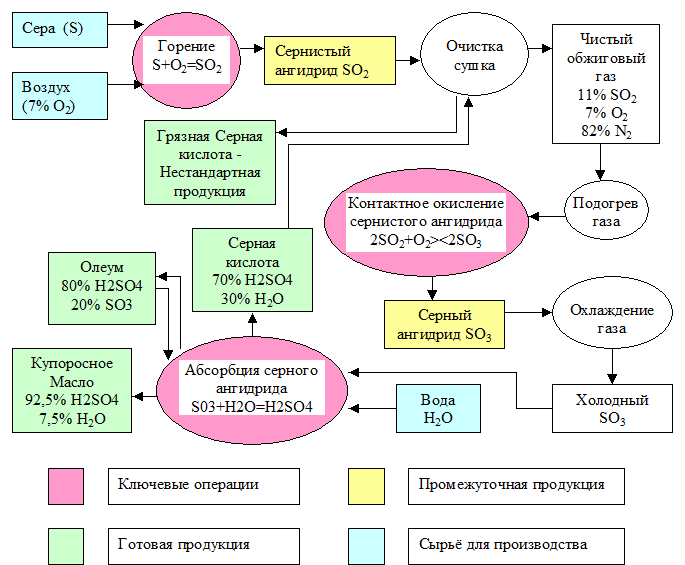 Рисунок 3 — Производство серной кислоты контактным способом Важнейшие тенденции развития производства серной кислоты контактным способом: 1) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов; 2) упрощение способов очистки газа от пыли и контактных ядов (более короткая технологическая схема); 3) увеличение мощности аппаратуры; 4) комплексная автоматизация производства; 5) снижение расходных коэффициентов по сырью и использование в качестве сырья серосодержащих отходов различных производств; 6) обезвреживание отходящих газов. 3.2 Нитрозный способ производства серной кислоты Для производства серной кислоты используется и другой, так называемый нитрозный, способ её получения. На первой стадии, одинаковой для обоих методов, получают сернистый ангидрид SO2. Полученный SO2 окисляют до H2SO4, используется для этого в нитрозном методе окислы азота. С этой стадии оба метода отличаются друг от друга. На рис. 3 изображена принципиальная схема производства серной кислоты башенным способом. 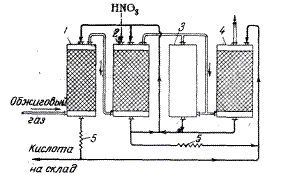 1 – денитрационная башня; 2 – продукционная башня; 3 – окислительная башня; 4 – абсорбционная башня; 5 – холодильники кислоты Рисунок 4 — Принципиальная схема башенной системы В специальной окислительной башне 3 смешивают окись азота NO и NO2 с воздухом в таком соотношении, чтобы в газовой смеси находилась половина имеющихся NO и NO2. 2NO + O2 → 2NO2 В результате газовая смесь содержит равные NO и NO2. Она подаётся в башни 4 и 5, орошаемые 75%-ной серной кислотой; здесь смесь окислов азота поглощается с образованием нитрозиллерной кислоты: NO + NO2 + 2H2SO4 →2NO(HSO4) + H2O Раствор нитрозиллерной кислоты в серной кислоте, называемый нитрозой, орошает башни 1 и 2, куда противотоком поступает SO2 и добавляется вода. В результате гидролизанитрозиллерной кислоты образуется азотистая кислота: NO(HSO4) + H2O→H2SO4 + HNO2 Она и окисляет SO2 по уравнению: SO2 + 2HNO2→H2SO4 + 2NO В нижней части башен 1 и 2 накапливается 75%-ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество её меряется с выхлопными газами, приходится добавлять в систему HNO3, служащую источником окислов азота. Недостаток башенного метода состоит в том, что полученная серная кислота имеет концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз нитрозиллерной кислоты). Концентрирование же серной кислоты упариванием представляет дополнительную трудность. Преимущество этого метода в том, что примеси содержащиеся в SO2, не влияют на ход процесса, так что исходный SO2 достаточно очистить от пыли, т.е. механических загрязнений. Естественно, башенная серная кислота бывает недостаточно чистой, что ограничивает её применение. Технологическая схема производства серной кислоты башенным способом На рис. 4 изображена принципиальная схема производства серной кислоты башенным способом. Первая башня, в которую поступает горячий обжиговый газ, предназначена для выделения окислов азота из кислоты, орошающей башню. Этот процесс называется денитрацией серной кислоты, а башня 1 носит название денитрационной. Около 1/3 денитрованной кислоты, вытекающей из этой башни, передается на склад как готовая продукция, а остальное поступает на орошение последней башни 4. Денитрационная башня орошается небольшим количеством серной кислоты, поэтому кислота в ней сильно нагревается, что способствует выделению окислов азота. Одновременно с денитрацией кислоты в башне 1 сернистый ангидрид частично абсорбируется серной кислотой и окисляется окислами азота. По характеру протекающих процессов первую башню можно схематически разделить на три зоны. В нижней зоне происходит упаривание серной кислоты с выделением водяных паров в газовую фазу, в средней зоне окислы азота выделяются из нитрозы вследствие наибольшего ее разбавления, в верхней зоне конденсируются поступающие снизу пары воды и, следовательно, происходит разбавление нитрозы и частичное окисление растворяющегося в ней SO2. Строгого разделения перечисленных процессов по зонам провести нельзя, так как частично они совмещаются друг с другом. Кроме этих процессов, в первой башне из газа улавливаются также остатки пыли, поглощаются мышьяковистый ангидрид и двуокись селена, конденсируются пары серной кислоты (образуются из SO3, присутствующего в обжиговом газе), происходит образование сернокислотного тумана и др. Туман лишь частично поглощается в первой башне, большая его часть поступает в последующие башни системы, где вследствие большой суммарной поверхности частиц тумана он существенно влияет на протекающие в башнях процессы. Готовую продукцию в башенных системах отводят только из денитрационной башни, где почти полностью улавливаются все примеси обжигового газа, поэтому башенная кислота загрязнена мышьяком, селеном, огарковой пылью и другими примесями. Основное назначение второй башни — абсорбция сернистого ангидрида из обжигового газа серной кислотой и окисление SO2 нитрозой. В этой башне образуется большая часть серной кислоты (70 — 80% продукции системы), поэтому ее часто называют продукционной башней. Процесс кислотообразования протекает по всей высоте башни 2, однако основное количество сернистого ангидрида окисляется в ее нижней части, где условия наиболее благоприятны для этого процесса. Окислы азота, выделяющиеся из нитрозы при окислении SO2, частично поглощаются в верхней части башни орошающей ее нитрозой, но большая часть окислов поступает вместе с газовым потоком в окислительную башню 3. Здесь окисляется такое количество окиси азота, которое требуется, чтобы соотношение между NO и NO2 было наиболее благоприятным для поглощения их в абсорбционных башнях. В башне 3 NO окисляется кислородом, содержащимся в газе. Степень окисления окислов азота в этой башне регулируют, пропуская часть газа по обводному газопроводу помимо башни (байпас). Из окислительной башни газ поступает в башню 4, где окислы азота поглощаются орошающей ее серной кислотой; эту башню называют абсорбционной или поглотительной. При охлаждении обжигового газа и образовании серной кислоты выделяется большое количество тепла, поэтому в денитрационной и продукционных башнях орошающая кислота нагревается и перед возвратом на орошение ее приходится охлаждать. Для этого установлены холодильники 5. В процессе производства башенной кислоты неизбежны потери окислов азота с отходящими газами, с продукционной кислотой и др. Для восполнения этих потерь в продукционную башню 2 подается азотная кислота. Вода, необходимая для образования серной кислоты, вводится в денитрационную и продукционную башни 1 и 2 Производство серной кислоты и охрана окружающей среды Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде. Например, отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках экологического кризиса. Вредные выбросы сернокислых заводов следует оценивать не только по действию содержащегося в них оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие факторы - увеличение количества случаев респираторных заболеваний человека и животных, гибель растительности и подавление ее роста, разрушение конструкций из известняка и мрамора, повышение коррозионного износа металлов. По вине кислых дождей повреждены памятники архитектуры (Тадж-Макал). В зоне до 300 км от источника загрязнения (SO2) опасность представляет серная кислота, в зоне до 600 км. — сульфаты. Серная кислота и сульфаты замедляют рост с/х культур. Закисление водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо экологического ущерба налицо экономический ущерб — громадные суммы каждый год теряются при раскисление почв. В отходящих газах сернокислотных систем, работающих при атмосферном давлении и с однократным контактированием, содержится около 0,2% оксида серы(IV), около 0,007% оксида серы(VI) и брызги серной кислоты. Для очистки от оксида серы(IV) газ пропускают через башню, орошаемую раствором бисульфита аммония, а для улавливания оксида серы(VI) и брызг кислоты – через электрофильтр. Применяют и другие методы, например, добавляют озон, который окисляет оксид серы(IV). При двойном контактировании, с промежуточным удалением из газовой смеси оксида серы(VI), степень окисления оксида серы(IV) достигает 99,7%, и содержание его в отходящих газах уменьшается почти в 10 раз по сравнению с содержанием в отходящих газах после однократного контактирования. Кроме самих соединений серы экологические проблемы могут вызывать и соединения, находящиеся в составе серосодержащих руд. Например, селен, который входит в состав серосодержащих руд и выделяется в атмосферу при обжиге пирита. Селен может заменять серу в аминокислотах (метионине, цистеине, цистине) и включаться в обмен веществ. Избыток селена в растениях (до 5•10–6 %) вызывает облысение овец и болезни их копыт, выпадение перьев у птиц, нарушение координации движений у животных. Другой отход производства – пиритный огарок. Огромные его количества занимают значительные территории пахотных земель, сильно запыляют атмосферу, создавая тем самым угрозу для здоровья людей. Кислотные осадки во многих районах мира настолько повысили кислотность озер, что жизнь их обитателей оказалась под угрозой. Борьба с этим явлением до сих пор сводилась к внесению в воду извести. Однако ее применение имеет целый ряд недостатков. Известь – вещество едкое, может вызвать ожоги у рабочих, занимающихся ее внесением, у рыб и растений, а также гибель микроорганизмов; растворение извести и ее нейтрализация приводит к местному разогреву воды, что вызывает кислородное обеднение воды; существенно повышается жесткость воды. Предлагаются другие способы борьбы с повышенной кислотностью воды в озерах. Один из них – применение некоторых отходов пищевой отрасли промышленности. Этот способ позволяет решить одновременно две проблемы: утилизации отходов и понижения кислотности природных вод. Другой способ разработан группой специалистов из канадской компании «Диборн Кемикал», возглавляемой химиками Дж.Кейнсом и Д.Янгом. Они предложили вместо извести вносить в озера некий строительный материал, обладающий такой же эффективностью в понижении кислотности. Его отличие заключается в том, что он существенно медленнее реагирует с кислотой и не вызывает нежелательных последствий. Предлагают такой способ понижения кислотности – применение яичной скорлупы, в состав которой входит карбонат кальция. Это позволяет избежать ожогов и местного разогрева воды – первые два пункта из перечня отрицательных последствий известкования водоемов. Однако большой проблемы в утилизации скорлупы не существует: ее используют для снижения кислотности почвы, а также дают курам для увеличения прочности скорлупы яиц. Еще одним способом может быть внесение в водоемы уже ненужных в строительстве изделий из бетона. В состав цемента входят обладающие основными свойствами компоненты, которые будут медленно реагировать с содержащейся в воде кислотой. Заключение В работе рассмотрены теоретические аспекты производства серной кислоты. Описаны технологические схемы и процессы, протекающие на каждой стадии. Серная кислота применяется в разнообразных производствах химической промышленности: минеральных удобрений, пластмасс, красителей, искусственных волокон, минеральных кислот, моющих средств; в нефтяной и нефтехимической промышленности: для очистки нефти, получения парафинов; в цветной металлургии: для получения цветных металлов - цинка, меди, никеля и др. в черной металлургии: для травления металлов; в целлюлозно-бумажной, пищевой и легкой промышленности (для получения крахмала, патоки, отбеливания тканей) и т.д. Серную кислоту в промышленности производят двумя способами: контактным и нитрозным. В настоящее время основным методом производства серной кислоты является контактный, т.к. этот метод имеет преимущества перед другими: - получение продукта в виде чистой концентрированной кислоты, приемлемой для всех потребителей; - уменьшение выбросов вредных веществ в атмосферу с выхлопными газами. Список использованной литературы Кузьменко Н.Е., Еремин В.В, Попов В.А. Химия для школьников и поступающих в вузы. М.: Дрофа, 1999. Хомченко Г.П. Химия для поступающих в вузы. М.: Высшая школа, 1994. Володин В.А. Энциклопедия для детей. Том 17 Химия. М.: Аванта+, 2000. Таблица 1 «Сырье для производства серной кислоты» (составлена автором по источнику автор и год)
|
