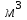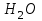Получение серной кислоты контактным способом
 Скачать 298.05 Kb. Скачать 298.05 Kb.
|
|
Министерство науки и высшего образования Российской Федерации федеральное государственное бюджетное образовательное учреждение высшего образования «Иркутский государственный университет» (ФГБОУ ВО «ИГУ») Химический факультет Учебный технологический регламент Получение серной кислоты контактным способом
Иркутск – 2020 Содержание Введение……………………………………………………….……………3 Общая характеристика производства………………………..…………....4 Характеристика изготовляемой продукции……………………………...6 Характеристика исходного сырья…………………………………………8 Описание технологического процесса…………………………………..10 Технологическая схема…………………………………………………...12 Материальный баланс……………………………………….…………....13 Охрана окружающей среды…………………………...…………………16 Список литературы………………………………………………..……..18 Введение Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это двумя причинами: ее дешевизной по сравнению со всеми другими кислотами, и ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из сильных кислот, в широком диапазоне температур (– 40… – 20 260 – 336,5°C) находится в жидком состоянии. Крупнейшими потребителями серной кислоты являются производства минеральных удобрений: суперфосфата, сульфата аммония. Многие кислоты (фосфорная, уксусная, соляная, концентрированная азотная и др.) и соли производятся в значительной части при помощи серной кислоты. Серная кислота широко применяется в производстве цветных и редких металлов, а также в металлообрабатывающей промышленности. Получение ряда красителей (для тканей), лаков и красок (для зданий и машин) лекарственных веществ и некоторых пластмасс также связано с применением серной кислоты. При помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры, ПАВ, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными травами. Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ. Общая характеристика производства В настоящее время в промышленности применяют два метода окисления диоксида серы в производстве серной кислоты: контактный — с использованием твердых катализаторов, и нитрозный (башенный), в котором в качестве катализатора используют оксиды азота. Контактный способ вследствие высокой эффективности (производительность, компактность, чистота и стоимость продукта и др.) вытесняет нитрозный. Контактный способ производства серной кислоты включает три стадии: очистку газа от вредных для катализатора примесей; контактное окисление сернистого ангидрида в серный; абсорбцию серного ангидрида серной кислотой. Главной стадией является контактное окисление SO2 в SO3; по названию этой операции именуется и весь способ. Контактное окисление сернистого ангидрида является типичным примером гетерогенного окислительного экзотермического катализа. Это один из наиболее изученных каталитических синтезов. Равновесие обратимой реакции 2SO2+O2=2SO3+193,4кДж(500оС) в соответствии с принципом Ле-Шателье сдвигается в сторону образования SO3 при понижении температуры и повышении давления; соответственно увеличивается равновесная степень превращения SO2 в SO3 Следует отметить, что повышение давления естественно увеличивает и скорость реакции . Однако повышенное давление в этом процессе применять нерационально, так как кроме реагирующих газов пришлось бы сжимать балластный азот, составляющий обычно 80 % от всей смеси и поэтому в производственном цикле активно используют катализаторы. Наиболее активным катализатором является платина, однако она вышла из употребления вследствие дороговизны и легкой отравляемости примесями обжигового газа, особенно мышьяком. Окись железа дешевая, но при обычном составе газа - 7% SO2 и 11% О2 она проявляет каталитическую активность только при температурах выше 625 оС. Ванадиевый катализатор менее активен, чем платиновый, но дешевле и отравляется соединениями мышьяка в несколько тысяч раз меньше, чем платина; он оказался наиболее рациональным и только он применяется в производстве серной кислоты. Ванадиевая контактная масса содержит в среднем 7% V2O5; активаторами являются окислы щелочных металлов, обычно применяют активатор К2О; носителем служат пористые алюмосиликаты. В настоящий момент катализатор применятся в виде соединения SiO2, K и/или Cs, V в различных пропорциях. Такое соединение оказалось наиболее устойчивым к кислоте и наиболее стабильным. Во всем мире его более корректное названия «ванадий - содержащий». Такой катализатор разработан специально для работы с невысокими температурами, что приводит в меньшим выбросам в атмосферу. Кроме того - такой катализ дешевле нежели калий/ванадиевый. При условиях катализа окись калия превращается в K2S2O7, а контактная масса в общем представляет собой пористый носитель, поверхность и поры которого смочены пленкой раствора пятиокиси ванадия в жидком пиросульфате калия. Ванадиевая контактная масса эксплуатируется при температурах от 400 до 600 оС. При увеличении температуры выше 600 оС начинается необратимое снижение активности катализатора вследствие спекания компонентов с образованием неактивных соединений, не растворимых в пиросульфате калия. При понижении температуры активность катализатора резко снижается вследствие превращения пятивалентного ванадия в четырехвалентный с образованием малоактивного ванадила VOSO4. Характеристика изготовляемой продукции. По физико-химическим показателям серная кислота должна соответствовать нормам, указанным в таблице 1. Табл.1. Физико-химические показатели.
Характеристика исходного сырья, материалов и полупродуктов. Табл.2
Табл.3
Описание технологического процесса. Печной газ с температурой 300-400 проходит через сухой электрофильтр 1 и поступает в промывную башню 2, орошаемую кислотой. Здесь газ охлаждается и частично освобождается от тумана серной кислоты и соединений мышьяка и селена. Вытекающую из башни кислоту охлаждают и перекачивают обратно в эту же башню для орошения. После промывной башни газ проходит через два мокрых электрофильтра 3, где почти нацело улавливаются соединения мышьяка, селена и туман серной кислоты, не поглотившиеся в промывной башне 1. Пройдя через увлажнительную башню 4, газ в следующих электрофильтрах 3 окончательно освобождается от примесей мышьяка и селена. Из мокрых электрофильтров газ поступает в сушильную башню 5, орошаемую серной кислотой высокой концентрации, где освобождается от влаги; отсюда турбокомпрессором 6 через фильтр 7 его подают в контактный узел. Контактный узел состоит из пускового подогревателя 8, двух теплообменников 9 и 12 и двух контактный аппаратов 10 и 11. При пуске системы, для первоначального нагрева катализатора и аппаратов пользуются нагретым в подогревателе 8 воздухом и очищенным газом. При нормальной работе газ последовательно проходит через оба теплообменника 9 и 12, где подогревается за счет тепла горячих газов, идущих противотоком из контактных аппаратов. Из теплообменника 12 газ поступает в первый контактный аппарат 11, где в присутствии катализатора SO2 окисляется 75-80% в SO3. Из первого контактного аппарата горячий газ, пройдя через трубы теплообменника 12, частично охлаждается и поступает во второй контактный аппарат 10, где окисляется остальное количество SO2. Прореагировавший газ, частично охлажденный в теплообменнике 9 за счет нагревания поступающего свежего газа, направляют для дальнейшего охлаждения в холодильники 13 и далее на абсорбцию. Абсорбция SO3 осуществляется в двух башнях-абсорберах 14 и 15, заполненных керамиковыми кольцами. Отработанные газы, пройдя ловушку 16 для задержания брызг кислоты, уходят в атмосферу. Первый абсорбер 14 (олеумный) орошают олеумом, а второй 15 (моногидратный) – 98%- ной серной кислотой. Вытекающую из абсорберов кислоту, проходящую через сборники 17, перекачивают насосами 18 через холодильники 19 обратно на абсорбцию. Для поддержания постоянной концентрации кислоты, орошающей каждый абсорбер0 в сборник первого абсорбера все время добавляют кислоту из цикла орошения второго абсорбера, а в сборник второго абсорбера – кислоту, вытекающую из сушильной башни. Готовую кислоту отбирают и отправляют на склад или сливают в железнодорожные цистерны для отправки потребителям. Технологическая схема 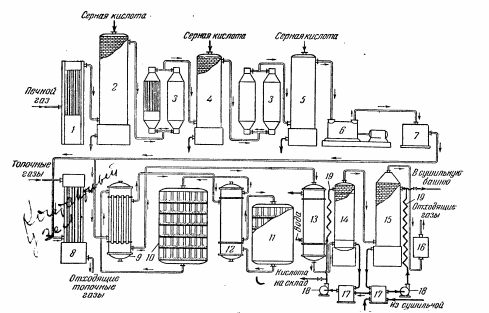 Материальный баланс Расчет материального баланса печи КС Исходные данные для расчета Интенсивность работы печи I, кг/(м2 сут)………………….10 000 Количество сжигаемого сухого колчедана, содержащего 41% серы, 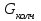 , кг/ч …………………………………………18 768 , кг/ч …………………………………………18 768Производительность печи (100% 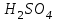 ) ) 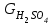 , т/ч ………20,833 , т/ч ………20,833Степень использования серы 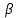 …………………………….0,885 …………………………….0,885Расход сухого колчедана (45% S) на 1 т 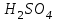 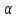 , т …………0,82 , т …………0,82Содержание, % серы в колчедане 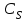 ………………………………………41 ………………………………………41влаги в колчедане 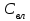 ………………………………………6 ………………………………………6серы в огарке 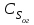 …………………………………………...1 …………………………………………...1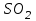 в сухом обжиговом газе в сухом обжиговом газе 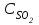 ……………………….14,5 ……………………….14,5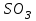 в сухом обжиговом газе в сухом обжиговом газе 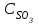 …………………………0,1 …………………………0,1Температура ºС: Колчедана 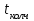 …………………………………………...20 …………………………………………...20Воздуха 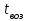 ……………………………………………….20 ……………………………………………….20Обжигового газа на выходе из печи 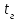 ………………..850 ………………..850Огарка 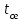 ………………………………………………..850 ………………………………………………..850Относительная влажность воздуха 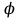 , % ……………………...50 , % ……………………...50Процесс горения колчедана 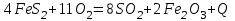 Расчет Общее содержание серы в колчедане 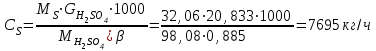 Количество сухого колчедана 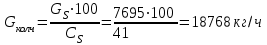 Количество влаги в колчедане 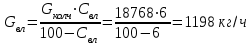 Количество огарка 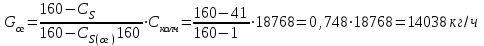 Количество серы в огарке 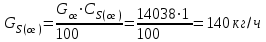 Потери серы с огарком 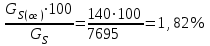 Количество выгоревшей серы 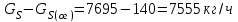 Общий объем  + + 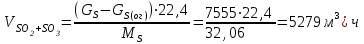 Объем 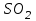 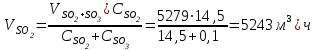 Объем 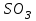 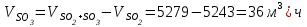 Концентрация кислорода в обжиговом газе определяется по формуле 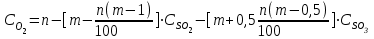 где n- содержание кислорода в воздухе (21%), m- стехиометрическое соотношение числа молекул кислорода к числу молекул диоксида серы, по балансовому уравнению (m=11:8=1,375) 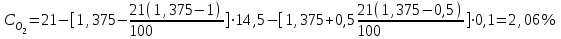 Объем сухого обжигового газа 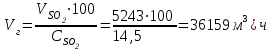 Объем азота в обжиговом газе 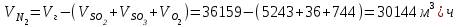 Объем сухого воздуха, поступающего на обжиг колчедана (воздух содержит 79% 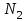 ) ) Объем паров в воздухе (при 20ºС и относительной влажности воздуха   давление паров воды в нем равно давление паров воды в нем равно  ) )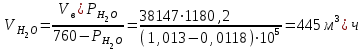 Общий объем паров в обжиговом газе 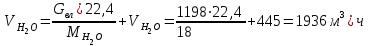 Таблица материального баланса печи КС (на часовую производительность печи)
Объем производства серной кислоты в год: 500 тонн в месяц. 500 т/мес. = 684,931 кг/ч = 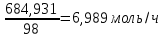 , а следовательно столько же молей и всех остальных веществ, участвующих в реакции. Исходя из этого для такого объема производства потребуется 6,989 моль/ч FеS2 или 3354,72 кг/ч. , а следовательно столько же молей и всех остальных веществ, участвующих в реакции. Исходя из этого для такого объема производства потребуется 6,989 моль/ч FеS2 или 3354,72 кг/ч. Охраны окружающей средыСогласно ГОСТу 2184-2013, должны выполняться следующие требования по охране окружающей среды: Предельно допустимая концентрация паров серной кислоты в атмосферном воздухе не должна превышать 0,3 мг/м  (максимально разовая) и 0,1 мг/м (максимально разовая) и 0,1 мг/м (среднесуточная), что соответствует 2-му классу опасности (среднесуточная), что соответствует 2-му классу опасности . . Перечень нормативных документов, действующих в Российской Федерации, представлен в приложении Б. Перечень нормативных документов, действующих в Российской Федерации, представлен в приложении Б.Предельно допустимая концентрация сульфатов Предельно допустимая концентрация серной кислоты (по сере) в почве не должна превышать 160,0 мг/кг, лимитирующий показатель вредности - общесанитарный. Предельно допустимая концентрация сульфат-аниона Защита окружающей среды должна быть обеспечена герметизацией технологического оборудования, устройством вытяжной вентиляционной системы, очистными сооружениями в местах возможного поступления в окружающую среду аэрозоля серной кислоты. Охрана атмосферного воздуха при производстве серной кислоты должна осуществляться согласно ГОСТ 17.2.3.02. Не следует допускать попадания серной кислоты в канализацию, водоемы и почву. Места пролива (разлива) серной кислоты должны быть обвалованы и нейтрализованы известью или содой, продукты нейтрализации должны быть отправлены на утилизацию. Кислые сточные воды после промывки коммуникаций и оборудования и твердые отходы должны подвергаться утилизации в технологическом процессе производства серной кислоты или нейтрализации на очистных сооружениях предприятия. Контроль за состоянием атмосферного воздуха и воды проводят в соответствии с планами производственно-экологического контроля службами предприятия или с привлечением аккредитованных лабораторий. Список литературы Амелин, А.Г. Технология серной кислоты. –М.:Химия, 1971. – 360с. Соколов, Р.С. Химическая технология: учебное пособие для студентов высших учебных заведений: В 2 т. – М.:Гуманит.изд.центр ВЛАДОС, 2003. – 368 с. Васильев, Б.Т. Технология серной кислоты./ Васильев Б.Т., Отважная М.И. - М.:Химия, 1985,стр.385. Бесков, В.С. Автоматизированный расчет материальных балансов химикотехнологических систем, уч. пособие №3985/ В.С. Бесков, Ю.Л. Вяткин, Н.З. Павлова, А.М. Кащук, Г.М. Семенов. - М.,1999. – 79 с. Бесков, В.С. Автоматизированная система расчетных работ в общеинженерных курсах по химической технологии, уч. пособие №4261/ В.С .Бесков, М.Г. Давидханова, В.И. Царев. - М., 2003. – 83с. ГОСТ 2184-2013 Кислота серная техническая. Технические условия (с Поправками).[Электрон.ресурс].URL: http://docs.cntd.ru/document/1200107829 ГОСТ 444-2016 Колчедан серный флотационный. Технические условия. [Электрон.ресурс].URL: http://docs.cntd.ru/document/12001446 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 , %, не более
, %, не более , %, не более
, %, не более раствора сравнения, не более
раствора сравнения, не более