готовые лекции аммиак (1). Получение синтетического аммиака
 Скачать 94.5 Kb. Скачать 94.5 Kb.
|
|
ПОЛУЧЕНИЕ СИНТЕТИЧЕСКОГО АММИАКА Аммиак - бесцветный газ с характерным запахом. При охлаждении до (- 33,35)°С аммиак сжижается в бесцветную, прозрачную жидкость, при (- 77,75)°С затвердевает, образуя бесцветную кристаллическую массу. Жидкий аммиак — легко летучее соединение, хорошо растворяет водород, азот, метан, аргон. Аммиак - хорошо растворим в воде: при 20°С и атмосферном давлении в 1 дм воды растворяется 760 дм газообразного аммиака; несколько хуже аммиак растворяется в органических жидкостях. Аммиак токсичен, вызывает острое раздражение слизистой оболочки дыхательных путей, слезотечение, удушье, ожоги. Сухие аммиак и воздух образуют взрывоопасные смеси. Химические свойства: С водой аммиак образует «гидраты» При растворении в воде устанавливаются следующие равновесия: С кислотами аммиак образует соли: 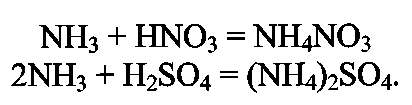 К окислителям аммиак устойчив. С кислородом воздуха очень медленно взаимодействует даже при повышенной температуре: 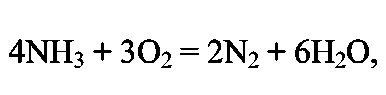 но в присутствии катализатора протекает практически до конца следующая реакция: Разлагается аммиак при температуре 1300°С по эндотермической реакции: 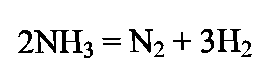 С диоксидом углерода образует карбамид: Карбамид - это одно из лучших удобрений, благодаря высокой концентрации в нём азота и хорошим физическим свойствам. На основе карбамида (мочевины) получают разнообразные химические продукты (например, полимеры). Значение и применение аммиака. Аммиак является важнейшим химическим продуктом, так как служит исходным сырьём для получения самых разнообразных азотсодержащих соединений. Наиболее крупными потребителями связанного азота, а именно аммиака, являются: промышленность минеральных удобрений; производство азотной кислоты (около 35% аммиака); производство красителей; производство взрывчатых и горючих веществ; производство химических волокон; производство пластических масс; медицина; холодильная техника. В природе источников связанного азота мало. Достаточно крупные месторождения связанного азота в виде нитрата аммония есть в Чили. Аммиак входит в состав коксового газ и извлекается из него в виде сульфата аммония или аммиачной воды. Мировое производство синтетического аммиака огромно. 2.Физико-химические основы синтеза аммиака. Уравнение химической реакции и его анализ. 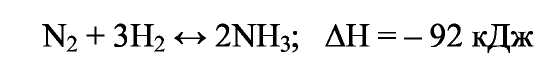 При температуре 500 °С и давлении 30 МПа ΔН = -112 кДж. Стандартная энтальпия образования аммиака равна ΔН°обр. = - 46 кДж. Реакция - обратимая, протекает с уменьшением объёма газообразных веществ, идёт с выделением тепла (экзотермическая). Согласно принципу Ле Шателье, процесс необходимо проводить при высоких концентрациях азота и водорода в газовой смеси, поступающей на синтез, при повышенном давлении и при постоянном понижении температуры. Равновесие сместится вправо также при отводе продуктов реакции. Исследование зависимости равновесного выхода аммиака от давления и температуры показывает, что: с увеличением давления содержание аммиака в газе повышается и происходит это по затухающей кривой (Рис.1.); с увеличением температуры равновесный выход аммиака уменьшается (Рис. 2); При одной и той же температуре с увеличением давления выход аммиака увеличивается. Все промышленные установки работают при повышенном давлении. Различают установки: низкого давления - (10 - 15) МПа; среднего давления - (25 - 60) МПа; высокого давления - (60 - 100) МПа. Но применять слишком высокие давления экономически не выгодно. Наиболее эффективным является агрегат синтеза аммиака под средним давлением (Р = 32МПа) мощностью 450000т/год (или 13 60т/сутки). Температура процесса 400 - 500 °С. Выход готового продукта увеличивается с понижением температуры. Но при низких температурах скорость реакции настолько мала, что реакция практически не протекает. В таком случае есть один выход - использование катализатора. Наиболее высокую каталитическую активность для данной реакции проявляют железо, рений, осмий и уран. Однако осмий рений и уран дороги и опасны в работе. Остаётся только одно - использовать железо. В промышленном синтезе аммиака используют разработанный ГИАП железный катализатор, промотированный оксидами алюминия, калия, кальция и кремния. Такой катализатор достаточно активен и стоек к местным перегревам. Катализатор подвержен отравлению. Соединения серы отравляют катализатор необратимо, а кислород и некоторые его соединения — обратимо, но очень быстро. Даже в ничтожно малых количествах присутствие соединений кислорода быстро выводят катализатор из строя, после чего требуется его восстановление. (Поэтому, перед синтезом аммиака проводят тонкую очистку от кислородсодержащих соединений - стадию метанирования). При указанных условиях синтеза: высокая температура; высокое давление; высокая объёмная скорость наличие катализатора; не весь азот и водород вступают в реакцию. В газовой смеси, выходящей из контактного аппарата, содержится всего (18 - 20) % (об.) аммиака, остальное - не прореагировавшая АВС. Процесс целесообразно проводить по циклической схеме. Схема цикла синтеза аммиака представляется следующим образом (Рис) Газовую смесь, выходящую из контактного аппарата, охлаждают до температуры сжижения аммиака. Аммиак выводят из цикла, а смесь водорода и азота, не вступившую в реакцию, возвращают в контактный аппарат. Способы выделения аммиака из газовой смеси зависит от применяемого давления. В системах с высоким давлением аммиак выделяется из газовой смеси при охлаждении только в водяных холодильниках (первичная конденсации газа). Причём всю продукцию получают в виде жидкого аммиака. В системах, работающих при средних давлениях, применяют водяное и аммиачное охлаждение. В этом случае часть продукции (30 - 40) % отводится в виде жидкого аммиака, а остальная часть (60 - 70) % в газообразном состоянии. В установках, работающих при более низких давлениях, весь аммиак получают в газообразном состоянии. Продувочные газы. Инерты или инертные газы синтеза аммиака - газы, которые не участвуют в реакции образования аммиака, но присутствуют в ABC, это аргон и метан и небольшие количества СО и СО2. Так как реакция синтеза аммиака идёт с уменьшением объёма и процесс организован по циклической схеме, то со временем содержание инертов в газе, поступающем в колонну синтеза, увеличивается. Поэтому необходимо периодически выводить их из системы в виде продувочных газов. Для поддержания в агрегате содержания инертов на определённом уровне производится продувка после сепаратора жидкого аммиака. Из продувочных газов выделяют аммиак в отделителе. А продувочные газы под давлением 32 МПа направляются в межтрубное пространство теплообменника конденсационной колонны продувочных газов. Технологическая схема синтеза аммиака при среднем давлении. Получение аммиака состоит из четырёх стадий: приготовление азотоводородной смеси (ABC); очистка ABC; компремирование; синтез аммиака. Все стадии представляют единую энерготехнологическую схему. Перед стадией синтеза азотовдородную (ABC) сжимают -это стадия компремирования. Отметим, что ABC получают двумя принципиально отличными способами: смешиванием раздельно полученных азота и водорода(проект «Линде»); паровоздушной конверсией метана с последующей конверсией оксида углерода (II) (проект ГИАП). На Рисунке приведена схема агрегата мощностью 450000 т/г (1360 т/сут.), включающая двухступенчатую паровоздушную конверсию метана, двухступенчатую конверсию СО, МЭА(моноэтаноламин?)-очистку от СО2, окончательную очистку от СО и СО2 каталитическим гидрированием (метанирование) и, наконец, СИНТЕЗ АММИАКА (проект ГИАП). Описание схемы. Получение водорода конверсией метана и оксида углерода. Очистка газа и конверсия метана. Природный газ (ПГ) под давлением 4 МПа после очистки от серосодержащих соединений в реакторе гидрирования 2 и адсорбере сероводорода 3 смешивается с паром в соотношении ПАР : ПГ = 3,7 : 1, подогревается в теплообменнике 4 отходящими газами из трубчатого конвертора и поступает в трубчатый конвертор 5. Перед реактором гидрирования 2 ПГ подогревается в подогревателе 1, а перед трубчатым конвертором 5 в теплообменнике 4 для увеличения скорости реакции. Трубчатый конвертор имеет топку 6, где сжигается в качестве топлива природный газ. В трубчатом конверторе 5 протекает первая ступень конверсии метана с водяным паром до образования СО и Н2 по следующей реакции Процесс протекает на никелевом катализаторе при температуре 800 - 850 °С. Остаточное содержание метана после первой ступени конверсии составляет 9 - 10 % (об.). Эту стадию называют первичным реформингом. Далее газ смешивается с воздухом и поступает в шахтный конвертор на вторую ступень конверсии остаточного метана кислородом воздуха по реакции при температуре 900 - 1000 °С и соотношении ПАР: ГАЗ = 0,8:1. Остаточное содержание метана после второй ступени составляет до 0,9 % (об). Эту стадию называют вторичным реформингом. Перед конверсией СО газ необходимо охладить. Из шахтного конвертора 7 газ направляется в котёл-утилизатор 8, где получают пар высоких параметров (10 МПа и 480°С) и который направляют в газовые турбины центробежных компрессоров. Конверсия СО. Из котла-утилизатора газ поступает на двухступенчатую конверсию СО, где протекает реакция: Конверсия СО осуществляется вначале в конверторе первой ступени 9 на среднетемпературном железо-хромовом катализаторе при температуре 430 - 470 °С, а затем в конверторе СО второй ступени 10 на низкотемпературном цинк-хром-медном катализаторе при температуре 200 - 260 С. Между первой и второй ступенями конверсии СО газ охлаждается, для чего устанавливают котёл-утилизатор 8. (Теплота газовой смеси, выходящей из второй ступени конверсии СО, используется для регенерации МЭА-раствора, выходящего из скруббера 13 очистки газа от СО2). (Регенерированный раствор МЭА проходит воздушный холодильник 14 и возвращается на МЭА очистку в абсорбер-скруббер 13). Очистка от СО2. 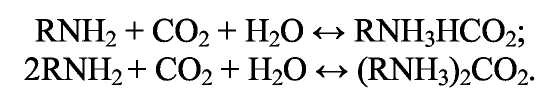 После конвертора СО второй ступени 10 газ, пройдя теплообменник 11, поступает на очистку от СО2 в абсорбер-скруббер 13, орошаемый холодным раствором МЭА, где при температуре 30 — 40°С происходит очистка газа от СО2 по реакциям: Тонкая очистка от СО и СО2 (метанирование). На выходе из абсорбера газ содержит примеси кислородсодержащих каталитических ядов ( СО до 0,3% и СО2 в количестве 30 - 40 см /м ), от которых газ необходимо очистить, для чего оксиды углерода затем гидрируют в метанаторе 15 при температуре 280 - 350°С на никелевом катализаторе. В метанаторе протекают следующие экзотермические реакции: 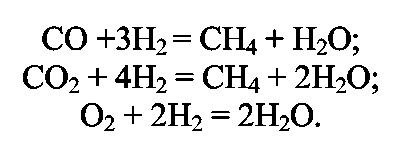 Теплота очищенного газа после метанатора используется для подогрева питательной воды. Дальнейшее охлаждение и сепарация выделившейся воды проводится в аппарате воздушного охлаждения и влагоотделителе. (На схеме их нет.) Далее стадия компремирования и синтез аммиака. Для сжатия азотоводородной смеси до 32 МПа и циркуляции газа в агрегате синтеза аммиака используют центробежный компрессор 16 с приводом от паровой конденсационной турбины 17. Свежая азотоводородная смесь (ABC) смешивается с циркуляционным газом перед системой вторичной конденсации, состоящей из аммиачного холодильника 18 и сепаратора 20, проходит два теплообменника 21 и 23 и направляется в полочную колонну синтеза 25. Прореагировавший газ при температуре 320 - 380°С проходит последовательно водоподогреватель питательной воды 22, «горячий» теплообменник 23 и 24, «холодный» теплообменник 21, сепаратор жидкого аммиака 19 и поступает на циркуляционное колесо компрессора. Жидкий аммиак из сепараторов 19 и 20 направляется в хранилище жидкого аммиака. Содержание аммиака в оборотной ABC над жидким аммиаком зависит от температуры и давления. Так, при давлении 30 МПа и температуре (-5 °С) в ABC остаётся около 2,5% NH3. «Танковые газы». Выделение аммиака. В результате дросселирования жидкого аммиака в сборнике с 32 МПа до 2,1 МПа происходит выделение растворённых в жидком аммиаке газов (водорода, азота, метана и аргона). Эти газы называются танковыми. Они содержат около 34% аммиака. Выделение аммиака из танковых газов происходит в испарителе за счёт охлаждения газов до (- 18°С) испаряющимся жидким аммиаком. Сконденсировавшийся аммиак отделяется в сепараторе, а оттуда направляется в сборник. Танковые газы дросселируются до 1,1 - 1,8 МПа и направляются в агрегат конверсии метана для сжигания в трубчатых печах. Колонна синтеза. Колонна синтеза - это основной аппарат установки синтеза аммиака. Аппараты изготавливают из специальных лигированных сталей. При высоких параметрах процесса (температуре и давлении) аммиак и особенно водород взаимодействуют со сталью, ухудшая её механические свойства. Колонна устроена так, что тепло уходящего газа используется для нагревания вновь поступающего. Совершенствование технологии производства аммиака проводится в следующих основных направлениях: - создание агрегатов большой единичной мощности; — разработка новых катализаторов, устойчивых к ядам и с низкой температурой зажигания, а также применение кипящего слоя катализатора; — обеспечение процесса синтеза при низких давлениях (10 МПа) без снижения выхода NH3; кооперация производства аммиака с производствами органического и неорганического синтеза; использование природного газа, газов нефтепереработки и других видов сырья; — использование теплоты реакций для получения пара высоких параметров. |
