|
|
Практическая работа № 2 Получение этилена и изучение его свойств. Практическая работа 2 Получение этилена и изучение его свойств
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 2
Получение этилена и изучение его свойств.
Цель: научиться получать в лаборатории этилен; изучить физические и химические свойства этилена.
Оборудование: пробирки, пробка с газоотводной трубкой, штатив, спиртовая горелка, спички.
Реактивы: C2H5OH, H2SO4(конц.), песок, бромная вода (Br2), KMnO4.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
№ п/п
|
Название опыта
|
Описание опыта, рисунок
|
Наблюдения и уравнения реакций
|
Вывод
|
1.
|
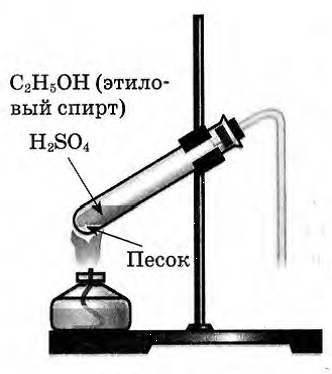
Получение этилена.
|
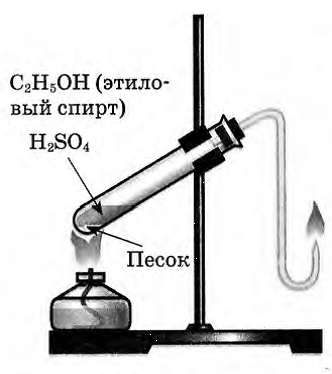
В пробирку налили 1 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпали немного прокаленного песка (чтобы предотвратить толчки жидкости при кипении). Закрыли пробирку пробкой с газоотводной трубкой, закрепили ее в штативе и осторожно нагрели содержимое пробирки.
|
В пробирке начинается выделяться газ - этилен.
С2H5OH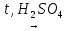 C2H4↑ + H2O. C2H4↑ + H2O.
|
В ходе реакции концентрированная серная кислота забирает воду из спирта, врезультате образуется этилен.
Такую реакцию называют – реакция дегидратации.
|
2.
|
Изучение свойств этилена.
|
В другую пробирку налили 2-3 мл бромной воды. Опустили газоотводную трубку первой пробирки до дна пробирки с бромной водой и пропускали через неё выдедяющийся газ.
|
При пропускании газа через бромную воду, происходит обесцвечивание бромной воды.
H2C=CH2 + Br2 → CH2Br – CH2Br
|
В ходе реакции происходит окисление этилена бромной водой по двойной связи.
|
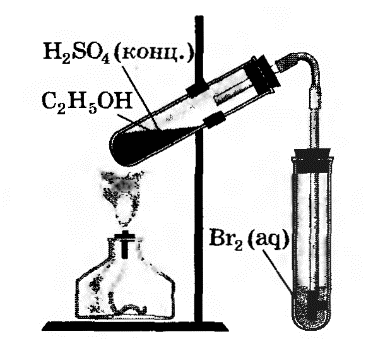
В третью пробирку налили 2-3 мл разбавленного раствора KMnO4, поодкисленного серной кислотой, и пропустили через него газ.
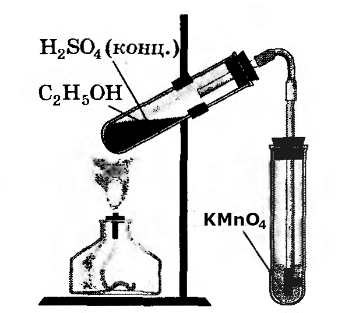
|
При пропускании газа через подкисленный раствор KMnO4, происходит обесцвечивание раствора KMnO4.
5C2H4+12KMnO4+18H2SO4→10CO2+6K2SO4+
+12MnSO4+28H2O.
|
В ходе реакции происходит окисление этилена подкисленным раствором перманганата калия.
|
Выделяющиеся газ первой пробирки подожгли.
|
Этилен на воздухе горит ярким светящимся пламенем.
С2Н4 + 3О2 → 2СО2+2Н2О.
|
Этилен горит ярким светящимся пламенем, что доказывает наличие кратных связей.
|
Общий вывод: на данной практической работе мы научились получать в лаборатории этилен реакцией дегидратации спиртов; изучили химические свойства этилена, а именно, действие этилена на бромную воду и подкисленный раствор перманганата калия.
Задание учителя:
I вариант
Какой из гомологов этена имеет плотность по воздуху 1,45?
Ответ: D(возд.) = Mr (алкена)/Mr (воздуха);
Mr (алкена) = D(возд.)* Mr (воздуха);
Mr (алкена) = 1,45*29 = 42.
Пропен Н2С=СН-СН3
II вариант
Какой из гомологов пропена имеет плотность по водороду 14?
Ответ: D(Н2) = Mr (алкена)/Mr (Н2);
Mr (алкена) = D(Н2)* Mr (Н2);
Mr (алкена) = 14*2 = 28.
Этен СН2=СН2 |
|
|
 Скачать 209.57 Kb.
Скачать 209.57 Kb.

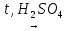 C2H4↑ + H2O.
C2H4↑ + H2O.

