ПР № 8. Практическая работа 8 Составление уравнений реакции в молекулярной и ионной форме. Гидролиз солей
 Скачать 45.84 Kb. Скачать 45.84 Kb.
|
|
Практическая работа № 8 «Составление уравнений реакции в молекулярной и ионной форме. Гидролиз солей» Цель: составить уравнения реакций в молекулярном и ионном виде, уравнения гидролиза солей. Краткое теоретическое обоснование: Электролитической диссоциацией называют распад электролита на сольватированные (гидратированные) ионы под действием молекул растворителя. Основания – электролиты, диссоциирующие с образованием гидроксид-ионов ОН- Кислоты – электролиты, диссоциирующие с образованием катионов водорода Н+: Средние соли, растворимые в воде, являются сильными электролитами и диссоциируют с образованием положительных ионов металла и отрицательных ионов кислотного остатка. Кислые соли рассматривают как продукт, получающийся из многоосновных кислот, в которых не все атомы водорода замещены на металл. Основные соли характерны для многоковалентных металлов и диссоциируют с образованием основных и кислотных остатков Реакции между ионами называются ионными реакциями, а уравнения этих реакции – ионными уравнениями. Запишем уравнение реакции в молекулярной форме:  CuSO4 + 2KOH= Cu(OH)2 + K2SO4 CuSO4 + 2KOH= Cu(OH)2 + K2SO4В ионной форме это уравнение будет иметь следующий вид: Cu2+ + SO2-4 + 2K+ + 2OH- = Cu(OH)2 + 2K+ + SO2-4 Гидролиз соли - это реакция обмена ионов соли с ионами воды. Например, гидролиз соли KNO2, образованной катионом сильного основания и анионом слабой кислоты, протекает следующим образом: - в молекулярной форме   KNO2+H2O KOH + HNO2 KNO2+H2O KOH + HNO2- в ионной форме   K+ + NO-2 + НОН K+ + ОН- + HNO-2 K+ + NO-2 + НОН K+ + ОН- + HNO-2- в краткой ионной форме   NO2 + НОН ОН- + HNO-2 NO2 + НОН ОН- + HNO-2Порядок выполнения работы: Выполните задания: Задание 1 Напишите уравнения реакций в молекулярной и ионной формах: I вариант а) соляная кислота и нитрат серебра б) хлорид бария и сульфат алюминия в) оксид алюминия и серная кислота г) сульфат железа (III) и гидроксид натрия II вариант а) нитрат серебра и бромид алюминия б) хлорид аммония и гидроксид натрия в) сульфид натрия и соляная кислота г) оксид кальция и азотная кислота Задание 2 По кратким ионным уравнениям составьте молекулярные и полные ионные уравнения: I вариант II вариант а) Fe2+ + S2- → FeS↓ а) Fe(OH)3 + 3H+ → Fe3+ + 3H2O б) СО 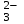 + 2Н+ → СО2 + Н2О б) Mg0 + 2H+ → Mg2+ + H2↑ + 2Н+ → СО2 + Н2О б) Mg0 + 2H+ → Mg2+ + H2↑Задание 3 Могут ли находиться в растворе следующие ионы, если нет, то почему? Напишите краткие ионные уравнения возможных реакций. I вариант II вариант а) Na+; SO 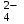 ; SO ; SO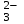 ; Н+ а) Fe3+; ОН-; К+; NO ; Н+ а) Fe3+; ОН-; К+; NO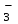 б) Al3+; SO 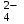 ; Cl -; Н+ б) Са2+; Сl- ; ОН-; SO ; Cl -; Н+ б) Са2+; Сl- ; ОН-; SO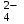 Задание 4 Какие растворы солей подвергаются гидролизу: Напишите молекулярные и ионные уравнения реакций, укажите среду раствора. I вариант II вариант CaCl2; Pb(NO3)2; К2СО3 ZnCl2; СuCO3; Na2S Задание 5 Напишите в молекулярной форме по два уравнения гидролиза к каждому из ионных уравнений: I вариант II вариант     Cr3+ + H2O Cr3+ + H2O  (CrOH)2+ + H+ SO (CrOH)2+ + H+ SO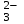 + H2O + H2O  HSO HSO + OH- + OH- |
