Серная кислота и её свойства. Разработка урока по химии по теме "Серная кислота"
 Скачать 45.05 Kb. Скачать 45.05 Kb.
|
|
Разработка урока по химии по теме "Серная кислота" в 9-м классе Организационный момент. (1-2 мин.) Оборудование и вещества: кусочек сахара, спил дерева, ткань, концентрированная и разбавленная серная кислота, медь, гидроксид натрия, цинк, хлорид бария, оксид меди (II), спиртовка, пробирки. Вводное слово учителя. Связь с материалом прошлого урока. Тематический тест по домашнему заданию и материалу прошлого урока. (2мин). (На столах в папках.) Ход урока. Тест по теме “ Сера. Соединения серы со II, IV, VI валентностью”. В ряду химических элементов O →S → Se →Te неметаллические свойства: а) усиливаются б) не изменяются в) ослабевают г) изменяются периодически Найдите формулу, соответствующую электронной конфигурации внешнего электронного слоя атома серы. а) ….3s23p4 б)…..4s24p4 в)…..6s26p4 г)…..4s24p5 Окислительные свойства серы проявляются в реакциях с а) с кислородом б) фтором в) металлами г) водородом Определите вещество, с которым оксид серы (VI) не будет взаимодействовать. а) гидроксид кальция б) оксид бария в) вода г) оксид углерода (IV) Укажите названия веществ, имеющих следующие формулы (по порядку) Na2SO3, K2SO4, Na2S а) сульфит натрия, сульфит калия, сульфид натрия б) сульфат натрия, сульфат калия, сульфит натрия в) сульфит натрия, сульфат калия, сульфит натрия г) сульфит натрия, сульфат калия, сульфид натрия. Оксид серы (IV) взаимодействует в растворе с веществами набора: а) NaOH, K2CO3 б) HCl, CO2 в) H3PO4, P2O5 г) Br2, Na2SO4 Работа по теме урока. Учитель сообщает цель и задачи урока. Цель и задачи урока Расширение знаний о кислотах на примере свойств серной кислоты, совершенствовать знания и умения, учащихся при написании уравнений реакций, работы с химическими веществами, при выполнении химических опытов; Формирование навыков сравнения, обобщения на примере свойств серной кислоты и умения выделять особенности, развитие творчества, интереса к предмету; Воспитание самостоятельности, аккуратности при выполнении опытов, записи уравнений реакций, воспитание бережного отношения к природе. Учитель у каждого вещества есть своя история открытия, такая история есть и у серной кислоты. Выступление 1-го учащегося по истории открытия серной кислоты. Учитель:Как же образуется молекула серной кислоты? И причем здесь эта фотография? ( На фотографии природное озеро серной кислоты на п-ове Камчатка) Учащиеся отвечают на вопросы. Записывают формулу серной кислоты и уравнение реакции ее образования. Учащиеся просматривают ролик об образовании молекулы серной кислоты, с записью в тетради ее физических свойств. Учитель мы с вами хорошо знаем правила техники безопасности при работе с кислотой. А как правильно? Правила техники безопасности. Учащиеся объясняют правила. Учитель Зная физические свойства и правила техники безопасности можно рассмотреть и химические свойства. Учитель: С какими веществами будет взаимодействовать серная кислота? Учащиеся называют Учитель. Теперь конкретно рассмотрим химические свойства. Конц. серная кислота при нагревании может взаимодействовать с металлами, расположенными в ряду напряжений металлов правее водорода. При этом продутом реакции является сернистый газ. В этой реакции серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления. При взаимодействии конц. серной кислоты с цинком возможно образование сернистого газа и серы. В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления. Холодная конц. серная кислота пассивирует железо, образуя на его поверхности тонкую пленку, нерастворимую в серной кислоте. Горячая конц. серная кислота является более сильным окислителем и взаимодействует с железом. При этом образуются следующие продуты реакции: В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления. При взаимодействии конц. серной кислоты с магнием возможно образование серы и сернистого газа. 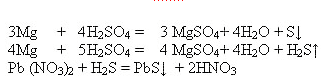 В этих реакциях серная кислота проявляет окислительные свойства, так как сера максимально понижает свою степень окисления . Конц. серная кислота проявляет водоотнимающие свойства. Она окисляет сахарозу, при этом образуются летучие газы диоксид углерода и диоксид серы, поэтому масса вспучивается и поднимается. В этой реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления. Показ взаимодействия конц. серной кислоты с органическими веществами с помощью документ-камеры.( под объективом документ-камеры, учитель показывает взаимодействие конц. кислоты с кусочком сахара, с древесиной, с тканью). При выполнении качественной реакции на сульфат- ион включается ролик по образованию сульфата бария. Обобщаем, подводим итог по свойствам серной кислот. Применение серной кислоты. Учащийся выступает по применению серной кислоты. Учитель: Прокомментировать этикетку чистящего средства. Зная технику безопасности и свойства серной кислоты. Влияние серной кислоты на окружающую среду: просмотр видеоролика. Что наблюдаете? В результате, каких явлений это произошло? Как это можно объяснить. Учащиеся отвечают на эти вопросы, комментируя фотографии на слайде. Целью сегодняшнего урока было: изучить свойства концентрированной серной кислоты, сравнить их со свойствами разбавленной серной кислоты и найти причину этих отличий. С этой задачей мы с вами успешно справились. Таким образом, цель урока достигнута. Объяснение домашнего задания. Подведение итогов урока. Выставление оценок за урок. |
