ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ химия. Практическая работа По дисциплине Химия (наименование учебной дисциплины согласно учебному плану) Тема работы подгруппа цинка Выполнил студент гр. Мнм22
 Скачать 122.54 Kb. Скачать 122.54 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное бюджетно-образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей Химии Практическая работа По дисциплине Химия (наименование учебной дисциплины согласно учебному плану) Тема работы подгруппа цинка
Оценка: Дата:
Санкт-Петербург 2022 Цель работы: изучение химических свойств элементов подгруппы цинка. Теоретические сведения В побочную подгруппу второй группы входят элементы цинк, кадмий и ртуть. Первые два элемента в соответствии с номером группы в своих соединениях проявляют степень окисления +2. Для ртути, кроме того, известны многочисленные соединения, в которых она проявляет степень окисления +1. Однако соединения ртути (I) всегда димеризованы. Например, графическая формула хлорида ртути (I) Cl–Hg–Hg–Cl показывает, что валентность II сохраняется. Изменяется только степень окисления. В отличие от элементов главной подгруппы второй группы металлы группы цинка являются тяжелыми металлами. В этом отношении они проявляют сходство с элементами подгруппы меди. Электрохимический характер в ряду Zn – Cd – Hg изменяется также, как в ряду Cu – Ag – Au: активность металла падает причем даже более резко: цинк является активным металлом, кадмий тоже располагается левее водорода, а ртуть по своему характеру уже приближается к благородным металлам. Оксиды металлов II B группы окрашены (ZnO проявляет цвет при нагревании). Гидроксиды мало растворимы в воде. Являются слабыми основаниями. Оксид и гидроксид цинка носят амфотерный характер. Гидроксид ртути, подобно гидроксиду серебра, неустойчив и быстро превращается в ее оксид. Для всех элементов подгруппы цинка характерны реакции комплексообразования. Выполнение работы Опыт №2: Свойства гидроксидов цинка и кадмия А) 1. 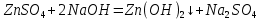 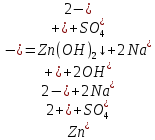 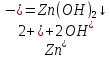 Выпадение белого осадка 2. 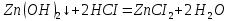 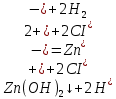 O O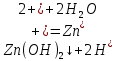 Растворение осадка в кислоте 3. 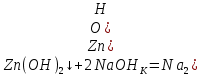 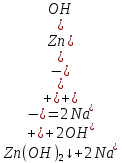 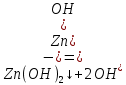 Растворение осадка в концентрированной щелочи Б) 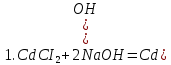 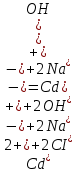 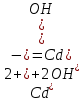 Выпадение осадка белого цвета 2. 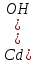 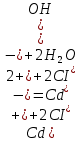 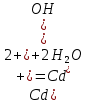 Растворение осадка в кислоте 3. 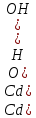 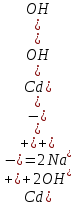 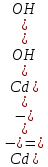 Растворение осадка в концентрированной щелочи Опыт 3. Получение амминокомплексов и изучение их свойств А) 1. 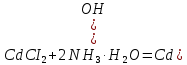 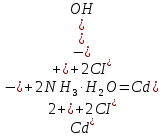 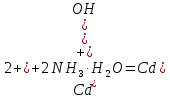 Выпадение осадка белого цвета 2. 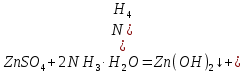 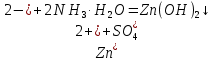 + +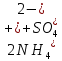 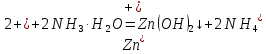 Выпадение осадка белого цвета 3. 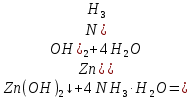 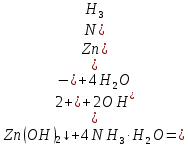 Растворение осадка в гидрате аммиака 4 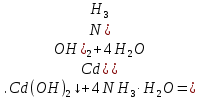 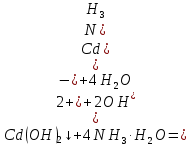 Растворение осадка в гидрате аммиака Б)1. 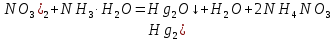 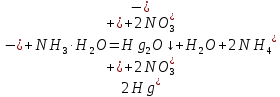 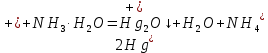 Выпадение буровато-черного осадка 2. 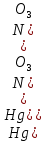 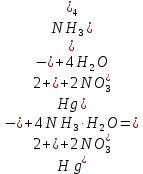 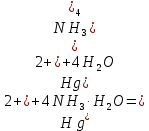 Опыт 4. Получение и свойства сульфидов А) 1. 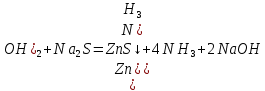 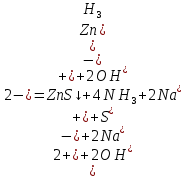 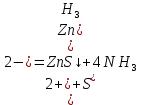 Выпадение белого творожистого осадка 2. 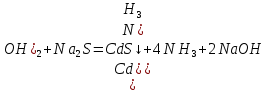 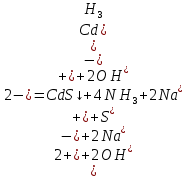 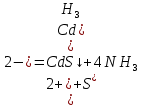 Выпадение желтого осадка Б) 1. 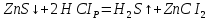 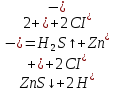 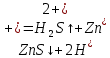 Растворение осадка в кислоте с выделением газа 2. 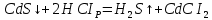 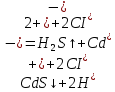 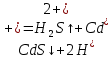 Растворение осадка в кислоте с выделением газа Опыт 7. Диспропорционирование солей Hg (I) 1. 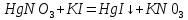 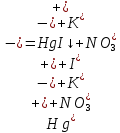 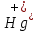 + +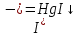 Выпадение ярко-оранжевого осадка 2. 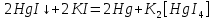 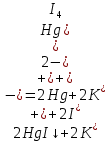 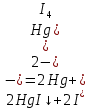 Выпадение ртути в осадок Вывод: в ходе лабораторной работы были изучены химические свойства элементов подгруппы цинка |
