учеб практика. Практика Иванова. Практикум по общей химии учебное пособие для хим тех спец вузов., А. А. Петрова. М. Высш шк. 2010 408с
 Скачать 92.51 Kb. Скачать 92.51 Kb.
|
|
ЗАДАНИЕ НА ПРАКТИКУ Название практики: Учебная практика ДАНО студенту Иванову Константину Владимировичу группы 26 Структура задания: Введение Индикаторы. Виды химических индикаторов. Растворы электролитов. Электролитическая диссоциация кислот, оснований, солей Классификация электролитов. Степень диссоциации. Сильные и слабые электролиты Реакции обмена в растворах электролитов и условия их протекания. Ионные уравнения Ионное произведение воды. Водородный показатель рН растворов Заключение Библиографический список Исходные данные для отчета по практике: ГОСТ 1510-84 Нефть и нефтепродукты ГОСТ 4919.1-2016 Реактивы и особо чистые вещества. Приготовление растворов индикаторов ГОСТ 33776-2016 Методы испытаний химической продукции, представляющей опасность для окружающей среды. Определение pH, кислотности и щелочности Рекомендуемая литература: Практикум по общей химии: учебное пособие для хим.тех.спец.вузов., А.А. Петрова. – М.: Высш.шк.-2010 – 408с. Фролов В.В. Химия: - М.: Высш. Шк., 2017.- 543с. Киреев В.А. “Курс физической химии”, М. 2016. Глинка. Н.Л. “Общая химия”, М. 2000. Содержание Введение………………………………………………………………….3 1 Индикаторы. Виды химических индикаторов……………………….5 2 Растворы электролитов. Электролитическая диссоциация кислот, оснований, солей……………………………………………………………….9 3 Классификация электролитов. Степень диссоциации. Сильные и слабые электролиты…………………………………………………………..12 4 Реакции обмена в растворах электролитов и условия их протекания. Ионные уравнения………………………………………………………….14 5 Ионное произведение воды. Водородный показатель рН растворов……………………………………………………………16 Заключение……………………………………………………………...17 Библиографический список……………………………………………19 Введение Индикаторы (от лат. Indicator –указатель) – соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента. Чтобы какое-либо вещество могло служить индикатором, оно должно удовлетворять следующим необходимым условиям: должно быть слабой кислотой или слабым основанием; его молекулы и ионы должны иметь разную окраску; окраска их должна быть чрезвычайно интенсивной, чтобы быть заметной при добавке к испытуемому раствору малого количества индикатора. Проблема получения индикаторов достаточно актуальна, так как природные индикаторы играют большую роль и широко используются при химических исследованиях. Индикаторы широко используют в титровании в аналитической химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность исследования. Самый часто используемый и известный в химии растительный кислотно-основной индикатор – лакмус. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолетовой краски - заменителя дорогостоящего пурпура. Позже лакмус был открыт в 1663 году. Он представлял собой водный раствор лишайника, растущего на скалах в Шотландии. Роберт Бойль приготовил водный раствор лакмусового лишайника для своих опытов. Склянка, в которой он хранил настой, понадобилась для соляной кислоты. Вылив настой, Бойль наполнил склянку кислотой и с удивлением обнаружил, что кислота покраснела. Заинтересовавшись этим явлением, Бойль на пробу добавил несколько капель к водному раствору гидроксида натрия и обнаружил, что в щелочной среде лакмус 3 синеет. Так был открыт первый индикатор для обнаружения кислот и щелочей, названный по имени лишайника лакмусом. С тех пор этот индикатор является одним из незаменимых индикаторов в различных исследованиях в области химии. 4 1 Индикаторы. Виды химических индикаторов Существуют следующие виды химических индикаторов: Кислотно-основные. Универсальные Комплексонометрические Адсорбционные Флуоресцентные Хемилюминесцентные Кислотно-основные – это органические соединения, способные изменять цвет в растворе при изменении кислотности. Такие индикаторы резко изменяют свой цвет в достаточно узких границах рН. Универсальные индикаторы – это смесь нескольких индивидуальных индикаторов, подобранных так, что их раствор поочередно меняет окраску, проходя все цвета. Комплексонометрические индикаторы – вещества, образующие с ионами металлов, окрашенные комплексные соединения. Адсорбционные индикаторы – индикаторы, когда некоторые вещества адсорбируются на поверхности осадка, изменяя его окраску. Флуоресцентные индикаторы – такие индикаторы светятся (флуоресцируют) разным цветом в зависимости от рН раствора. Они удобны при исследовании мутных или окрашенных растворов, в которых практически невозможно заметить изменение окраски обычными кислотно-основными индикаторами. Хемилюминесцентные индикаторы — вещества, способные в точке эквивалентности светиться видимым светом и используемые при титровании сильно окрашенных растворов. Причина изменения цвета индикаторов в том, что присоединение 5 или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных групп. Хромофо́ры — ненасыщенные группы атомов, обуславливающие цвет химического соединения. К хромофорам относят азогруппу —N=N—, нитрогруппу —NO2, нитрозогруппу —N=O, карбонильную группу =С=О, сопряженные системы двойных связей, хиноидные группировки и др. Введение других групп, называемых ауксохромами (—ОН, —NH2 и др.), способствует углублению окраски. 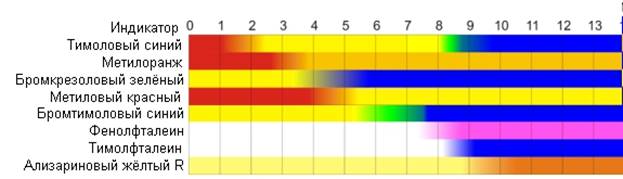 Рисунок 1 - Изменение цвета синтетических индикаторов в зависимости от pH. Кислотно-основные индикаторы можно найти среди природных объектов. Пигменты многих растений способны менять цвет в зависимости от кислотности клеточного сока. Следствие, пигменты являются индикаторами, которые можно применить для исследования кислотности других растворов. Общее название таких растительных пигментов флавоноиды. Флавоноиды (от лат. flavus - желтый) – группа природных биологически активных соединений – производных бензо-гамма-пирона, в основе которых лежит фенилпропановый скелет. Это гетероц- Кольцо А синтезируется из трёх активированных молекул малоновой кислоты. 6 Кольцо В ( рис.2) и примыкающий к нему трёхуглеродный фрагмент (атомы С-2, С-3 и С-4 и О, образующие кольцо С) синтезируются из шикимовой кислоты и фосфоенолпировиноградной кислоты с промежуточным образованием через фенилаланин-коричную кислоту. Циклические соединения с атомом кислорода в кольце. 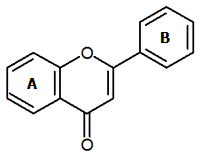 Рисунок 2 - Общая структура флавонов (имена ароматических колец: А - С - В) Производными этих веществ являются катехины, бетацианины, антоцианы и антоцианидины. Антоцианы – общее название флавоноидного пигмента. Они состоят из углевода (сахара) и агликона – неуглеводной составляющей, в качестве которого у антоцианов выступают антоцианидины – 2-фенилхромены, кроме того, во многих случаях они имеют ацильную группу (рис. 3). 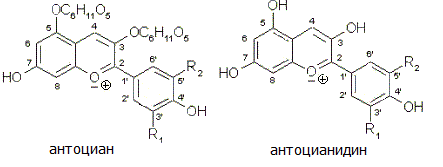 Рисунок 3 - Структурные формулы антоциана и антоцианидина Цвет антоцианидинов является рН зависимым. Антоцианидиновая система претерпевает различные молекулярные преобразования, 7 связанные с изменением рН. В водных растворах существует пять молекулярных видов химического равновесия антоцианидинов: красная пирилиевая соль, бесцветное псевдооснование, синяя хиноидная форма, пурпурный фенолят хиноидной формы, жёлтый халкон (рис. 4). 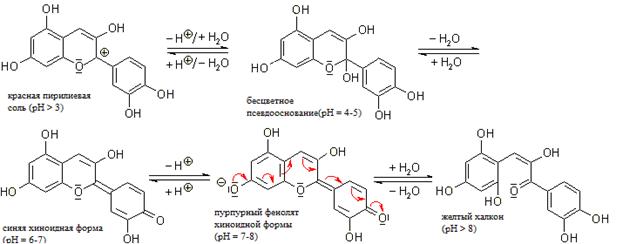 Рисунок 4 - Пять молекулярных видов химического равновесия антоцианидинов На кислых рН = 1-3, антоцианидин существует преимущественно в виде красной пирилиевой соли. Увеличение рН приводит к снижению интенсивности цвета, так как первая форма подвергается гидратации, вследствие которой получается бесцветная. Из-за нуклеофильной атаки воды на 2-положение антоцианидинового скелета и быстрой потери протона у флавилиевых катионов равновесие смещается в сторону синей хиноидной формы при рН <7 и к пурпурному феноляту хиноидной формы при рН <8. При дальнейшем увеличении рН получается светло-желтый халкон. Данное превращение происходит за счет открытия центрального кольца. Цвет щелочным растворам могут быть возвращены путем изменения рН к кислой. Антоцианидиновая форма равновесия переход к равновесию, где концентрация красных ионов флавилиевого катиона преобладает. 8 2 Растворы электролитов. Электролитическая диссоциация кислот, оснований, солей Водные растворы солей, кислот и оснований обладают особенностью – они проводят электрический ток. При этом большинство твёрдых солей и оснований в безводном состоянии, а также безводные кислоты обладают очень слабой электрической проводимостью: плохо проводит электрический ток и вода. Очевидно, что при образовании растворов подобные вещества претерпевают какие-то изменения, обуславливающие возникновение высокой электрической проводимости. Эти изменения заключаются в диссоциации соответствующих веществ на ионы, которые и служат переносчиками электрического тока. Вещества проводящие электрический ток своими ионами, называются электролитами . При растворении в воде и в ряде неводных растворителей свойства электролитов проявляют соли, кислоты и основания. Электролитами являются также многие расплавленные соли, оксиды и гидроксиды, некоторые соли и оксиды в твёрдом состоянии. Кислоты При диссоциации любой кислоты образуются ионы водорода. Поэтому все свойства, которые являются общими для водных растворов кислот, объясняются присутствием гидратированных ионов водорода. Это они вызывают красный цвет лакмуса, сообщают кислотам кислый вкус и т.д. С устранением ионов водорода, например при нейтрализации, исчезают и кислотные свойства. Поэтому теория электролитической диссоциации определяет кислоты как электролиты, диссоциирующие в растворах с образованием ионов водорода. У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей 9 степени, у слабых в меньшей. Чем лучше кислота диссоциирует, тем она сильнее. Основания Поскольку общим для всех растворов оснований является присутствие в них гидроксид-ионов. Поэтому с точки зрения теории электролитической диссоциации основания – это электролиты, диссоциирующие в растворах с отщеплением гидроксид-ионов. Сила оснований, как и сила кислот, зависит от величины константы диссоциации. Чем больше константа диссоциации данного основания, тем оно сильнее. Соли Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионов, образующих соль. При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы Н +. При диссоциации основных солей образуются анионы кислоты и сложные катионы, состоящие из металла и гидроксогрупп. Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют ионы ОН -. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы 10 химического равновесия. Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от С раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует. Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Первое равновесие – диссоциация по первой ступени – характеризуется константой диссоциации, обозначаемой К 1 , а второе - диссоциация по второй ступени – константой диссоциации К 2 . Величины К, К 1 и К 2 связаны друг с другом соотношением К= К 1 К 2 (1) При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Соблюдается неравенство: К 1 >К 2 >К 3 … (2) Это объясняется тем, что энергия, которую нужно затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени. 11 3 Классификация электролитов. Степень диссоциации. Сильные и слабые электролиты Если бы электролиты полностью диссоциировали на ионы, то осмотическое давление (и другие пропорциональные ему величины) всегда было бы в целое число раз больше значений, наблюдаемых в растворах неэлектролитов. Но ещё Вант-Гофф установил, что коэффициент i выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам. Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует в растворе на ионы, и ввёл понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе. Позже было установлено, что электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированны практически нацело. Понятие степени диссоциации к ним по существу неприменимо, а отклонение изотонического коэффициента i от целочисленных значений объясняется другими причинами. Слабые электролиты в водных растворах диссоциируют только частично. Поэтому число ионов в растворах сильных электролитов больше, чем в растворах слабых той же концентрации. И если в растворах слабых электролитов С ионов мала, расстояние между ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг 12 к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов. К сильным электролитам принадлежат все соли; из важнейших кислот и оснований к ним относятся HNO 3 , H 2 SO 4 , HClO 4 , HCl, HBr, HI, KOH, NaOH, Ba(OH) 2 , и Ca(OH) 2 . К слабым электролитам относятся большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат H 2 CO 3 , H 2 S, HCN, H 2 SiO 3 и NH 4 OH. Степень диссоциации принято обозначать греческой буквой a и выражать либо в долях единицы, либо в процентах. 13 4 Реакции обмена в растворах электролитов и условия их протекания. Ионные уравнения При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты. Это говорит о том, что подобные реакции сводятся к одному процессу. Если перепишем уравнение, записывая сильные электролиты в ионной форме, поскольку они существуют в растворе в виде ионов, а слабые – в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул. Рассматривая получившееся уравнение, видим, что в ходе реакции ионы Na + и Cl - не претерпели изменений. Поэтому перепишем уравнение ещё раз, исключив эти ионы из обеих частей уравнения. Получим: Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводится к одному и тому же процессу – к образованию молекул воды из ионов водорода и гидроксид-ионов. Ясно, что тепловые эффекты этих реакций тоже должны быть одинаковы. Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением: Вода - очень слабый электролит и диссоциирует лишь в ничтожно малой степени. Равновесие между молекулами воды и ионами сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца При смешивании раствора какой-либо соли серебра с соляной кислотой или с раствором любой её соли всегда образуется характерный 14 белый творожистый осадок хлорида серебра: Подобные реакции также сводятся к одному процессу. Для того чтобы получить его ионно-молекулярное уравнение, перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме а вещество, находящееся в осадке, в молекулярной. Как видно, ионы Н + и NО 3 - не претерпевают изменений в ходе реакции. Поэтому исключим их и перепишем уравнение ещё раз: Это и есть ионно-молекулярное уравнение рассматриваемого процесса. Здесь также надо иметь в виду, что осадок хлорида серебра находится в равновесии с ионами Ag + и Cl - в растворе, так что процесс, выраженный последним уравнением обратим: Однако, вследствие малой растворимости хлорида серебра, это равновесие очень сильно смещено вправо. Поэтому можно считать, что реакция образования AgCl из ионов практически доходит до конца. Для составления ионно-молекулярных уравнений необходимо знать, какие соли растворимы в воде и какие практически нерастворимы. Ионно-молекулярные уравнения помогают понять особенности протекания реакций между электролитами. 15 5 Ионное произведение воды. Водородный показатель рН растворовЧистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы. Для воды и разбавленных водных растворов при неизменной температуре произведение концентраций ионов водорода и гидросид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды. Растворы, в которых концентрация ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. Если концентрация ионов водорода в водном растворе известна, то тем самым определена и концентрация гидроксид-ионов. Поэтому как степень кислотности, так и степень щёлочности раствора можно количественно охарактеризовать концентрацией ионов водорода. Кислотность и щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают её десятичный логарифм, взятый с обратным знаком. Эта величина называется водородным показателем и обозначается через рН : рН=-lg [H + ] (3) Для измерения рН существуют различные методы. Приближённо реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами , окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространённый индикатор – метиловый оранжевый, метиловый красный, фенолфтолеин. 16 ЗаключениеРастворами называются гомогенные системы переменного состава, в которых растворенное вещество находится в виде атомов, ионов или молекул, равномерно окруженных атомами, ионами или молекулами растворителя. Любой раствор состоит, по меньшей мере, из двух веществ, одно из которых считается растворителем, а другое - растворенным веществом. Растворителем считается компонент, агрегатное состояние которого такое же, как и агрегатное состояние раствора. Деление это довольно условно, а для веществ, смешивающихся в любых соотношениях (вода и ацетон, золото и серебро), лишено смысла. В этом случае растворителем считается компонент, находящийся в растворе в большем количестве. Состав растворов может меняться в довольно широких пределах, в этом растворы сходны с механическими смесями. По другим признакам, таким как однородность, наличие теплового эффекта и окраски растворы сходны с химическими соединениями. Растворы могут существовать в газообразном, жидком или твердом агрегатном состоянии. Воздух, например, можно рассматривать как раствор кислорода и других газов в азоте; морская вода - это водный раствор различных солей в воде. Металлические сплавы относятся к твердым растворам одних металлов в других. Растворение веществ является следствием взаимодействия частиц растворяемого вещества и растворителя. В начальный момент времени растворение идет с большой скоростью, однако по мере увеличения количества растворенного вещества возрастает скорость обратного процесса - кристаллизации. 17 Кристаллизацией называется выделение вещества из раствора и его осаждение. В какой-то момент скорости растворения и осаждения сравняются, и наступит состояние динамического равновесия. Раствор, в котором вещество при данной температуре уже больше не растворяется, или иначе, раствор, находящийся в равновесии с растворяемым веществом, называется насыщенным. Для большинства твердых веществ растворимость в воде увеличивается с повышением температуры. Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы, то образуется пересыщенный раствор. Пересыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор крайне нестабилен и при изменении условий (энергичное встряхивание или внесение активных центров кристаллизации - кристалликов соли, пылинок) образуется насыщенный раствор и кристаллы соли. Раствор, содержащий меньше растворенного вещества, чем насыщенный, называется ненасыщенным раствором. Выводы: Индикаторы играют важную роль в химии и биологии, их используют при титровании. Существует огромное количество видов индикаторов, каждый используется в разных условиях. Каждый индикатор обладает своими свойствами, для их использования нужно это учитывать. Природные индикаторы можно использовать на уроках химии, элективных курсах. 18 Библиографический список Глинка Н.Л. Общая химия: - Л.: Химия 2014.-704с. Под ред. В.А. Рабиновича. Фролов В.В. Химия: - М.: Высш. Шк., 2017.- 543с. Киреев В.А. “Курс физической химии”, М. 2016. Глинка. Н.Л. “Общая химия”, М. 2000. Дей М.К., Д. Селбин “Теоретическая неорганическая химия”, М. 2016. Николаев Л.А. “Общая и неорганическая химия” М. 2015. Краснов К.С. “Физическая химия” М. 2015. 19 |
