рпо. Практикум по сбору и подготовке продукции нефтяных и газовых скважин 2011 Содержание
 Скачать 5.39 Mb. Скачать 5.39 Mb.
|
1.6 Жесткость водыЖесткостью воды называется суммарное содержание растворимых солей катионов Ca(2+), Mg(2+), Fe(2+) [кмоль/кг] [моль/л]. Временная или карбонатная жесткость Жв, Жк обусловлена содержанием в воде гидрокарбонатов 2-х валентных металлов: Ca(HCO3)2, Mg(HCO3)2, Fe(HCO3)2. Постоянная или некарбонатная жесткость Жп, Жнк обусловлена в воде содержанием сульфатов, хлоридов 2-х валентных металлов CaSO4, MgSO4, CaCl2, MgCl2... Жобщ = Жп + Жв = Жнк + Жк (1.73) Жесткость воды оценивается содержанием в ней солей в миллиграммах - эквивалентах на литр воды (мг - экв/л). Типы природных вод классифицируются в зависимости от содержания 2-х валентных катионов. Очень мягкая вода - до 1,5 мг-экв/л Мягкая вода - в 1,5 – 3,0 мг-экв/л Умеренно жесткая вода - в 3,0 – 5,0 мг-экв/л Жесткая вода - в 6,0 - 9,0 мг-экв/л и выше Для характеристики жесткости воды пользуются так называемыми градусами жесткости. 1 российский 1грЖ соответствует 1мг-экв/л Ca(2+) 1 немецкий 1грЖ = 10мг CaO в 1л. воды или 0,357мг-экв/л 1 французский 1грЖ = 10мг CaCO3 в 1л. воды или 1,12мг-экв/л 1 английский 1грЖ = 10мг CaCO3 в 0,7л. воды или 0,284мг-экв/л 1 американский 1грЖ = 1мг CaCO3 в 1л. воды или 0,0199мг-экв/л В зависимости от соотношения между Жобщ и содержанием в ней ионов гидрокарбонатов HCO3- нефтепромысловые сточные воды условно делятся на 2 группы: Iгр Жобщ = Жк + Жнк + Ж(Ca) + Ж(Mg) (1.74) Жп = Жобщ ≥ q(HCO3) - жесткие (кислые) Жп = Ж(Ca) + Ж(Mg) ≥ q(HCO3) - жесткие (кислые) G (HCO3) - содержание ионов гидрокарбонатов IIгр Жобщ = Ж(Ca) + Ж(Mg) (1.75) Жп = Жобщ < q(HCO3) - щелочные (мягкие) pH ≥ 7 вода, содержащая Ca(HCO3)2 имеет щелочную реакцию Ca (HCO3)2 + H2O = Ca (OH) 2 + H2O + CO2 Как устраняют жесткость воды? Жк (временную) карбонатную можно устранить двумя методами: 1. Термический метод - кипячением при 100 0Cв течение 1-2 часов Ca(HCO3) = CaCO3 + CO2 + H2O CaCO3 - выпадает в осадок (накипь) 2. Химический метод: Ca(HCO3)2 + Ca(OH) = 2CaCO3 + 2H2O + CO2 Жп (постоянную) жесткость устраняют химическим способом: 1. Введением соды: CaSO4 + Na2CO3 = CaCO3 + Na2SO4 CaCO3 - накипь, Na2SO4 - раствор 2. Введением Ca (OH) 2, NaOH, NH4OH: MgSO4 + Ca (OH) 2 = Mg (OH) 2 + CaSO4 Mg (OH) 2 - накипь 3. Ионным обменом (введением катионов или анионов) это наиболее экономичный способ. MgSO4 + 2NH4OH = Mg(OH)2 + (NH4)2SO4 В случае если количество ионов HCO3 превышает суммарное содержание ионов Ca и Mg, вся жесткость считается карбонатной. Эквивалентом Э ионов вещества, диссоциированного в воде, называется их молекулярная масса или часть ее, соответствующая единице валентности. Или иначе эквивалентом Э ионов называется отношение молекулярной массы ионов к валентности его в растворе (реакции). Таким образом, для определения эквивалента Э нужно молекулярную массу иона, подсчитываемую как сумму атомных масс элементов его составляющих, разделить на валентность иона nи в данной реакции: Э = Ми / nи (1.76) Таким образом, чтобы выразить содержание ионов вещества в растворе, нужно, например, в миллиграмм-эквивалентах на килограмм (мг∙экв/кг), нужно количество миллиграммов ионов вещества в килограмме раствора разделить на его эквивалент. 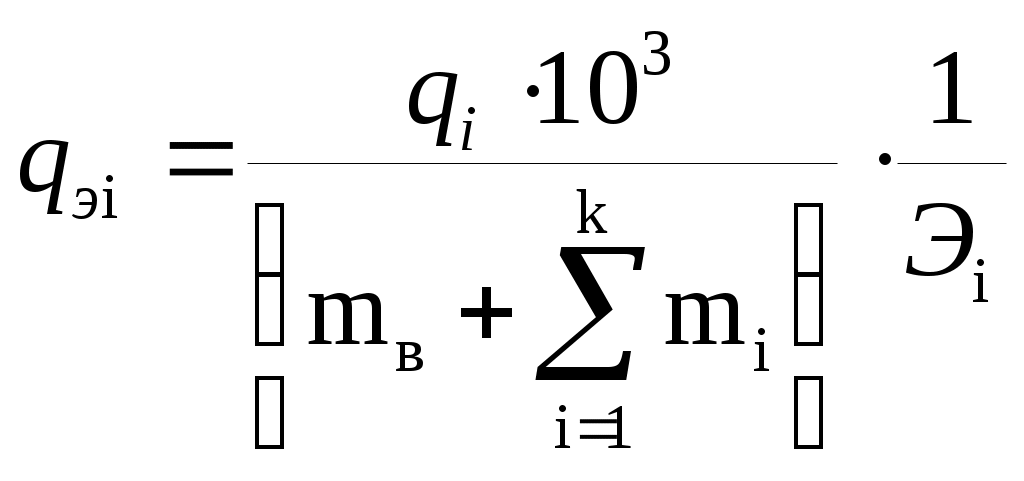 (1.77) (1.77)где qэi -концентрация i-х ионов в растворе, мг-экв/кг; qi -массовая доля i-х ионов в растворе; mi -масса i-х ионов в растворе, кг; mв - масса воды в растворе, кг; k -число разновидностей ионов растворенных веществ в воде (натрий, кальций и т.д.); Эi -эквивалент i-х ионов в данном растворе; qi∙103 –содержание i-х ионов в растворе, мг/кг. Типовые задачиТиповая задача 1.19 В одном литре исследуемой воды содержится 21 мг ионов Mg(2+) и 56 мг ионов Ca(2+). Найти Жобщ. Решение: Зная, что 1мг-эквЖ соответствует содержанию в 1л H2O 12,5 мг Mg(2+) или 20,004 мг Ca(2+) находим 1 мг-экв/л – 12,15 мг Mg(2+) x - 21 мг Mg (2+) x = 21/12,15 = 1,73 мг-экв/л 1 мг-экв/л – 20,4 Ca(2+) x - 56 мг Ca(2+) x = 56/20,04 = 2,79 мг-экв/л Жобщ = Ж (Ca2+) + Ж(Mg2+) = 1,73 + 2,79 = 4,52 мг-экв/л Таким образом, чтобы выразить содержание ионов вещества в растворе в мг-экв в литре или на кг. (мг-экв/кг) нужно количество миллиграммов ионов вещества в литре (или в килограмме) раствора разделить на его эквивалент. qvi = mvi / Эi, где q(v,i) - содержание i-тых ионов, мг-экв/л; m(v,i) - концентрация i-тых ионов вещества мг/л. Типовая задача 1.20 Определить тип пластовой воды, ее карбонатную и некарбонатную, кальциевую и магниевую жесткость и процентно-эквивалентный состав, если известно, что в одном литре пластовой воды содержаться ионы Cl (-) -38065,8 мг; SO42(-) =83,9 мг; HCO3(-) = 482,0 мг; Ca2(+) = 1667,7 мг; Mg2(+) = 249,7 мг и Na =? Решение: Известно, что пластовые воды электронейтральны. Поэтому число молей положительно заряженных ионов (катионов) должно быть равно числу молей отрицательно заряженных ионов (анионов), следовательно, исходный состав пластовой воды необходимо перевести в мг-экв состав в соответствии с: 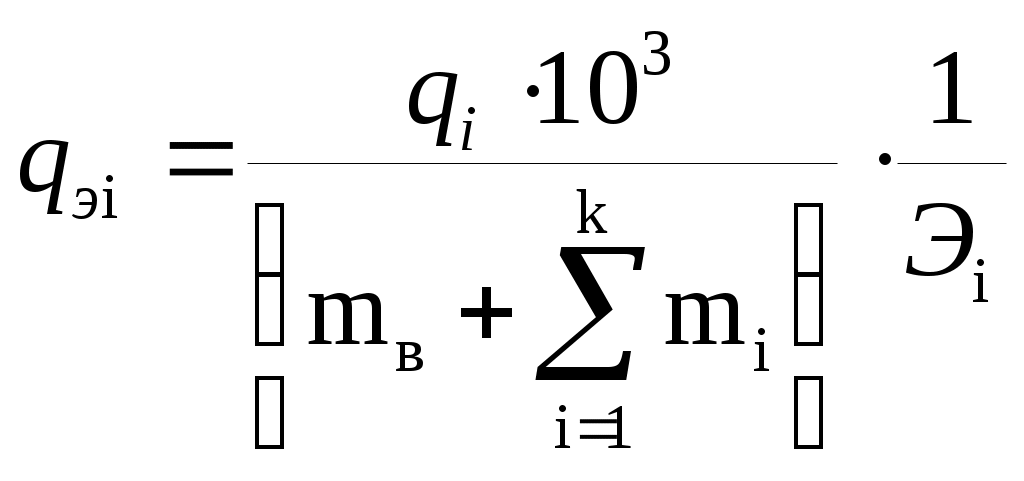 Так как плотность пластовой воды неизвестна, будем выражать концентрацию ионов вещества в растворе в мг-экв на литр раствора из соотношения qvi = mvi / Эi Тогда концентрация ионов хлора Cl(-) в растворе (пластовой воде) будет q (v, Cl (-)) = 38065,8/35,45 = 1073,79 Результаты аналогичных расчетов представлены в таблице 1.16 Для определения концентрации Na(+) 1073,79 + 1,75 + 7,90 = 83,22 + 20,55 + r(Na) r(Na) = 1083,44 -103,77 = 979,67 Жо = Ж (Са) + Ж(Mg) = 83,22 + 20,55 = 103,77 Так как 103,77 > 7,90,т.е. Жо > r(HCO3), то пластовая вода жесткая Как видно из следовательно, некарбонатная жесткость воды равна: Жнк = 103,77 - 7,9 = 95,87 Присутствие ионов натрия не придает воде жесткости Таблица1.16
Задания для домашней и самостоятельной работы по теме1.6Задача 1.21 Рассчитать эквивалентное содержание ионов, представить полученные данные в процентно-эквивалентной форме, вычислить все виды жесткости, классифицировать воду по степени жесткости, определить ТИП пластовой воды, если известно, содержание основных ионов в одном литре пластовой воды. Рассчитать содержание иона натрия. Таблица1.17 Исходные данные к задаче 1.21
1.7 Фазовые состояния углеводородных систем и расчеты разгазирования нефти.Давление и температура в системе сбора и подготовки продукции добывающих скважин непрерывно изменяются, что сопровождается фазовыми превращениями: разгазированием нефти, кристаллизацией парафина, выпадением солей в сложных гидродинамических условиях. Фазовые превращения происходят при отделении нефти и конденсата от их паров в сепараторах, при хранении нефти и конденсата в резервуарах, при образовании и разложении кристаллогидратов углеводородных газов. Сжатие и охлаждение углеводородных газов при компрессионных методах переработки газа и его транспорте сопровождается фазовыми переходами. Фазовые переходы имеют место при выветривании сырого бензина или конденсата в емкостях. Если скорость установления термодинамического равновесия между фазами смеси значительно превышает скорость изменения давления или температуры, паровая и жидкая фазы находятся в термодинамическом равновесии. В такой системе все же возможен переход вещества из одной фазы в другую: в условиях термодинамического равновесия происходит равновесный массообмен компонентов между фазами, т.е. количество каждого компонента, перешедшего из первой фазы во вторую за данный промежуток времени равно количеству компонента, перешедшему из второй фазы в первую за тот же промежуток времени. В замкнутом объеме при термодинамическом равновесии масса или число молей каждого компонента в системе остаются неизменными. В условиях термодинамического равновесия при невысоких давлениях (до 1МПа) и температурах справедливо уравнение Дальтона-Рауля о равенстве парциальных давлений компонентов в паровой и жидкой фазах: где Niv, NiL - молярные концентрации i- го компонента в паровой и жидкой фазах соответственно; P - давление паров смеси; Qi - упругость насыщенных паров i-го компонента в чистом виде при заданной температуре системы. Давление паров смеси над жидкостью в условиях термодинамического равновесия складывается из парциальных давлений компонентов, входящих в жидкость: Таким образом, из уравнения равновесия (1.78) следует, что распределение углеводородов между фазами двухфазной равновесной системы протекает в соответствии с упругостью насыщенных паров углеводородов и их молярными концентрациями. При нарушении равновесия в системе вследствие изменения температуры или давления начинается перераспределение углеводородов между фазами, которое происходит до тех пор, пока парциальные давления каждого компонента в паровой и жидкой фазах не сравняются. Углеводороды, обладающие при данной температуре упругостью насыщенных паров Q большей, чем общее давление Р системы, будут иметь более высокую концентрацию в паровой фазе, чем в жидкой и наоборот, углеводороды с давлением насыщенных паров меньшим, чем давление паров смеси, будут иметь более высокую концентрацию в жидкой фазе, чем в паровой. Следовательно, состояние углеводород, находящихся в смеси, определяется не только давлением и температурой, но еще и составом фаз. Используя законы Рауля и Дальтона-Рауля, зная температуру и давление, при которых находится смесь, по концентрации компонента в одной фазе можно найти его концентрацию в другой. (См. задачи по курсу 'Физика пласта'). Такое решение, при котором определяются только составы паровой и жидкой фаз, не позволяют определить молярные доли паровой и жидкой фаз а, следовательно, рассчитать материальный баланс работы сепараторов, конденсаторов, испарителей, разделительных колонн, процессов сжатия и охлаждения углеводородных газов. Константа фазового равновесия. Рассмотрим многокомпонентную смесь заданного состава в молярных долях, находящуюся в двухфазном состоянии пар-жидкость при условиях термодинамического равновесия. Масса смеси остается постоянной. Давление смеси газов изменяется только за счет изменения объема смеси. Температура смеси поддерживается постоянной. Так как в данном случае имеются три переменные - давление смеси, определяемое ее составом, температура и упругость паров, которая при высоких давлениях смеси углеводородов является функцией не только температуры, но и общего давления, введена так называемая константа равновесия, представляющая собой отношение упругости паров индивидуального углеводорода Qi к давлению смеси Рсм С учетом уравнения (1.78) можем записать: где Кi- константа равновесия i-го компонента при данных термодинамических условиях. Константой фазового равновесия, или коэффициентом распределения i-го компонента в паровую и жидкую фазы, называется отношение молярной доли i-го компонента в паровой фазе к молярной доле его в жидкой фазе. Константа фазового равновесия определяется экспериментально или расчетными методами.(табл.прил.) При низких давлениях и температурах константы фазового равновесия углеводородов мало зависят от состава смеси. Уравнения фазовых концентраций. Процесс изменения соотношения между фазами и переход компонентов смеси из одной фазы в другую при постоянных массе и составе смеси и изотермическом изменении давления называется контактной (однократной) конденсацией или контактным (однократным) испарением в зависимости от того, происходит конденсация компонентов из паровой фазы или испарение компонентов жидкой фазы при изменении давления. Общее число молей - n рассматриваемой исходной смеси равно числу молей паровой nV и жидкой nL фаз при давлении Р и температуре t: Число молей i-го компонента распределяется между фазами следующим образом: где Ni(L+V), NiV, NiL - молярные доли i-го компонента в исходной смеси. Если разделить левую и правую части уравнения (1.82) на n, т.е. написать уравнение материального баланса распределения компонентов в смеси для одного моля смеси, то получим: где NV, NL - молярные доли паровой и жидкой фаз соответственно. если из (1.80) уравнения записать: и подставить эти выражения в (1.83), получим соотношения, связывающие молярную долю i-го компонента в двухфазной системе с общим составом смеси: Уравнения (1.86),(1.87) называются уравнениями фазовых концентраций компонентов смеси. Они позволяют определять концентрацию компонентов в фазах при заданных давлениях, температуре, исходном составе смеси и константах фазового равновесия. Молярная доля паровой фазы Nv определяется из следующих соотношений: где n - число компонентов смеси. Тогда из (1.86), (1.87) с учетом (1.88): Это выражение называется уравнением фазовых равновесий. Решение уравнения фазовых равновесий (1.89) методом последовательных приближений позволяет найти такое значение NV, при котором Затем по уравнениям фазовых концентраций, зная NV, находим молярный состав фаз. Таким образом, алгоритм решения задачи на расчет равновесных составов нефти и газа при сепарации следующий: Определяем по таблице константы фазового равновесия для заданных давления и температуры сепарации для каждого компонента нефтегазовой смеси; Дальнейший расчет проводим в программе EXCEL: Решаем уравнение фазового равновесия методом последовательных приближений, т.е. последовательно задаваясь произвольными значениями NV – мольной долей газовой фазы, добиваемся, чтобы значение правой части уравнения по абсолютной величине было меньше 0,003. Используя уравнения фазовых концентраций и подобранное значение NV, рассчитываем молярный состав жидкой и паровой фазы. Проверкой правильности решения служит выполнение следующих соотношений: Пример расчета фазового равновесия приведен в приложении. Исходя из молярного состава рассчитываем требуемые свойства фаз (молекулярную массу, плотность и другие). Количество нефти и отсепарированного газа: рассчитываем число молей исходной смеси углеводородов: Зная NV, а значит и NL, рассчитываем число молей нефти и число молей газа: Зная число молей и молекулярную массу фазы, можно рассчитать количество каждой фазы: Типовые задачиТиповая задача 1.21 Рассчитать равновесные составы нефти и газа в газожидкостной смеси, поступающей в сепаратор при давлении 0,3 МПа и температуре 38 0С, если известен состав пластовой нефти (молярные доли): азот – 0,001, метан – 0,3298, этан – 0,0345, пропан – 0,0702, изобутан – 0,019, бутан – 0,0467, изопентан – 0,0166, пентан – 0,0249, гексан + высшие – 0,083 и нелетучая часть – 0,3743. Решение: По таблицам из Приложения определить константы фазового равновесия при давлении 0,3 МПа и температуре 38 оС. Для заданного состав смеси при известных константах фазового равновесия по уравнению (1.89) найти молярную долю NV газообразной фазы в смеси, а по уравнениям (1.86) и (1.87) рассчитать, соответственно, составы равновесных жидкости (NiV) и газа (NiL). Для этого задаемся произвольными молярными долями газообразной фазы в смеси. Например, первое приближение NV = 0,5. Затем, используя данные о составе смеси, рассчитывают значение левой части уравнения (1.89). В результате вычислений, при молярных долях газообразной фазы в смеси NV = 0,5; 0,4 ;0,475; 0,47; 0,46; 0,465; 0,4655; 0,467; 0,466 получены соответственно следующие значения левой части уравнения 0,0; -0,1074; 0, 2151; -0,0284; -0,0126; 0,0191; 0,0032; 0,0017; -0,0042; 0,000077. Принимаем как окончательное значение NV = 0,466. Так как исходный состав пластовой нефти, как правило, содержит погрешность, то при решении (1.89) вполне можно ограничиться приближением, при котором абсолютная величина значения правой части уравнения (1.89) отличается от нуля не более, чем на 0.003, что позволяет сократить объем вычислительной работы. Результаты расчета равновесных составов газообразной и жидкой фаз по (1.86) и (1.87) представлены в таблице 1.18. Расчет количества образовавшихся фаз показан в типовой задаче 1.23 Таблица1.18 Равновесные составы смеси нефти и газа при 0,3 МПа и 38 оС
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
