рпо. Практикум по сбору и подготовке продукции нефтяных и газовых скважин 2011 Содержание
 Скачать 5.39 Mb. Скачать 5.39 Mb.
|
Задание для самостоятельной работы по теме 6.3.Задача 6.3 Рассчитать количество ингибиторов гидратообразования, подаваемых в газопровод. Условия движения газа определены давлением (Рн) и температурой газа (tн) в начале газопровода и давлением (Рк) и температурой (tк) в конце газопровода. Известно количество транспортируемого газа (Q) и плотность газа по воздуху, а также начальные концентрации ингибиторов (С1). Таблица 6.5 Исходные данные к задаче 6.3
ПРИЛОЖЕНИЕ К РАЗДЕЛУ 6.3 Графические зависимости к расчету возможности образования гидратов 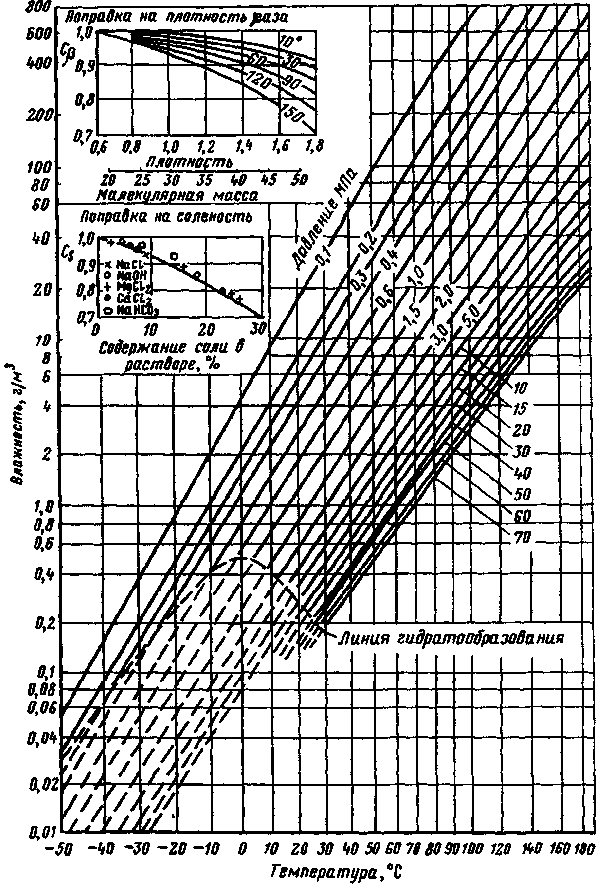 Рис 6.1. Номограмма равновесного содержания водяного пара в природном газе 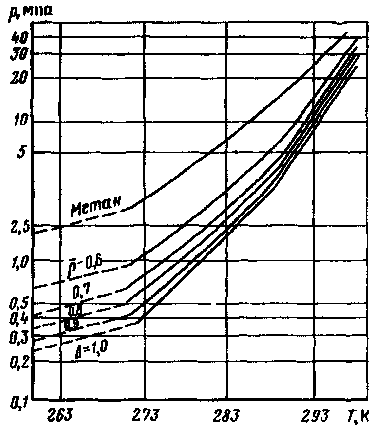 Рис.6.2 Зависимости для определения равновесных условий начала образования гидратов для природных газов разной относительной плотности 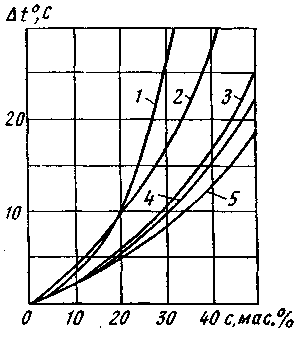 Рис. 6.3. Снижение температуры гидратообразования в зависимости от концентрации отработанного ингибитора: 1 —СаСl2; 2 — СН3ОН; 3 —ТЭГ; 4 — ДЭГ; 5 — ЭГ ПРИЛОЖЕНИЕ6.4.Отложение солей.Интенсивность отложения солей в трубах зависит: 1 - От режима движения потока Р.И. Шищенко выведена эмпирическая формула для оценки необходимой скорости потока от веса дисперсных частиц (в основном песчаных примесей) в нефтяной системе. V > 0.21 * (ρ1 - ρ2) * Д / (g * ρ * υ) (6.24) где V - средняя скорость потока [м/с],ρ1, ρ2 - плотности дисперсных частиц и нефти [кг/м3], Д - внутренний диаметр трубопровода [м],υ - μ/ρ - кинематическая вязкость нефти [м2/с], g - ускорение свободного падения = 9.81 м/с2 Относительна плотность наиболее часто встречающихся минералов ρλв
ρλв = ρм/ρв ρм = ρλв * ρв ρв = 1000 кг/м3 На некоторых месторождениях (Самотлор, м-я Куйбышевской обл., Азербайджана и др.) в процессе эксплуатации скважин наблюдается интенсивное отложение солей в рабочих органах ЭЦН и штанговых насосов, НКТ, выкидных линиях, сборных коллекторах. Отложения солей в основном наблюдаются в ОБВОДНЕННЫХ скважинах. Отлагающиеся соли могут быть как водорастворимые (NaCl, CaCl2), так и водонерастворимые: CaCO3, MgCO3, CaSO4*2H2O (гипс),MgSO4, BaSO4, силикаты кальция и магния: CaSiO3, MgSiO3 и др. Состав отложений: соли - 70-88%, нефтепродукты - 2-25%, окислы железа (продукты коррозии) - 0,5-5%, окись кремния - 1-5%. Состав отложений на оборудовании тепловой подготовки нефти (%): Са(Mg, Mn)CO3 - 78,28; СаSO4*2H2O - 6,65; SiO2 - 3; гидроксиды железа FeO(OH) или Fe2O3*nH2O - 2,50; S и нефтяная органика - 8. Основная причина образования и отложения солей - это нарушение термодинамического карбонатного равновесия, обусловленное снижением температуры и давления при подъеме нефти и пластовой воды от забоя до устья скважины и далее по трубопроводам. Известно, что в пластовых водах углекислый газ находится в 1) свободной и 2) связанной (растворенной) формах: недиссоциированные молекулы угольной кислоты H2CO3 (концентрация их незначительна), бикарбонат-ионы HCO3(-) и карбонатные ионы CO3(2-). Слабая углекислота ступенчато диссоциирует: Н2СО3 ---> Н (+) + НСО3(-) (1) <--- НСО3(-) ---> Н (+) + СО3(2-) (2) <--- Из уравнений (1) и (2) следует, что степень диссоциации Н2СО3 и, следовательно, величина отношений [НСО3(-)] / [Н2СО3] и [СО3(2-)] / [Н2СО3] зависят от концентрации ионов водорода, т.е. от рН. Установлено, что в кислых и слабокислых водах (рН=1-3 и рН=4-6) доминирует недиссоциированная кислота; в нейтральных и слабощелочных водах (рН=6-8 и рН=8-10) - ион НСО3(-); в сильно щелочных водах (рН=11-14) - ион СО3(2-). В пластовых условиях при постоянных давлении и температуре в водных растворах углекислых соединений существует динамическое равновесие между различными формами углекислоты: 2НСО3(-) ---> СО3(2-) + СО2 + Н2О (3) <--- Как следует из уравнения (3), карбонатное равновесие определяется количеством свободного СО2. При наличии в пластовых водах одновременно ионов Са(2+), Мg(2+) и НСО3(-) образуются очень непрочные растворимые бикарбонаты кальция и магния: Са(2+) + 2 НСО3(-) ---> Са(НСО3)2 (4) <--- Mg(2+) + 2 НСО3(-) ---> Mg(НСО3)2 , <--- равновесие которых также поддерживается за счет свободного углекислого газа. В природных ПРЕСНЫХ водах бикарбонат кальция находится в динамическом равновесии с карбонатом кальция и диоксидом углерода: Са (НСО3)2 ---> СаСО3 + СО2 + Н2О (5) <--- На основе реакций (4) и (5) можно записать: Са(2+) + 2 НСО3(-) ---> СаСО3 + СО2 + Н2О , (6) <--- откуда следует, что любое воздействие, в результате которого СО2 удаляется из системы (например, при повышении температуры или увеличении щелочности системы), приводит к сдвигу химического равновесия реакции (6) вправо и выпадению осадка карбоната кальция СаСО3. В соответствии с этим воду, содержащую равновесное количество СО2, называют СТАБИЛЬНОЙ; воду, имеющую избыток или недостаток СО2, называют НЕСТАБИЛЬНОЙ: при недостатке СО2 вода перенасыщена СаСО3 и способна самопроизвольно его выделять; при избытке СO2 вода недонасыщена СаСО3 и способна его растворять. Такая вода называется еще и агрессивной, поскольку не допускает образования на металлической поверхности защитных карбонатных пленок, что приводит к сильной коррозии металла. При движении нефти, газа и пластовой воды по стволу скважины, выкидным линиям и сборным коллекторам давление в них понижается и растворимость СО2 в воде уменьшается, в результате чего из нее выделяется диоксид углерода, при этом нарушается карбонатное равновесие (6). Для восстановления равновесия избыток бикарбонат-ионов НСО3(-) удаляется из системы путем превращения бикарбонатов кальция и магния в карбонаты (5), которые выпадают в осадок и отлагаются на стенках труб, снижая их пропускную способность. Итак, причинами выпадения солей являются: - снижение давления (сдвиг равновесия реакции (6) вправо); - повышение температуры (при снижении температуры потока равновесие реакции (6) смещается влево, т.е. уменьшается выделение СО2 и выпадение кристаллов солей затормаживается; однако, снижение давления более интенсивно влияет на равновесие рассматриваемой реакции, чем снижение температуры); - изменение давления и температуры или смешение вод одного типа, но с разной концентрацией ионов, может вызвать пресыщение раствора растворимой солью и привести к её выпадению из раствора; растворимость других компонентов при этом также изменяется; - изменение химического состава пластовых и попутных вод при смешении вод различных типов. В связи с очень сложным механизмом образования солей методы прогнозирования солеотложения недостаточно обоснованы, поэтому методы ПРЕДУПРЕЖДЕНИЯ используются редко. Методы борьбы с отложениями солей: химические, физические и технологические. Химические методы борьбы с солеобразованием в скважинах и сборной системе применяют, главным образом, при выпадении карбонатных (СаСО3, MgСО3) и сульфатных (CaSO4,MgSO4) солей, т.е. водонерастворимых. В данном случае применяют ингибиторы отложения солей: гексаметафосфатнатрия (NaPO3)6 и триполифосфат натрия (Na5P3O10) как в чистом виде, так и с добавками различных присадок. Сущность метода в том, что при образовании кристаллов солей они тут же сорбируют из раствора ингибитор, в результате этого на поверхности кристаллов возникает коллоидная оболочка, препятствующая прилипанию их к поверхности труб. С отложениями водонерастворимых солей можно бороться с помощью растворов соляной кислоты: CaCO3 + 2HCl ---> CaCl2 + H2O + CO2, (7) переводя нерастворимую соль в водорастворимую. Однако, такой прием ведет к усиленной коррозии оборудования. Невысокую эффективность защиты от отложений солей (18-22%) может обеспечить использование деэмульгаторов: дисольвана, проксамина, сепарола и др. Перспективными физическими методами являются воздействия магнитного поля и ультразвуковых колебаний. При обработке воды магнитным полем создаются условия для более быстрого образования кристаллов, которые затем выпадают в виде аморфного шлама, легко удаляемого из трубопровода потоком. При непрерывном воздействии ультразвукового поля на границу раздела двух фаз (кристалл-жидкость) происходит отщепление мельчайших кристаллов. Опыты по УЗ-обработке нефти, содержащей минерализованную пластовую воду, подтвердили, что при действии УЗ-волн на жидкость осадка в теплообменных аппаратах УПН получается меньше, а часть его в виде мелких кристаллов находится в воде во взвешенном состоянии. Получаемые рыхлые осадки легко уносятся потоком жидкости. Эффективность обработки водонефтяной смеси ультразвуком достигает 80%, а при совместной обработке деэмульгатором увеличивается до 98%. Технологические способы предупреждения отложения солей направлены на: 1) сдвиг карбонатного равновесия (6) влево; 2) исключение контакта пластовой воды со стенками трубопровода. Для этого повышают давление в системе или вводят свободный диоксид углерода, или подкачивают пресную воду. Повышение давления и ввод СО2 увеличивает концентрацию СО2 в водном растворе, создавая тем самым его избыток и сдвигая равновесие в требуемом направлении. С этой точки зрения высоконапорные системы сбора продукции предпочтительны. Для борьбы с образованием и отложением водорастворимых солей применяют метод подачи в продукцию скважин пресной воды. Этот метод может применяться в двух вариантах: 1) непрерывный подлив пресной воды на забой скважины в процессе её эксплуатации; 2) периодический подлив воды в затрубное пространство. Первый способ позволяет исключить ВОЗМОЖНОСТЬ выпадения солей в скважине и нефтесборной системе благодаря переводу насыщенного раствора солей в ненасыщенный, в результате чего кристаллы не образуются. Смешение высокоминерализованной воды с пресной, подливаемой в затрубное пространство, позволяет компенсировать уменьшение растворимости солей из-за снижения температуры потока. Второй способ рассчитан на периодическое растворение солей в скважине и сборной системе по мере накопления в них осадка. Образование нерастворимых соединений при смешении нагнетаемой и пластовой вод может являться одной из причин возрастания фильтрационного сопротивления при закачке воды в пласт. В большинстве случаев воды, закачиваемые в нефтяные залежи, по солевому составу отличаются от пластовых вод этих залежей. При закачке воды, содержащей сульфат-ионы, в пласты, насыщенные хлоркальциевой водой, в порах пласта в результате смешения этих вод может образоваться сернокислый кальций, выпадающий в осадок в виде кристаллов гипса: SO4 (2- ) + Ca (2+) + 5 H2O ---> CaSO4 * 5 H2O (8) Малорастворимые соединения, выпадающие из воды в осадок, могут образоваться при закачке воды, содержащей бикарбонат кальция, в пласты с высокой температурой: 2 НСО3(-) ---> СО3(2-) + СО2 + Н2О (9) СО3(2-) + Са(2+) ---> СаСО3 (10) Эксплуатация обводнившихся скважин в случае несовместимости закачиваемой и пластовой воды иногда осложняется образованием пробок нерастворимых солей на забое скважин и в эксплуатационных трубах. При возможности такого осложнения следует определять солевой состав воды для заводнения, исследуя совместимость её с пластовой водой. Воды, отобранные с забоев нефтяных скважин после длительной безводной эксплуатации до начала их обводнения, представляют высокоминерализованные рассолы, близкие к насыщению и даже насыщенные сульфатом кальция, и могут явиться источником гипсообразования на забоях эксплуатационных скважин. Используя формулу (11),предложенную Озолиным Б.В., и Шустефом Н.Д. для расчета ПРЕДЕЛЬНОГО количества сульфат-ионов в воде при данных условиях (минерализация > 600 мг-экв/100 г), и зная ДЕЙСТВИТЕЛЬНОЕ содержание сульфат-ионов можно оценить степень насыщенности воды сульфатом кальция и, таким образом, судить о вероятности выпадения его в осадок: 108 SO4(2-) = ----------- , (11) Са(2+) * d2 где Са(2+) и SO4(2-) - содержание ионов кальция и магния, мг-экв/100 г, d - плотность воды, г/см3. Типовые задачи по теме 6.4Типовая задача 6. Известен состав пластовой воды и ее плотность. Рассчитать степень насыщенности воды сульфатом кальция. Дать прогноз образования гипса в скважине. Дано:
Решение: 1. Рассчитываем ПРЕДЕЛЬНОЕ количество сульфатов, способных растворится в водах при данных условиях: [SO4(2-)] = 108 / [Ca(2+)] / ρ2, мг-экв/100г [SO4(2-)] = 108 / 38 / 1,1792 = 2,04 мг-экв/100г 2. Сравниваем предельное содержание сульфатов с реальным: 2.04 - 100%, 0.45 - х; х = 22.05% Раствор насыщен сульфатами на 22.05%. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
