лабы по химии. Правила техники безопасности в химической лаборатории При работе в химической лаборатории необходимо соблюдать следующие правила
 Скачать 1.5 Mb. Скачать 1.5 Mb.
|
|
Б  АШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ АШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТХимический факультет  ЛАБОРАТОРНЫЙ ЖУРНАЛ по общей и неорганической химии на учебный 2021/2022 год Студент Овинов Евгений Владимирович Институт (факультет) __ФТИ_____________ Группа 3ПМФ УФА Р  ИЦ БашГУ, ИЦ БашГУ, 2021 2021Правила техники безопасности в химической лаборатории При работе в химической лаборатории необходимо соблюдать следующие правила: Все лабораторные работы должны быть предварительно спланированы студентом и согласованы с преподавателем. В лаборатории следует работать в хлопчатобумажном халате, волосы должны быть убраны. Строго запрещается принимать пищу в лаборатории. До и после выполнения работы необходимо вымыть руки. Работать нужно аккуратно, результат опыта зависит от чистоты проведения эксперимента. Все опыты с ядовитыми и пахучими веществами выполнять в вытяжном шкафу. Химические реактивы брать только шпателем, пинцетом или ложечкой. Неизрасходованные реактивы не высыпать и не выливать обратно в те сосуды, откуда они были взяты. Жидкости переливать непосредственно через воронки. Склянку, из которой переливают жидкость, необходимо держать этикеткой к руке во избежание её порчи. При нагревании растворов и веществ в пробирке необходимо использовать держатель. Отверстие пробирки должно быть направлено в сторону от себя и других работающих. Нельзя наклоняться над сосудом, в котором происходит нагревание или кипячение жидкости. При необходимости определить запах выделяющихся при реакции газов нужно легким движением ладони направить струю газа от горла сосуда к себе и осторожно вдохнуть. При разбавлении концентрированных кислот и щелочей небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот. Опасные продукты реакции, а также концентрированные кислоты и щелочи сливать только в соответствующие банки в вытяжном шкафу. Лабораторная работа № 1 Приготовление водного раствора тиосульфата натрия из кристаллогидрата Цель работы: освоить навыки приготовления раствора заданной концентрации и методики его количественного анализа. Теоретическая часть Раствор это - однородная система, в состав которой входят молекулы двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах. Количественный состав растворов выражается концентрацией. Концентрацией раствора называется весовое и или объемное содержание растворенного вещества, находящиеся в определенном весовом количе-стве или в определенном объеме раствора или растворителя. Массовая доля растворённого вещества - это величина, равная отношению массы растворённого вещества к массе раствора. Молярная концентрация - количество вещества (число молей) компонента в единице объёма смеси. [ моль/м³] Нормальная концентрация количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Моляльная концентрация – количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Мольная доля - способ выражения концентрации, отношение количества вещества к общему количеству всех веществ, содержащихся в смеси: где. — мольная доля вещества A в смеси; — количество вещества A, содержащееся в смеси (измеряется в молях); — сумма количества вещества всех компонентов раствора (измеряется в молях). Экспериментальная часть Плотность раствора измеряется с помощью ареометра. Ареометр (другое название - денсиметр) представляет собой запаянный стеклянный сосуд. В верхней узкой части ареометра имеется бумажная шкала с указанием плотности в г/см3. Цена деления обычно 0,001 г/см3. Ареометры общего назначения позволяют измерять плотность жидкостей в диапазоне 0,700 – 1,840 г/см3. Перед определением плотности необходимо выбрать ареометр с нужным пределом измерений. Если ареометр предназначен для измерения плотностей больших, чем измеряемая, то он тонет в растворе, если наоборот, то жидкость выталкивает его. Следует помнить, что плотность воды составляет 1 г/см3 при температуре 20oС, а водные растворы солей и большинства неорганических кислот имеют более высокую плотность. Для измерения плотности раствора жидкость наливают в стеклянный цилиндр с диаметром, превышающим диаметр ареометра, и высотой не меньшей, чем длина ареометра. Затем ареометр осторожно опускают в жидкость. Измерение производят, если ареометр свободно плавает в растворе, не касаясь дна и стенок цилиндра. Показания определяют по нижнему краю мениска жидкости (рис., б). 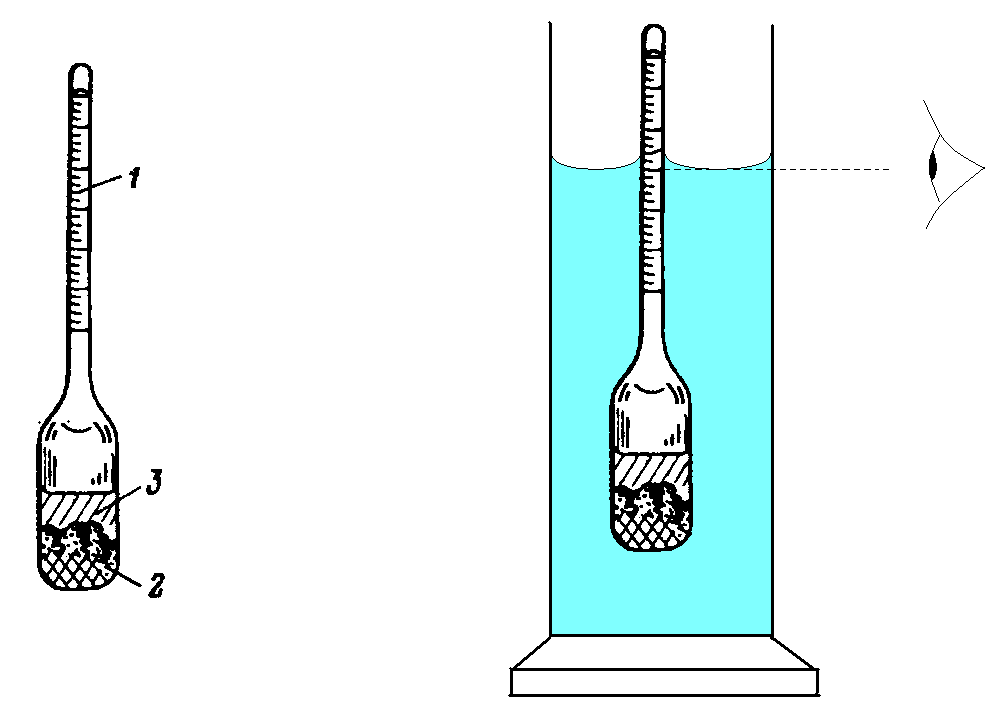 а б Рис. Ареометр (а) и измерение плотности ареометром (б): 1 – шкала; 2 – балласт; 3 – связующее вещество Отсчет делений шкалы производится сверху вниз. Если измеренное значение плотности раствора не совпадает с табличным, то для расчета массовой доли можно использовать метод линейной интерполяции. Для этого из таблицы плотностей выбирают два последовательных значения плотности раствора, между которыми находится измеренное значение, и соответствующие им массовые доли вещества в растворе. Суть метода линейной интерполяции можно проиллюстрировать графически: 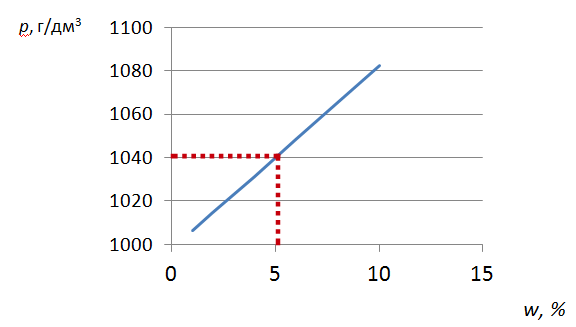 Задание: На миллиметровой бумаге формата А5 постройте график зависимости массовой доли от плотности раствора Na2S2O3 (метод интерполяции) согласно имеющимся справочным данным: РастворNa2S2O3 (20oC)
w, % Опыт 1. Приготовление раствора заданной концентрации Задание: Приготовить 50мл 5%-ного раствора тиосульфата натрия в пересчете на безводную соль из кристаллогидрата Na2S2O3,5H2O. Рассчитайте массу безводной соли: mр-ра=Vρ=50ml*1,015=50,75 g. wр-ра/100%=mб.с=1,015 г Рассчитайте массу кристаллогидрата Na2S2O3,5H2O: mк.р= μк.р* mб.с /μб.с= 1,59г Рассчитайте массу воды: Mводы= mр-ра - mк.р = 49,16 г Взвесьте на технохимических весах необходимую навеску соли в стакане с точностью до 0,01 г., запишите массу навески: 1,59 г. Мерным цилиндром отмерьте воду, влейте ее в стакан с солью и перемешайте стеклянной палочкой. Измерьте ареометром плотность полученного раствора, нанесите это значение на график и определите концентрацию раствора тиосульфата натрия: ρ=1,015 г/мм Определите по графику массовую долю вещества в растворе, отвечающую найденной плотности: w=2% Рассчитайте абсолютную ошибку эксперимента по формуле А = |ωэксп. – ωтеор.|=0 Рассчитайте относительную ошибку эксперимента в процентах ξ = (|ωэксп. – ωтеор.|/ ωтеор.).100% Сделайте вывод: Мы освоили навыки приготовления раствора заданной концентрации и методики его количественного анализа. В результате выполнения работы экспериментальные данные сошлись с теоретическими. Проверил преподаватель кафедры _________________________ ____________________ (Подпись, дата) И.О. Фамилия Лабораторная работа № 2 Электролитическая диссоциация. Водородный показатель Цель работы: изучить электрическую проводимость растворов электролитов и зависимость её от различных факторов; научиться предсказывать направление обменной реакции в растворах электролитов освоить навыки приготовления раствора заданной концентрации и методики его количественного анализа. Теоретическая часть . Электролиты - вещества, растворы и расплавы которых проводят электрический ток. Процесс распада молекул вещества на ионы под действием растворителя называется электрической диссоциацией. Основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-анионы OH:_ NaOH → Na+ + OH-- NH4OH ↔ NH4(+) + OH(-) Кислоты– это электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н+ HCl → H(+) + Cl(-) HNO3 →Н (+) + NO3(-) Sr(OH)2 H2SO4 → H(+) + HSO4(2-) H3PO4 →_ Н(+) + Н2РО4 (-) Амфотерные гидроксиды диссоциируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются ионы: катионы водорода Н + и гидроксид-анионы ОН. К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома (III) Cr(OH)3, свинца (II) Pb(OH)2 и др. Например, при диссоциации Zn(OH)2 в водном растворе одновременно присутствуют: ___________= H2ZnO2 ↔ Zn(OH)2 = _____________. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металлов а также катион аммония ( NH+4)\nи анионы кислотных остатков Na2SO4 →2 Na+ + SO42– Ca3(PO4)2 → 3Ca 2+ + 2PO4 3-. Кислые соли при растворении в воде образуют ионы H+. KHSO3 → HCO3– H+ + CO32–, сложный анион диссоциирует частично: HSO3- H+ + CO32– Основные соли при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН— Al(OH)2Cl → Al(OH)2(+)+Cl(-) Двойные соли диссоциируют на два катиона образуют два типа катионов металла. KAl(SO4)2 → K+ + Al3+ 2SO42- Na2NH4PO4 → NH4(+) + NH4HРО4(-). Смешанные соли диссоциируют на катион металла и анионы нескольких кислотных остатков. ZnClNO3 → Zn2+ + Cl- + NO3- AlSO4Cl → Al3+ + SO42− + Cl− . Степень диссоциации показывает какая доля от общего количества электролита распадается на ионы Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, внешних условий (температуры, давления). Для сильных электролитов ɑ > 30%, для средних электролитов 30%>ɑ>3%, для слабых электролитов ɑ< 3%. Равновесия в слабых электролитах подчиняются закону разведения Оствальда. Экспериментальная часть Прибор для испытания электрической проводимости 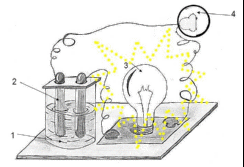 веществ (1 — исследуемый раствор, 2- электроды, 3- лампа накаливания, 4 — электрическая сеть) веществ (1 — исследуемый раствор, 2- электроды, 3- лампа накаливания, 4 — электрическая сеть)Растворы для опытов: растворы соляной кислоты, гидроксида натрия, сульфата натрия; этанол или раствор сахарозы, водопроводная и дистиллированная вода, CH3COOHконц., CH3COOHразб.., NH4OHконц., NH4OHразб. Опыт 1а. Изучение электрической проводимости растворов Запишите наблюдения, отмечая степень накала лампы: H2Oводопроводная ярко. Н2Одистиллированная нет накала. Напишите уравнение диссоциации воды: H2O________ H+ + OH- ______________ Запишите наблюдения, отмечая степень накала лампы: CH3COOHконц. ___нет накала_____________ CH3COOHразб. ______начинает накаляться________________ NH4OHконц. _____нет накала___________________________________ NH4OHразб. ________начинает накаляться__________________________________ CH3COOHконц.+ NH4OHконц. __________якро горит_________________________ HCl ___________есть накал______________________________. KOH ___________есть накал_________________________________ Напишите уравнения диссоциации электролитов: CH3COOH_______ СН3СОО (-) + Н (+) ___________ NH4OH______________ NH4(+) + OH(-) ______________________ CH3COONH4_________ NH4+ + CH3COO—____________________ HCl ________________ H+ + Cl-. ___________________________ KOH _________________K+ + OH-_______________________________ Сделайте вывод: Вода водопроводная пропускает ток, дистилированная нет. Кислоты и щелочи не пропускают ток, пока концентрированы. Щелочь + кислота образует соль и воду, соотвественно пропускает ток. Опыт 2. Окраска индикаторов Напишите уравнение диссоциации серной кислоты: H2SO4 _______ H+ + HSO4(2 -)_______________________ Напишите уравнение диссоциации гидроксида калия: КOH __________ K+ + OH -__________________________. Заполните таблицу
Опыт 3. Равновесие в растворе слабого основания. Влияние одноименного иона на степень диссоциации слабого электролита (смещение равновесия диссоциации) Напишите уравнения диссоциации: NH4OH ________________ NH4+ + OH - ____________________ NH4Cl _______________ NH4+ + Cl— _____________________________ При добавлении фенолфталеина к раствору аммиака наблюдается _малиновое_____окрашивание. В присутствии хлорида аммония цвет раствора светлеет. Сделайте вывод: Фенолфталеин окрашивает раствора аммиака в малиновый цвет, что говорит о щелочных свойствах раствора аммиака. _______________________________________________________________ _______________________________________________________________ ______________________________________________________________________________________________________________________________. Опыт 4. Равновесие в растворе слабой кислоты Напишите уравнения диссоциации CH3COOH _____ СН3СОО (-) + Н (+) __________________________ CH3COONa ____ CH3COO(-) + Na(+) __________________________ КД (CH3COOH) = _____________ 1,78·10-5 _____________________ При добавлении метилового оранжевого к раствору уксусной кислоты наблюдается __красное____ окрашивание. В присутствии ацетата натрия цвет раствора _____станет желтым___________________. Сделайте вывод: Метилоранж краснеет в кислой среде, присоединяя ион водорода - окраска индикатора определяется концентрацией [H+] При добавлении к уксусной кислоте ацетата натрия концентрация ионов водорода уменьшается и индикатор меняет цвет. Цвет метилоранжа меняется в интервале pH 3,1-4,4, тем временем как для уксусной кислоты pKa=4,76. Таким образом, при добавлении к раствору уксусной кислоты сходного количества ацетата метилоранж станет полностью жёлтым. Проверил преподаватель кафедры _________________________ ____________________ (Подпись, дата) И.О. Фамилия | |||||||||||||||||||||||||
