Билеты органика. Предмет и объекты органической химии. Возникновение теоретических представлений об органической химии. Учение о типах и радикалах
 Скачать 85.36 Kb. Скачать 85.36 Kb.
|
|
Предмет и объекты органической химии. Возникновение теоретических представлений об органической химии. Учение о типах и радикалах. Эмпирический период. Термин «органическая химия» предложен Берцеллиусом в 1808 году. Шведский химик Й. Берцелиус дает понятие «органической химии как химии животных и растительных веществ». Сам Берцелиус пришел к выводу, что органические соединения невозможно синтезировать из неорганических, полагая, что это можно сделать только с помощью «жизненной силы» (теория «витализма»). Первое определение: наука, изучающая строение и свойства органических соединений. Шорлеммер: органическая химия – химия углеводородов и их производных. Органическая химия – наука, изучающая состав, строение, физические и химические свойства органических веществ и их применение. Органическими веществами называют вещества, молекулы которых состоят из атомов углерода, водорода, кислорода, азота, серы и некоторых других и содержат в своем составе c-c и c-h связи, причем наличие их обязательно. Предмет – органическое вещество. Предмет органической химии включает следующие цели, экспериментальные методы и теоретические представления. 1. Выделение индивидуальных веществ из растительного и животного или ископаемого сырья. 2. Синтез и очистка соединений. 3. Определение структуры веществ. 4. Изучение механизмов химических реакций. 5. Выявление зависимостей между структурой органических веществ и их свойствами. Аналитический период (конец XVIII – середина XIX в.). Исследования по установлению состава вещества. В 1828 г. немецкий химик Ф. Велер синтезировал типичное органическое соединение – мочевину – из неорганического – цианата аммония. В 1842 г. Н. Н. Зинин восстановлением нитробензола получил анилин, который ранее получали из растительного сырья. Далее в 1845 г. немецкий химик А. Кольбе синтезировал уксусную кислоту, используя для этого древесный уголь, серу, хлор и воду; М. Бертло получил вещество, относящееся к классу жиров (1854 г.). В 1861 г. А. М. Бутлеров синтезировал сахаристые вещества из формальдегида. Структурный период (вторая половина XIX – начало XX в.). Из ранних структурных теорий следует отметить теорию радикалов (Ж. Дюма и Ю. Либих 1837 г.) и теорию типов (Ш. Жерар 1851 г.). Согласно теории радикалов, эти частицы сохраняются без изменения, поэтому Дюма и Либих определили органическую химию как химию сложных радикалов. Группа из двух и более атомов, способная переходить из одной молекулы в другую была названа радикалом от латинского слова «корень», поскольку в то время считали, что радикалы являются своеобразными корнями, из которых вырастают молекулы. Авторы теории полагали, что радикалы играют в органической химии роль атомов и не могут изменяться при химических превращениях. Сильное влияние на признание теории радикалов оказали исследования «горько-миндального масла» – бензойного альдегида. При изучении его реакций был получен ряд соединений, неизменно содержащих в своем составе радикал С7Н5О, названный бензоилом: С7Н5О–Н водородистый бензоил (бензойный альдегид); С7Н5О–Cl хлористый бензоил; С7Н5О–ОН гидрат окиси бензоила (бензойная кислота); С7Н5О–ОNa бензойнонатриевая соль и т. д. Результаты исследований были восприняты как доказательство того, что органические соединения построены из радикалов, так же как неорганические из атомов. На определенном этапе развития теория радикалов сыграла свою положительную роль, так как было сделано важное обобщение: при химических реакциях группы атомов (радикалы) в неизменном виде входят в образующиеся во время этих реакций молекулы. Удар по теории радикалов нанесло открытие реакции металепсии – замещения атома водорода на атом хлора при взаимодействии Cl2, в результате чего происходит изменение радикала. Сторонники теории типов (О. Лоран, Ш. Жерар, А. Дюма) исходили из того, что невозможно определить строение вещества опытным путем, однако можно классифицировать органические вещества по типам реакций, в которые эти вещества вступают. Первоначально насчитывали четыре, затем пять типов органических соединений: тип водорода, хлористого водорода, воды, метана и аммиака. При такой классификации одно и то же вещество можно было относить к разным типам. Теория типов позволяла как-то сгруппировать и классифицировать большой экспериментальный материал, накопившийся к этому времени, но не могла предсказать существование и пути синтеза неизвестных соединений. В 1858 Купер предложил обозначать черточками связи между атомами. Учение А. М. Бутлерова о химическом строении веществ. Значение учения. В 1861 Бутлеров сформулировал понятия химического строения и предложил теорию строения органических веществ. Теория строения органических веществ, которая послужила толчком для развития органической химии как самостоятельной науки. В становление этой теории внесли свой вклад шотландский ученый А. Купер и немецкий химик А. Кекуле. Они сформировали представление о 4-валентном углероде и высказали идею о способности углеродных атомов соединяться в длинные цепи. Основные положения: Атомы в молекулах соединены друг с другом химическими связями в соответствии с их валентностями, Атомы в молекулах органических веществ соединены в определенной последовательности, что обуславливает химическое строение, Свойства органических веществ зависят не только от качественного и количественного состава, но и от строения их молекул, т.е. порядка связи атомов в молекуле и характера связи между ними (изомерии), Атомы, входящие в состав молекул органических веществ, оказывают друг на друга взаимное влияние, причем особо сильное влияние оказывают непосредственно связанные, Химическое строение вещества можно определить в результате изучения его химических превращений и наоборот, по строению вещества можно характеризовать его свойства. В настоящее время теорию Бутлерова можно сформулировать следующим образом: химические и физические свойства органических веществ определяются начальным и конечным составом, а также химическим, пространственным и электронными строениями молекулы. Первым практическим следствием является возможность написания структурных формул, с помощью которых можно отразить строение молекулы сочетанием символов атомов и черточек, обозначающих химические связи. Правила: Атомы углерода в молекулах органических соединений всегда 4-валентны, Атомы углерода способны образовывать цепи, Атомы углерода могут быть соединены 2 и 3 связями, Атомы углерода могут образовывать циклы, Атом или группа атомов определенным образом, соединенных друг с другом и придающие молекулам органических соединений характерные свойства называются функциональными группами. Теория Бутлерова в последствии была дополнена теорией пространственного расположения атомов в молекулах. В начале 20 века в органическую химию были введены электронные представления о химической связи и структуре соединения. Позднее были предложены 2 метода описания химической связи. Сейчас разработана теория химических реакций. Она объясняет, что происходит с энергией системы при образовании химически связей. Классификация органических реакций. По направлению: А) присоединение (A) В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются: CH2=CH-CH3 + HBr →CH3-CHBr-CH3 Б) замещение (S) Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку): CH3CH2Cl + KOH (водн. р-р) → CH3CH2OH + KCl щелочной гидролиз хлорэтана В) отщепление (E) В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета: CH3-CH2Cl + NaOH →CH2=CH2 + NaCl + H2O Г) перегруппировки В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава. В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными). 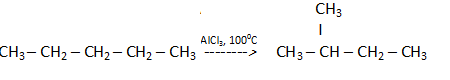 По молекулярности (определяется числом частиц на лимитирующей стадии): А) мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица): А → В + . . . К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например: СН3 – СООН → CH3COO- + H+ Б) бимолекулярные реакции - реакции типа А + В → С + . . . , в которых происходит столкновение двух молекул (частиц). Это самый распространенный тип элементарных реакций. В) тримолекулярные реакции – реакции, в которых происходит столкновение трех молекул. 2А + В → С + . . . По характеру разрыва химической связи: В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные. Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим: В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим: В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом. Радикалы – атомы, молекулы или группы атомов, имеющие неспаренный электрон. Электрофилы – катионы или нейтральные молекулы, имеющие свободные орбитали и предоставляющие их на образование связи. Нуклеофилы – анионы или нейтральные молекулы, имеющие неподеленную электронную пару и предоставляющие ее на образование химической связи. ОВР – отщепление и присоединение кислорода и водорода. Взаимное влияние атомов в молекулах органических соединений. Индуктивный и мезомерный эффекты. Молекула органического соединения представляет собой совокупность атомов, связанных в определенном порядке, как правило, ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности. Величины электроотрицательностей в значительной степени определяют такие важнейшие характеристики связи, как полярность и прочность (энергия образования). В свою очередь, полярность и прочность связей в молекуле в значительной степени определяют возможности молекулы вступать в те или иные химические реакции. Электроотрицательность атома углерода зависит от состояния его гибридизации. Это связано с долей s-орбитали в гибридной орбитали: она меньше у sр3- и больше у sр2- и sр-гибридизованных атомов. Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается в основном через систему ковалентных связей с помощью так называемых электронных эффектов. Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей. Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой . Атом, «оттягивающий» электронную плотность σ-связи в свою сторону, приобретает отрицательный заряд -. При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по σ-связи соответственно будет иметь равный по величине дефицит электронной плотности, т. е. частичный положительный заряд +, и будет называться электронодонором. Смещение электронной плотности по цепи s-связей называется индуктивным эффектом и обозначается I. Состоит в смещении электронной плотности вдоль линии σ-связей в молекуле к более электроотрицательному атому, при этом тем больше, чем сильнее различаются соседние атомы по своей электроотрицательности. Влияние осуществляется путем последовательной поляризации σ-связей и распространяется вдоль цепи связанных атомов по механизму электростатической индукции: F-δ ←C1+δ ←C2+δδ ←C3+δδδ Графически I-эффект обозначается стрелками (по σ-связи) в направлении смещения электронов. Фтор (ЭО 4,0), притягивая к себе электронную пару связи F-δ ←C1+δ, вызывает появление дефицита электронов на углеродном атоме (C1+δ). Это заставляет смещаться к этому углеродному атому электронную пару следующей связи C1+δ ←C2+δδ, что способствует появлению недостатка электронной плотности, но уже меньшего по величине (C2+δδ), у следующего атома углерода и т. д. Подобные смещения электронных пар распространяются далее по цепи простых σ-связей. Характерные черты индукционного эффекта. Все смещаемые электронные пары σ-связей остаются в своих первоначальных атомных октетах, изменения касаются лишь их положения относительно связанных атомов. Индукционный эффект оказывает воздействие на все атомы насыщенной цепи в одном направлении. В качестве стандарта для оценки индуктивного эффекта выбирают алканы, условно считая, индукционный эффект водорода равным «0». Атомам или группам атомов, оттягивающим на себя электронную плотность ковалентной связи, приписывают отрицательный индуктивный эффект (-I). Группы, смещающие электронную плотность ковалентной связи к более электроотрицательному атому, проявляют положительный индуктивный эффект (+I). Знак индукционного эффекта определяют по частичному заряду, который приобретает заместитель, вызывающий этот эффект. ЭО(х)< ЭО(Н)=2,1 < ЭО(У) +I(х) I(Н)=0 -I(У) Сила индукционного эффекта зависит от природы заместителя, а именно, его ЭА или ЭД свойств. Ярким примером индукционного эффекта, вызываемого различными заместителями, может служить изменение констант диссоциации карбоновых кислот. Экспериментальные данные позволяют сформулировать ряд закономерностей проявления I-эффекта: 1. чем больше электроотрицательность, тем сильнее – I-эффект.
2. Влияние нескольких заместителей суммируется. 3. С удалением заместителя от реакционного центра его влияние быстро падает, на четвертый атом он почти не влияет. Мезомерный эффект (эффект сопряжения, резонансный эффект). Мезомерный эффект (М-эффект)- поляризующее действие атомных групп, вызывающее статическую поляризацию сопряженной системы связей молекулы или иона. Сопряжение – тип электронного взаимодействия, осуществляющийся в молекулах, ионах, радикалах, в структуре которых имеет место чередование простых и кратных связей, или совокупности этих связей с атомами или группами атомов, содержащих неподеленные электронные пары, вакантные или частично заселенные валентные орбитали. М-эффект отмечается лишь в том случае, если атомная группа связана с sp2- или с sp-гибридизованным атомом углерода. М-эффект – это смещение -электронов сопряженных связей в сторону атомов с недостроенной до октета электронной оболочкой. Различают +М и –М-эффекты. Знак эффекта определяют по заряду, который приобретает заместитель, вызывающий этот эффект. Направление и величина М-эффекта зависят от ЭО заместителя, числа электронов, размера p-орбитали. М-эффект предполагает частичное перемещение электронных пар в соседние октеты В цепи, состоящей из атомов одного вида и построенной симметрично, М-эффект не имеет знака и вызывает большее или меньшее выравнивание электронной плотности на атомах цепи. Существует несколько видов сопряжения: ,- , p,-, ,-сопряжения (см. таблицу Виды сопряжения). Способы изображения М-эффекта. 1. Способ изогнутых стрелок. 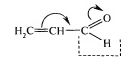 В ,- сопряженных системах происходит их смещение в область соседней одинарной связи; направление смещения зависит от ЭО атомов. В p,- сопряженных системах p-электроны НЭП смещаются от атома, которому они принадлежат в область соседней одинарной связи. В ,- сопряженных системах электроны (С(sp3)-Н)- связи смещаются в область соседней одинарной связи. В ,- сопряженных системах происходит их смещение в область соседней одинарной связи; направление смещения зависит от ЭО атомов. В p,- сопряженных системах p-электроны НЭП смещаются от атома, которому они принадлежат в область соседней одинарной связи. В ,- сопряженных системах электроны (С(sp3)-Н)- связи смещаются в область соседней одинарной связи.2.Способ резонанса. СН2=СН-С(Н)=0 -- +СН2-СН=С(Н)-0- (одинаковое расположение атомов, но различное распределение электронов; все структуры должны иметь одинаковое (наименьшее число неспаренных электронов)) Экспериментальные данные позволяют сформулировать ряд закономерностей проявления М-эффекта: 1. Практически не ослабевает по всей молекуле, даже если в ней несколько десятков атомов.
Электронная теория химической связи. Метод валентных связей. Г.Льюисом и В.Косселем (1916 г.) была предложена электронная теория химической связи. Согласно этой теории, ковалентная связь образуется за счет пары электронов, общей для двух связываемых атомов. Частица устойчива, если валентная оболочка элементов первого периода (Н) содержит два (правило дублета), а элементов второго периода (C, N, O, F) - восемь электронов (правило октета). Электронное строение органических соединений изображают с помощью электронных формул Льюиса. В них с помощью точек указывают положение всех валентных электронов: электронов химических связей и неподеленных пар электронов. При этом считают, что неподеленные пары электронов составляют часть внешней оболочки только одного атома, а электроны, участвующие в образовании ковалентной связи, являются частью внешней оболочки обоих атомов. Например, в приведенной ниже формуле Льюиса для тетрахлорметана все атомы имеют октет электронов. Для каждого атома в структуре Льюиса определяют формальный заряд. При этом полагают, что атому принадлежат все неподеленные электроны и половина электронов ковалентных связей. Избыток электронов, принадлежащих атому в молекуле по сравнению со свободным атомом, обусловливает отрицательный заряд, а недостаток - положительный заряд. Сумма формальных зарядов всех атомов дает заряд частицы в целом. 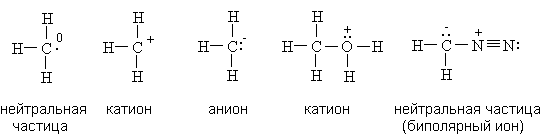 Теория Валентных связей (В. Гейтлер и Ф. Лондон). Образование химической связи между атомами является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов. Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула. Таким образом, проведенное исследование позволило сделать вывод, что химическая связь осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам. Разработанная на этой основе теория химической связи и для более сложных молекул получила название метода валентных связей. Важным положением является то, что всякий раз, когда химическая связь образуется, спины пары электронов должны быть антипараллельными. Это находится в соответствии с принципом Паули и подчеркивает, что при образовании химической связи электроны переходят в новое квантовое состояние. Наличие спаренных электронов является «индикатором» наличия химической связи, но не причиной ее образования. Изучение причины образования химической связи к настоящему времени показало, что энергия системы из двух атомов понижается тогда, когда электроны с большей вероятностью находятся в межъядерном пространстве (как бы «задерживаются» в этой области). Такая задержка приводит к понижению их кинетической энергии, в результате отрицательная составляющая полной энергии молекулы преобладает, молекула становится устойчивой или, как говорят, образуется химическая связь. Метод валентных связей дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул. Хотя этот метод не оказался универсальным и в ряде случаев не в состоянии правильно описать структуру и свойства молекул, все же он сыграл большую роль в разработке квантово-механической теории химической связи и не потерял своего значения до настоящего времени в качественном понимании природы химической связи. Основные положения метода валентных связей. Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах: Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар. Оба электрона общей электронной пары удерживаются одновременно двумя ядрами, что энергетически более выгодно, чем нахождение каждого электрона в поле «своего» ядра. Такая химическая связь является двухцентровой. При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R1 и R2), тем прочнее химическая связь. 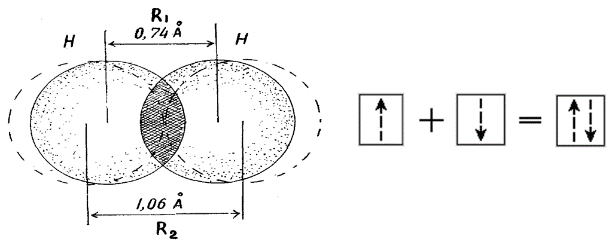 При образовании общей электронной пары спины взаимодействующих электронов должны быть антипараллельны (т. к. электроны с параллельными спинами отталкиваются, и связь не образуется). В образовании общих электронных пар по вышеописанному механизму могут участвовать только неспаренные электроны атомов (иначе говоря - только одноэлектронные облака). Например, изобразим образование молекулы F2 с помощью квантовых ячеек внешнего энергетического уровня (электронная формула атома F: 1s22s22p5):  Спаренные электроны внешнего уровня атома для образования химических связей с другими атомами должны разъединяться (распариваться). Атом перейдет в новое валентное состояние. Затрата энергии на такой процесс возбуждения атома компенсируется энергией, выделяющейся при образовании химической связи (следует помнить, что возможности возбуждения атомов ограничены числом свободных орбиталей в соответствующих энергетических подуровнях). Ковалентная связь обладает свойством насыщаемости, вследствие чего молекулы имеют вполне определенный состав. Например, при образовании молекулы метана СН4 каждый из четырех неспаренных электронов возбужденного атома углерода соединился с электроном атома водорода, образовались 4 ковалентные связи; больше электронных пар в данном случае образоваться не может, молекулы СН5, СН6 и т.д. не существуют. Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности). В зависимости от того, какими электронами осуществляются связи - s-, р-, d- или f-электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве. Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают σ- (сигма), π- (пи) и δ (дельта)-связи. Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра - это σ-связь; если облака перекрываются вне этой линии, возникают π- и δ-связи. Если между атомами возникла одна общая электронная пара (обычно σ-связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной. Теория гибридизации. Три валентных состояния атома углерода. Cтруктура молекул зависит прежде всего от вида и свойств тех орбиталей, которые атомы предоставляют для образования химических связей. Но, помимо этого фактора, на пространственное строение молекул влияет явление гибридизации орбиталей. Гибридизацией называется образование новых равноценных по форме и энергии орбиталей из орбиталей разного типа. Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости. На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp3-гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две - одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н2O в целом. Первое валентное состояние – sp3-гибридизация. В результате гибридизации с участием одной s и трех p орбиталей атома углерода образуются четыре эквивалентные sp3-гибридные орбитали, направленные к вершинам тетраэдра под углами 109,5о В состоянии sp3-гибридизации атом углерода образует четыре s -связи с четырьмя заместителями и имеет тетраэдричекую конфигурацию с валентными углами, равными или близкими 109,5о: 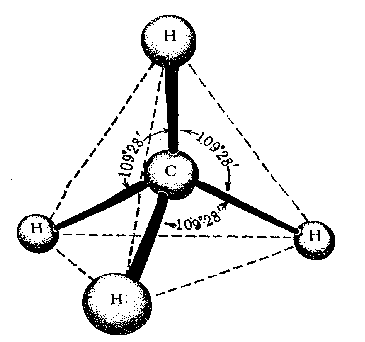 Второе валентное состояние – sp2-гибридизация. В результате гибридизации с участием одной s- и двух p-орбиталей атома углерода образуются три эквивалентные sp2-гибридные орбитали, лежащие в одной плоскости под углами 120о, а не участвующая в гибридизации p-орбиталь расположена перпендикулярно плоскости гибридных орбиталей. 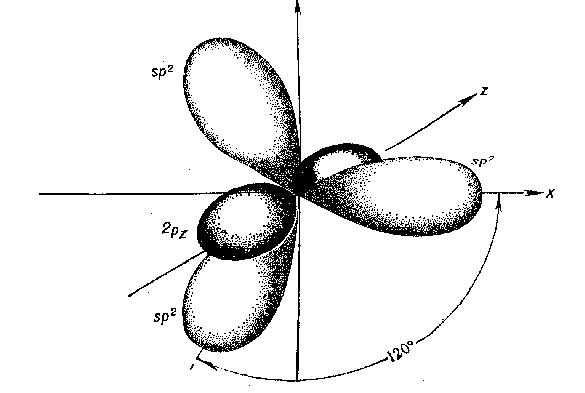 В состоянии sp2-гибридизации атом углерода образует три s -связи за счет гибридных орбиталей и одну p -связь за счет не участвующей в гибридизации p-орбитали и имеет три заместителя:  Третье валентное состояние углерода – sp-гибридизация. В результате гибридизации с участием одной s- и одной p–орбитали образуются две эквивалентные sp-гибридные орбитали, лежащие под углом 1800, а не участвующие в гибридизации p-орбитали расположены перпендикулярно плоскости гибридных орбиталей и друг другу. В состоянии sp-гибридизации атом углерода образует две s -связи за счет гибридных орбиталей и две p -связи за счет не участвующих в гибридизации p-орбиталей и имеет два заместителя:  Индуктивный эффект. Два вида индуктивных эффекта. См. 2.5.1 Индуктивный эффект. Влияние индуктивных эффектов на физические и химические свойства. Если мы имеем при каком-то углероде сильно электроотрицательный заместитель (-I-эффект), то он уже оттянул на себя электроны и образование карбкатиона у этого углерода становится невыгодно, значит нуклеофильный процесс по нему пойдёт плохо. Наоборот, если при нашем углероде имеется заместитель с +I-эффектом, то нуклеофилы будут его атаковать с удовольствием. Для электрофильных реакций всё строго наоборот. Мезомерный эффект. Типы сопряжений. См. 2.5.2 Мезомерный эффект. Влияние мезомерного эффекта на физико-химические свойства. Мезомерный эффект - это взаимодействие p-орбитали, на которой сидит заряд, с соседними π-связями. Точно так же, в зависимости от заместителя возможен как +M-, так и -М-эффект, который аналогичным образом приведёт либо к ускорению нуклеофильных процесов и замедлению электрофильных, либо наоборот к замедлению нуклеофильных и ускорению электрофильных. |
