Лекция. 7. Электрохимия. Принцип действия гальванических элементов (Элемент ЯкобиДаниэля)
 Скачать 148.5 Kb. Скачать 148.5 Kb.
|
|
Возникновение потенциала на границе металл-раствор Ме = Меn+ + ne (Me – ne = Men+) 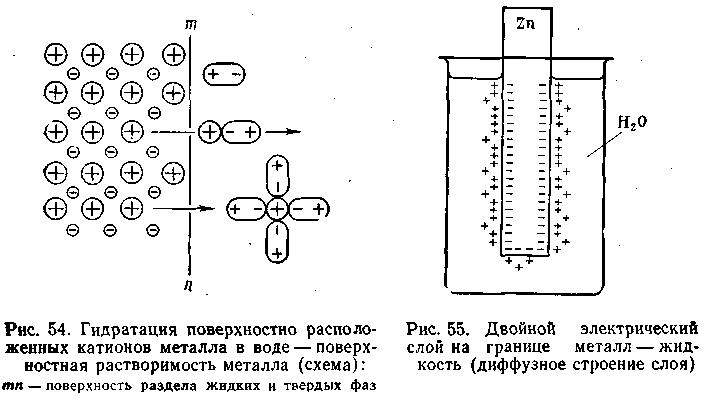 Fe + CuSO4(р-р) = FeSO4 + Cu Принцип действия гальванических элементов (Элемент Якоби-Даниэля) 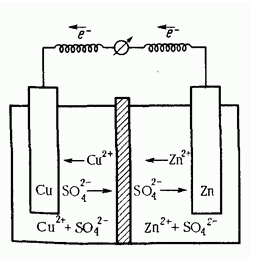 Zn | ZnSO4 || CuSO4 | Cu Анод (–): Zn0 = Zn2+ + 2e (окисление цинка) Катод (+): Cu2+ + 2e = Cu0 (восстановление меди) Zn0 + Cu2+ + 2e = Zn2+ + 2e + Cu0 (ионное уравнение) Zn0 + Cu2+ = Zn2+ + Cu0 (сокращенно-ионное уравнение) Zn + CuSO4 = ZnSO4 + Cu (молекулярное уравнение) В виде химической схемы данные процессы выглядят так:    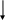 2е 2еА   (–) Zn | ZnSO4 || CuSO4 | Cu (+)К (–) Zn | ZnSO4 || CuSO4 | Cu (+)К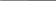 Электродвижущая сила (ЭДС): Е = φк – φа Уравнение Нернста: где Е0 – стандартный потенциал данного электрода (из таблицы); R – универсальная газовая постоянная (8,341 Дж/К·моль); Т – фактическая температура, К; n – число электронов, участвующих в элементарном акте; F – число Фарадея (96500), С – концентрация ионов соответствующей соли (моль/л). Принимая температуру раствора постоянной и равной 298,15 К, уравнение Нернста преобразуется следующим образом: 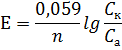 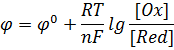 Поляризация гальванических элементов Zn | H2SO4 | Cu Zn0 = Zn2+ + 2e 2Н+ + 2е = Н2↑ Наиболее распространенные и перспективные гальванические элементы Марганцево-цинковый элемент (батарейка от карманного фонаря): 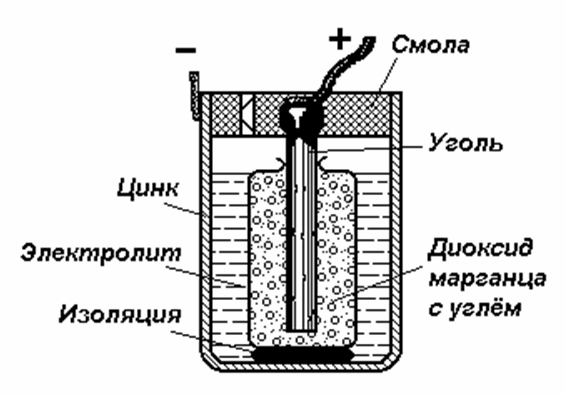 Химические процессы, протекающие при работе марганцево-цинкового элемента можно выразить так: А(–) Zn – 2e = Zn2+ (окисление) К(+) Mn4+ + 2e = Mn2+ (восстановление) MnO2 + Zn = MnO + ZnO Топливные элементы: 2Н2 + О2 = 2Н2О 2Н2 + 4ОН- = 4Н2О +4е О2 + 2Н2О +4е = 4ОН- Электролиз. Последовательность катодных процессов 2Н+ + 2е = Н2 Меn+ + ne = Ме Электролиз. Последовательность анодных процессов 2J- – 2е = J2 4ОН- – 4е = 2Н2О + О2↑ 2SO42- – 4е = 2SО3 + О2↑ Примеры электролиза Электролиз водного раствора хлорида натрия NaCl ↔ Na+ + Cl- H2O ↔ H+ + OH- К(–): 2Н+ + 2е = Н2 (восстановление) А(+): 2Cl- – 2e = Cl2 (окисление) 2Н+ +2Cl- = Н2 + Cl2 2Н2О + 2NaCl = H2 + Cl2 + 2NaOH Электролиз раствора серной кислоты К(–): 2Н+ + 2е = Н2 (восстановление) А(+): 2ОН- – 4e = 2Н2О + О2 (окисление) 2Н2О = 2Н2 + О2 Электролиз с растворимым анодом К(–) Cu2+ + 2e = Cu А(+) Cu – 2e = Cu2+ Законы электролиза (Законы Фарадея) m = KQ, где m – масса вещества, г; Q – количество электричества, Кулон (Кл); К – электрохимический эквивалент, г/кулон. Q = It, где I – сила тока, Ампер (А); t – время, сек. Э/К = 96500 Аккумуляторы 1) Кислотный свинцовый аккумулятор PbО | H2SO4 | PbO К(–) Pb2+ + 2e = Pb А(+) Pb2+ – 2e = Pb4+ Pb | H2SO4 | PbO2 К(+) Pb – 2e = Pb2+ А(–) Pb4+ + 2e = Pb2+ Pb + PbO2 = 2PbO Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 2) Щелочной железо-никелевый аккумулятор Fe | NaOH | Ni(OH)3 К(+) Fe – 2e = Fe2+ А(–) Ni3+ + e = Ni2+ Fe + 2Ni(OH)2 = Fe(OH)2 + 2Ni(OH)2 Коррозия металлов. Химическая и электрохимическая коррозия Fe | электролит | Cu Fe = Fe2+ + 2e Fe + Н2О(г) → Fe(OH)2 + H2O + O2 → Fe(OH)3 → Fe2O3·H2O Электрохимические способы защиты металлов от коррозии Fe | раствор | Zn Zn = Zn2+ + 2e 2Н+ + 2е = Н2 Fe = Fe2+ + 2e |
