производство ацитилена. курсовая. Производство ацетилена
 Скачать 238.57 Kb. Скачать 238.57 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное учреждение высшего образования «Омский государственный технический университет» Кафедра: Химическая технология КУРСОВАЯ РАБОТА по дисциплине «Химия и технология органических веществ» Тема: «Производство ацетилена»
Омск 201 ОГЛАВЛЕНИЕ
Введение Ацетилен НС = СН — бесцветный газ со слабым сладковатым запахом. Температура плавления—81,8°, температура возгонки— 83,6°С. Плотность по воздуху 0,9056, удельный вес при 0°С и 760 мм рт. ст. 1,1709 кг/м3. Основной метод получения ацетилена из карбида кальция дает возможность получить ацетилен высокой концентрации. Существенным недостатком этого метода является весьма значительный расход электроэнергии па получение карбида кальция (около 3000 квт-час на 1 тонну карбида, что соответствует около 10000 квт-час на 1 тонну ацетилена). В настоящее время перспективным является получение ацетилена из углеводородных газов нефтепереработки или из природного газа. Производство ацетилена из этих газов основано на крекинге их, требующем затраты большого количества энергии для создания высокой температуры. При этом ацетилен получается низкой концентрации и загрязненный гомологами. Применение такого ацетилена невозможно без выделения его из реакционной смеси и очистки. В промышленном масштабе используются электротермический крекинг метана и термический крекинг пропана. Большое внимание уделяется термоокислительному пиролизу метана, так как этот способ позволяет наиболее комплексно использовать природный газ. Электрокрекинг характеризуется высокими затратами в подсобных цехах, связанных с обеспечением этого производства. Без утилизации побочных продуктов электрокрекинга стоимость ацетилена значительно повышается. При технологическом оформлении метода встречаются трудности конструктивного порядка, связанные с применением высокой температуры. К достоинствам электрокрекинга относится возможность использования различных углеводородов газообразных и жидких. Термический крекинг требует меньше капитальных затрат и электроэнергии на единицу продукта. Расход основного углеводородного сырья по этому методу выше, чем при электрокрекинге, так как нагрев реакционных печей происходит за счет сжигания газообразного топлива или в виде процесса частичного окисления исходного сырья—углеводородов поступающих на крекинг. Существенное значение имеет вопрос подбора жароупорных материалов. Применение регенеративных печей с цикличностью их работы вызывает трудность при выдерживании режима на последующих стадиях процесса. Это же обстоятельство усложняет автоматизацию производства. Процесс частичного окисления исходного сырья—метана или термоокислительный пиролиз его базируется на дешевом сырье—природном газе. Конструктивно решен вопрос теплового воздействия путем проведения пиролиза в факеле горения. Многоканальные и одноканальные реакторы при промышленной и опытной эксплуатации показали, что термоокислительный крекинг имеет реальные перспективы для широкого промышленного применения. Экономическая целесообразность его во многом определяется рациональным использованием побочных продуктов—синтез-газа. 1. Теоретические основы процесса Ацетилен является важным исходным углеводородом для производства многих химических продуктов. За последние годы в ряде нефтехимических производств ацетилен заменяют более дешевыми этиленом и пропиленом. 1.1 Физические свойства алкенов При обычных условиях алкены С2 – С4 – это, газообразные вещества без цвета и запаха, С5 – С15 – бесцветные жидкости, начиная с С16 - твердые вещества. Алкены нерастворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси. По сравнению с алканами с тем же числом атомов углерода алкены алкены обладают немного более низкими температурами кипения и плавления. 1.2 Химические свойства алкенов По своим химическим свойствам алкены коренным образом отличаются от свойств предельных углеводородов. Наличие в молекуле двойной углерод-углеродной связи обуславливает характерные свойства олефинов: реакции электрофильного присоединения, окисления, полимеризации. 1. Реакции присоединения. Этим объясняется правило . Это правило выполняется, в частности, в реакциях гидрогалогенирования и гидратации алкенов. 1.1 Гидрогалогенирование. При взаимодействии алкенов с хлороводородом или бромоводородом образуются галогеналканы. Присоединение, как было подчеркнуто, протекает по правилу Марковникова: CH2=CH-CH3 + HBr → CH3-CHBr-CH3 1.2 Гидратация. При взаимодействии алкенов с водой в присутствии серной или фосфорной кислот, выполняющих роль катализатора, образуются спирты. Строение образующегося спирта также определяется правилом Марковникова: CH2=CH-CH2-CH3 + Н2О 1.3 Галогенирование. Алкены легко присоединяют молекулы галогенов (хлор, бром) с разрывом двойной связи и образованием дигалогенопроизводных: CH2=CH2 + Br2 → CH2Br-CH2Br Реакция может идти и в гетерогенной системе между газообразным или жидким алкеном и водным раствором брома (бромной водой), при этом бромная вода, имеющая желтую окраску, обесцвечивается. Эта реакция является качественной на непредельные углеводороды, в том числе и на алкены. 1.4 Гидрирование. Присоединение водорода по двойной связи у алкенов происходит при повышенных температуре и давлении в присутствии металлических катализаторов. Наиболее распространенным катализатором процессов гидрирования и дегидрирования является никель: CH2=CH-CH3 + H2 2. Реакции окисления. Характерным химическим свойством алкенов является их легкое окисление. 2.1 Горение. Как и любые другие углеводороды, алкены горят с образованием углекислого газа и воды: CnH2n + 3n/2O2 → nCO2 + nH2O 2.2 Окисление перманганатом калия. При взаимодействии алкена с водным раствором перманганата калия при комнатной температуре происходит обесцвечивание раствора: 3CH2=CH2 + 2KMnO4 + 4H2O → 3HOCH2-CH2OH + 2MnO2↓ + 2KOH Эта реакция была открыта в 1888 году русским ученым и носит его имя. В результате реакции Вагнера двойная связь разрывается, и оба атома углерода присоединяют по гидроксильной группе –ОН. Соединения такого класса называют гликолями. Это реакция также является качественной на двойную С=С-связь. Реакция окисления этилена имеет важное значение, так как этиленгликоль применяют для производства антифризов (жидкостей с низкой температурой замерзания), синтетического волокна лавсан, взрывчатых веществ. Если реакцию с перманганатом калия проводить в жестких условиях (кипящий раствор, кислотная среда), то происходит разрыв углеродной цепи по месту расположения двойной связи с образованием кетонов, карбоновых кислот или углекислого газа: CH2=CH-CH2-CH3 Эта реакция используется для установления положения двойной связи в молекуле алкена по продуктам окисления. CH3-C=CH-CH3 2.3 Каталитическое окисление этилена. В зависимости от применяемого катализатора в результате окисления этилена кислородом воздуха можно получить различные продукты. При использовании в качестве катализатора влажной смеси двух солей – хлорида палладия и хлорида меди (II) - получают ацетальдегид (Вакер-процесс): CH2=CH2 + O2 На сегодняшний день это наиболее распространенный способ получения уксусного альдегида в промышленности. При пропускании смеси этилена с воздухом над серебряным катализатором при температуре 150 – 3500С образуется оксид этилена, относящийся к классу эпоксидов: 2CH2=CH2 + O2 Оксид этилена широко используют в промышленности для получения эпоксидных смол, синтетических моющих средств, лаков, пластмасс, синтетических каучуков и волокон. 3. Реакции полимеризации. При повышенной температуре и давлении в присутствии катализаторов молекулы алкенов соединяются друг с другом вследствие разрыва двойной связи с образованием длинных цепочек: nCH2=CH2 1.3 Способы получения ацетиленовых углеводородов Обычным способом получения ацетиленовых углеводородов является действие спиртовой щелочи на дигалоидные производные предельных углеводородов, в которых оба атома галоида находятся или при двух соседних атомах углерода, или при одном и том же атоме: CH2Br-CH2Br → CH≡CH + 2HBr (Савич, 1861) CH3-CH2CHCI2 → CH3-C≡CH + 2HCI CH3-CH2-CCI-CH3 → CH3-C≡C-CH3 + 2HCI Так как дигалоидные соединения первого типа обычно получаются присоединением галоидов к этиленовым углеводородам, то эта реакция является реакцией превращения этиленовых углеводородов в ацетиленовые. Исходными веществами для получения дигалоидных соединений второго типа являются альдегиды и кетоны. Отщепление галоидоводорода может идти в две фазы, причем сначала получаются галоидные производные этиленовых углеводородов: CH2Br-CH2Br → CH2=CHBr + HBr CH2=CHBr → CH≡CH + HBr Сам ацетилен может получиться при высокотемпературном крекинге (термическом или электротермическом) метана и более сложных углеводородов: 2CH4 → H-C≡C-H + 3H2 Гомологи ацетилена можно получать алкилированием натриевых производных ацетилена галоидалкилированием или диалкилсульфатами, например: H-C≡C-Na + R-Br → H-C≡C-R + NaBr При электролизе щелочных солей некоторых двухосновных непредельных кислот ацетиленовые углеводороды образуются в результате распада аниона на аноде: CH-COO-Н 2. Производство ацетилена электрокрекингом. К числу существенных достоинств процесса получения ацетилена из газообразных углеводородов способом электрокрекинга следует отнести высокую степень использования сырья. Выход ацетилена на разложенный метан при этом достигает 45% вес. Другим, не менее важным, достоинством процесса является получение одновременно с ацетиленом значительных количеств водорода. Поэтому электрокрекинг углеводородов является методом одновременного получения ацетилена и водорода. Сырьем для получения ацетилена по описываемой схеме служит метан. Метан, разбавленный водородом под давлением 1,7 атм. ротационным компрессором подается через трубчатый подогреватель 1 в конвертор 2. В конверторе газ проходит через зону дугового разряда, температура которого достигает 1600°С . При этом протекает основная реакция: 2СН4 → С2Н2 + 3Н2— 92 ккал/г-молъ Возможно, что процесс протекает сложнее по уравнениям: 2СН4 → С2Н4 + 2Н2 — 56 ккал/г-молъ, 2СН4 → С2Н6 + Н2 — 14 ккал/г-молъ, С2Н4→ С2Н2 + Н2— 47,4 ккал/г-молъ, С2Н6→ С2Н2 + 2Н2 - 78,8 ккал/г-молъ. Побочной реакцией является СН4 → С + 2Н2—21 ккал/г-молъ. Реакционные газы из конвертора 2 проходят по трубе, охлаждаемой водяной рубашкой. Внутрь трубы впрыскивается вода для их усиленного охлаждения. Охлажденные реакционные газы проходят циклон 7, в котором осаждается часть образовавшейся сажи, небольшое количество смолообразных продуктов, получающихся в результате побочных реакций, и сконденсировавшаяся вода. Реакционные газы идут через холодильник 3, затем с температурой 40—50° через сажеуловитель 8 для отделения сажи и сконденсировавшейся воды, которые спускаются в сборник 9. Для окончательного отделения от сажи реакционные газы промываются в скруббере 4 маслом, поступающим на орошение скруббера из сборника 10. Очищенные реакционные газы сжимаются компрессором до 15 атм., проходят через буфер-маслоотделитель 11 и поступают в абсорбер 5, в котором ацетилен поглощается водой. Непоглощенные газы, состоящие в основном из водорода и непрореагировавшего метана, направляются в блок разделения газов. Часть водорода отделяется, а метан с частью водорода в отношении СН4: Н2 = 1 : 2 идет в виде циркуляционного газа в линию всасывания турбокомпрессора и, смешавшись со свежей порцией газа, поступает в систему. Вода с поглощенным ацетиленом дросселируется до атмосферного давления и подается в десорбер 6. Выделившийся сверху десорбера ацетилен направляется на сушку (на схеме не указана) и отправляется к потребителю. Горячая вода из куба десорбера охлаждается в холодильнике 12, собирается в сборнике 13 и центробежным насосом подается на орошение абсорбера 5 (рис. 1) Основные параметры производства Температура на входе газа в конвертор 800° С Температура в конверторе в зоне дугового разряда 1600° С Давление на входе в конвертор 1,7 атм. Температура газов на входе в циклон 150—200° С Соотношение СН4 : Н2 в поступающем в конвертор газе 1:2 Выход ацетилена от исходной смеси 15% Давление газовой смеси перед абсорбером 15—18 атм. Температура в абсорбере 30—40° С Давление в десорбере атмосферное Температура в кубе десорбера 80°С 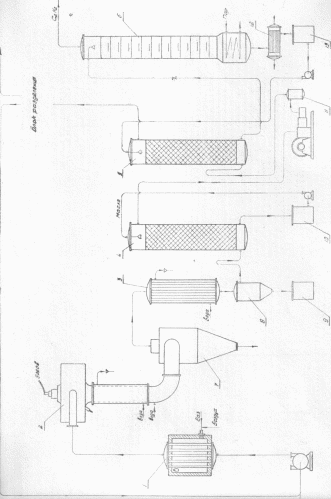 Рис. 1 3. Производство ацетилена термическим крекингом. Сырьем для производства ацетилена служит жидкий пропан. Термический крекинг требует меньше капитальных затрат и электроэнергии на единицу продукта. Расход основного углеводородного сырья по этому методу выше, чем при электрокрекинге, так как нагрев реакционных печей происходит за счет сжигания газообразного топлива или в виде процесса частичного окисления исходного сырья — углеводородов поступающих на крекинг. Основные параметры процесса Давление пропана на входе в испаритель 1 8,8 атм. Соотношение объемов газов, поступающих в смеситель 25—пропан : возвратный газ : пар =1:2:6 Давление в смесителе 37—40 мм рт. ст. Температура в центре печи 16 1100°С Давление в печи 15 мм рт. ст. Цикл работы печи 2 минуты: 1 мин. нагрев, 1 минута — крекинг Система проектируется и работает минимум с двумя печами Давление после вакуум-насоса 420 мм вод. ст. Температура после теплообменника 50°С Давление после компрессора 10,5 атм. Состав газов крекинга пропана после печи 16 С2Н2-10,0; СН4-15,0; Н2-55,7; N2—5,2; СО-6,9; С2Н4—3,8; СО2—1,6, прочие—1,8 объемных процента 4. Производство ацетилена из карбида кальция Один из основных способов получения ацетилена основан на реакции взаимодействия карбида кальция с водой. Карбид кальция СаС2 - твердое вещество кристаллического строения, имеющее в излометемно-серыйили коричневый цвет. Плотность химически чистого СаС2 при температуре 18 °С равна 2,22 г/см3. Реакция образования карбида кальция из окиси кальция и углерода является эндотермической и протекает при температуре 1900-2300°Спо уравнению: CaO+3C → CaC2+CO -452,5кДж/моль (108 ккал/моль) Для получения 1 кг СаС2 теоретически требуется затратить 7060 кДж теплоты или более 3000 кВт/час электроэнергии. Технический карбид кальция содержит 70—75%химически чистого СаС2,1.7—24%СаО и различные примеси: окислы магния, алюминия, железа, соединения серы, фосфора, ферросилиций, углерод и др. Карбид кальция чрезвычайно активно вступает во взаимодействие с водой, разлагаясь при этом с образованием газообразного ацетилена и гидроксида кальция (гашеной извести). Разложение карбида кальция водой протекает экзотермически: СаС2 + 2Н2О → С2Н2 + Са(ОН)2 + 127,4 кДж/моль Теоретически, количество ацетилена, получаемое при разложении 1 кг химически чистого СаС2, равно 372,5 л/кг. Практически же из 1 кг технического продукта получается 230-280л ацетилена. Экзотермичность реакции разложения карбида кальция создает опасность перегрева в зоне реакции. В связи с этим необходимо осуществлять ее при избытке воды и обеспечивать отвод теплоты реакции. Особенно опасны местные перегревы карбида кальция, так как при этом температура в месте его разложения может достигать 700-800°С. При такой температуре возможна полимеризация, разложение и взрыв ацетилена, особенно при попадании воздуха в зону реакции. Поэтому необходимо в месте разложения карбида кальция поддерживать температуру не выше 150 °С, при которой еще не начинаются процессы полимеризации ацетилена. При температуре 200 °С и выше может происходить разложение карбида кальция за счёт дегидратации гашеной извести: СаС2+Са(ОН)2 → С2Н2+2СаО Эта реакция протекает при недостатке влаги, поэтому может произойти сильный перегрев карбида кальция, куски которого будут покрыты плотной коркой гашеной извести. С уменьшением размеров частиц карбида кальция выход ацетилена понижается, что объясняется большим содержанием в мелком карбиде посторонних примесей (СаО и др.) Способ получения ацетилена из карбида кальция довольно громоздкий, дорогой и требующий затрат большого количества электроэнергии. Но при этом ацетилен имеет высокую концентрацию, в чём и состоит главное достоинство метода. 5. Производство ацетилена термоокислительным пиролизом метана Производство ацетилена осуществляется в многоканальном реакторе, выделение ацетилена производится адсорбцией селективным растворителем—диметилформамидом. Сырьем является природный газ, содержащий 92—95% метана и 95—99% кислорода. Сущность термоокислительного пиролиза метана заключается в том, что тепло, необходимое для реакции превращения метана в ацетилен, получается за счет окисления (сжигания) части метана. Основными реакциями термоокислительного пиролиза метана являются: СН4+0,5О2 ↔ СО+2Н2+6,1 ккал/г-моль, 2СН4 ↔ С2Н2+ЗН2—91,1 ккал/г-моль Быстрый вывод реакционной смеси из зоны реакции и резкое понижение температуры — закалка — способствует прекращению распада ацетилена, повышая его выход. Существенным является соотношение между количествами метана и кислорода. Процесс получения ацетилена возможно осуществить в многоканальном реакторе (способ Заксе), состоящим из смесителя, диффузора и горел очной плиты с большим числом каналов. Скорость движения исходных компонентов 15—50 м/сек. Этот способ получил пока наибольшее распространение. Одноканальные реакторы Гриненко имеют реакционную зону — капал—относительно малого диаметра. Скорость движения газов в зоне реакции равняется, 330—550 м/сек. Стабилизация пламени осуществляется путем подачи дополнительного кислорода через топочную камеру. Концентрация ацетилена в газах пиролиза составляет 8—10%, поэтому для дальнейшей переработки его необходимо выделить из этих газов Сущность термоокислительного пиролиза метана заключается в том, что тепло, необходимое для реакции превращения метана в ацетилен, получается за счет сжигания части метана. Быстрый вывод реакционной смеси из зоны реакции и резкое понижение температуры — закалка — способствует прекращению распада ацетилена, повышая его выход. Существенным является соотношение между количествами метана и кислорода. Основные параметры производства: Температура природного газа и кислорода перед входом в реактор: 500—600°С. Соотношение метан-кислород(по объему) 1,6 - 2,0:1 Давление газовой смеси перед реактором не более 0,4 атм. Температура реакционной зоны 1400 - 1500°С Состав газа после закалки (объемные %): С2Н2—8-9; СО2—3-4; СО— 24-26; Н2-54—56; СН4 - 4-6; О2- 0- 0,4; Температура газа на выходе из реактора около 180°С. Время пребывания смеси в зоне реакции 0,003 - 0,01 сек. Температура природного газа и кислорода перед входом в реактор 500—600°С. Соотношение между метаном и кислородом перед реактором (по объему) 1,6 - 2,0:1. Давление газовой смеси перед реактором не более 0,4 атм. Температура реакционной зоны 1400 - 1500°С. Состав газа после закалки в пересчете на сухой (в объемн. %): С2Н2—8-9; С02—3-4; СО—24-26; Н2-54—56: СН4—4-6; О2-0—0,4; прочих-1-7. Температура газа на выходе из реактора около 80°С. Время пребывания смеси галоп в зоне реакции 0,003 — 0,01 сек. Скорость газового потока в реакционном канале печи 15—50 м/сек. Давление и абсорбере 2 около 10 атм. Расход на 1 т 100% ацетилена: метана (на синтез) 6000 нм3 кислорода (100%-ного) 3280— 3430 нм3 На 1 г ацетилена получается синтез-газа до 11000 нм3 6. Извлечение ацетилена из реакционных газов ацетилен электрокрекинг метан пропан При получении ацетилена из углеводородного сырья образуются сложные газовые смеси, содержащие 5—10% С2Н2 (по объему). Предложенные в настоящее время способы выделения ацетилена (1) можно разделить в основном на четыре группы: 1) абсорбция водой (при давлении 18—20 атм.); 2) абсорбция селективными растворителями; 3) низкотемпературная абсорбция метанолом, аммиаком и ацетоном; 4) адсорбция ацетилена активированным углем в движущемся слое—гиперсорбция. Абсорбция водой. На первой стадии реакционный газ промывается маслом для отделения бензола, нафталина, части диацетилена и др. Затем реакционная смесь компримируется до 18—20 атм. и поступает на абсорбцию водой. Вместе с ацетиленом водой абсорбируется и углекислый газ. Десорбция ацетилена ведется четырехступенчатым дросселированием до первоначального давления. Затем ацетилен очищается от примесей (СО2, SО2). Очищенный ацетилен содержит 98—99% С2Н2 Схема этого метода сложна, очистка недостаточна, расход электроэнергии значителен. Абсорбция селективными растворителями. Из растворителей ацетилена для промышленного применения пригодны диметилформамид, бутнролактон, N —метилиирролидан, диметилсульфоксид и некоторые другие. Технологические схемы извлечения ацетилена из реакционных газов термического крекинга и термоокислительного пиролиз диметилформамидом наиболее разработаны и находят практическое применение, несмотря на их сложность и недостаточную очистку от С02. Низкотемпературная абсорбция метанолом, аммиаком или ацетоном. Реакционный газ предварительной промывкой щелочью освобождают от сажи и углекислого газа, сушат, промывают метанолом и абсорбируют ацетилен аммиаком при атмосферном давлении и температуре —70°С. Аммиак, содержащий растворенный ацетилен, подвергают разгонке для отделения его от ацетилена. Способ имеет то преимущество, что не требуется компримирования ацетиленовой смеси. Растворитель аммиак доступен и дешев. Извлечение ацетилена методом гиперсорбции опробовано на пилотной установке, имеются лабораторные данные , показывающие возможности использования этого метода в промышленном масштабе. Ацетилен из газов пиролиза в промышленном масштабе выделяют методом абсорбции с применением селективных растворителей. Абсорбционный метод основан на более высокой растворимости ацетилена в различных жидких абсорбентах по сравнению с растворимостью других компонентов газа. Первым абсорбентом, применявшимся в промышленности для выделения ацетилена, являлась вода и, несмотря на то, что вода обладает наиболее низкой растворяющей способностью, и поэтому требуется большой ее расход, она до сих пор еще используется для этой цели. Помимо воды для выделения ацетилена применяется ряд селективных растворителей: N-метилпирролидон, диметилформамид, метанол, ацетон, аммиак. Так, в одном литре воды при 20 0С растворяется около 1 литра ацетилена. Значительно выше растворимость ацетилена в органических жидкостях. При температуре 20 0С и атмосферном давлении она составляет в литрах на 1 л растворителя : в метаноле 11,2; в ацетоне 23; в диметилформамиде 32; в N – метилпирролидоне 37. Растворимость ацетилена в этих растворителях высока и увеличивается с понижением температуры. Однако понижение температуры процесса извлечения ацетилена ограничивается температурой плавления растворителя. Наряду с ацетиленом в абсорбентах растворяются и другие компоненты, но растворимость их значительно меньше, чем ацетилена. Процессы абсорбции могут осуществляться при нормальной или отрицательных температурах. Для абсорбции при нормальной температуре применяются малолетучие абсорбенты – диметилформамид и N-метил-пирролидон; для абсорбции при низких температурах – летучие абсорбенты: аммиак, метанол, ацетон. Наиболее распространенным абсорбентом является метанол. Чистота выделенного ацетилена превышает 99 %. Иногда требуется дополнительная его очистка от диоксида углерода аммиаком до концентрации не более 0,1 % (об.). 7. Применение ацетилена. 1) может применяться в качестве горючего при газовой сварке и резке металлов; 2) используется также для синтеза различных органических соединений; 3) в результате присоединения хлора к ацетилену получают растворитель – 1,1,2,2-тетрахлорэтан. Путем дальнейшей переработки тетрахлорэтана получаются другие хлорпроизводные; 4) при отщеплении хлороводорода от 1,1,2,2-тетрахлорэтана образуется трихлорэтен – растворитель высокого качества, который широко применяется при чистке одежды: СНСI = ССI2; 5) в больших количествах ацетилен идет на производство хлорэтена, или винилхлорида, с помощью полимеризации которого получается поливинилхлорид (используется для изоляции проводов, изготовления плащей, искусственной кожи, труб и других продуктов); 6) из ацетилена получаются и другие полимеры, которые необходимы в производстве пластмасс, каучуков и синтетических волокон. Производители ацетилена. Российские производители. В России незначительно увеличился объем производства ацетилена по итогам 7 месяцев 2016 г. В 2015 году общий объем производства ацетилена в РФ составил 34,384 тыс. тонн, что на 25.8% меньше по сравнению с аналогичным периодом прошлого года. Общий объем производства за январь-июль 2016 г. ацетилена составил 19,311 тыс. тонн, что на 1.4% больше по сравнению с аналогичным периодом прошлого года. В июле текущего года объем производства ацетилена составил 3,2 тыс. тонн, что на 3,4% больше по сравнению с аналогичным периодом прошлого года, и на 5,4% больше по сравнению с июнем текущего года. По итогам 2015 года львинная доля общего объема производства пришлась на АО «Невинномысский азот» - 33,625 тыс. тонн., что составляет 97,8% в структуре общего производства среди всех российских продуцентов. АО «Невинномысский азот» ОАО «Волгоградский кислородный завод» ОАО «Линде Уралтехгаз» ООО «Усть-Лабинскгазстрой» ОАО «Автогенный завод» Заключение Эффективность процесса выделения ацетилена имеет большое практическое значение в связи с тем, что около 70 % эксплуатационных расходов и капитальных затрат на производство ацетилена из углеводородного сырья падает на процесс выделения. В настоящее время весьма перспективными считаются низкотемпературные процессы абсорбции ацетилена, однако в промышленности не менее распространены процессы абсорбции при положительных температурах. Список литературы 1. , Остроумов . М., Дрофа, 2008; 2. Чичибабин начала органической химии. М., Госхимиздат, 1963. – 922 с.; 3. Лебедев и технология основного органического и нефтехимического синтеза. М., Химия. 1988. – 592 с.; 4.Андреев Д Н., Органический синтез в электрических разрядах, изд. АН СССР, 1953. 5.Андреев Д. Н., Применение электрических разрядов в химико-технологических процессах. Методы и процессы химической технологии. Сборник 1, изд. АН СССР. 1955. 6.Марковский Л. Я., Оршанский Д. Л., Прянишников В. П., Химическая электротермия, ГХИ, 1952. 7.Ньюленд Ю., Фогт Р., Химия ацетилена, Иниздат, 1947. 8. Производители (http://www.chemmarket.info/ru/news/view/31787/) |
